-
先天免疫细胞包括单核巨噬细胞、树突细胞及NK细胞等,在外周血中单核巨噬细胞来源丰富,并作为先天免疫反应抵御病原体第一道防线.外源及内源刺激如细菌均可诱导细胞炎性激活,引发细胞因子级联释放,触发炎症反应.脂多糖(Lipopolysaccharide,LPS)构成革兰氏阴性菌细胞壁主要毒力因子[1],也是致炎及先天免疫的诱因[2].脂多糖结合蛋白(LPS-binding protein,LBP)主要由肝脏合成、相对分子质量约为6×104大小,因具有与LPS结合能力得名,还能与活菌及病原体模式识别分子结合[3].它不仅表达于肝细胞,还包括呼吸道上皮细胞、肠道上皮细胞及人牙龈上皮细胞等[4-5].它属于先天免疫系统的核心分子,位于细胞Toll样模式识别受体4(TLR4)的上游,其N端结合革兰氏阴性菌LPS类脂A,形成LPS/LBP复合物,将其运送至白细胞分化抗原(CD14)并被其识别和结合,激活TLR4,启动胞内依赖髓样分化因子88(MYD88)和非依赖MYD88路径信号传导,促进IκB磷酸化和降解,刺激NF-κB活化,诱导早期促炎因子如IL-1β,IL-6和TNF-α释放,触发宿主先天免疫及炎症反应[6-9],严重时可致机体死亡.
研究发现,LBP可增强LPS对免疫细胞的诱导效应,其高表达水平与多种炎症疾病密切相关,可作为多种炎症疾病潜在生物标志物,如败血症[10]、类风湿关节炎[11]、脂肪代谢综合征[12-13]、帕金森[14]等,也可作为机体感染后外在表现指标.近来发现LBP基因多态性[15]和甲基化[16]亦与脂肪代谢、大肠杆菌感染等诊治联系紧密.一些涉及胃肠部位的炎症疾病如胰腺炎[17],可见非常高水平的LBP基因表达. Toddonio等[18]报道发现,LBP(-/-)基因敲除小鼠通过介导LBP/TLR4信号通路,对革兰氏阴性菌识别和致炎过程发生迟缓,导致LPS刺激后未能释放细胞因子,说明在该感染模型中LBP基因缺失对机体不利,LBP基因在抵抗细菌引起感染中是必需的. Sun等[19]报道发现,添加牛重组LBP蛋白可调节奶牛乳腺上皮细胞LPS致炎反应. Pretorius等[20]指出,添加合适浓度的LBP可能被用来防治2型糖尿病.而Fang等[21]发现LBP抑制肽(MP12和P1)阻塞LBP和CD14结合,进而导致NF-KB活性、促炎细胞因子TNF-α基因表达和蛋白分泌显著降低(p<0.01),抵抗LPS诱发大鼠炎症.类似地,最近报道指出新合成抗菌肽AWRK6在小鼠内毒素血症模型中可降低血清中IL-1β,IL-6和TNF-α水平,逆转LPS诱导TLR4高表达,改善机体肝脏和肺损伤,有效抑制LPS炎症反应[22]. Huang等[23]借助LBPshRNA质粒转染A549细胞,发现沉默LBP基因能抑制p38 MAPK和p65 NF-κB活化,从而改善LPS诱导大鼠肺损伤.总之,采用基因敲除、重组LBP蛋白、LBP抑制肽、LBPshRNA瞬时转染等方法研究该基因功能,虽在不同疾病模型中效果存在差异,但都可调控免疫炎症反应,在一定程度上降低促炎因子表达,从而削弱过度炎症,维持机体稳态.然而,目前多数有关LBP基因的功能研究仅局限于鼠与人,对大型家畜研究报道较少.
水牛(Bubalus bubalis)是我国南方具有重要经济价值的大型家畜[24],目前对影响其健康和生产力的病原体或寄生虫的免疫反应机制的研究进展十分有限,关于其基因功能注释信息及免疫疾病研究相对较少.由于免疫系统与黄牛及奶牛存在物种差异[25],免疫相关分子信息挖掘亟待开展,如Toll样受体、干扰素、细胞因子及受体等免疫分子信息大部分尚未解析.因此,为了深入了解水牛LBP基因在LPS致炎反应中的作用及其致炎信号传导分子调控机制,本研究以广西本地水牛外周血单核巨噬细胞为材料,利用慢病毒包装并感染原代单核巨噬细胞,研究体外靶向抑制水牛LBP基因表达对LPS诱导下炎症相关基因表达的影响,为探究LPS致炎分子机制提供理论基础及水牛抗病育种提供新的思路.
全文HTML
-
水牛外周血样采自广西大学牧场,雌性健康水牛3年龄,每头80 mL.由pSicoR-GFP,VSVG和NRF组成的慢病毒载体包装系统3质粒,293T细胞系、重组质粒pSicoR-GFP-LBPshRNA774(前期实验已验证该小RNA片段有抑制活性[26])、pSicoR-GFP-1864(NC阴性对照)均由本实验室保存.宿主菌为商品化大肠杆菌DH5α菌株.红细胞裂解液购自康为世纪公司. TRIzol Reagent购自Invitrogen公司. RIPM1640基础培养液,青链霉素混合液,FBS血清购自Gibco公司. LPS购自美国Sigma公司,Focill分离液购自STELL CELL公司. PCR引物由上海生工生物工程有限公司合成.牛细胞因子TNF-α和IL-1β的ELISA试剂盒购自南京奥青生物技术公司;SYBR Green PCR试剂盒和逆转录试剂盒购自美国Takara公司.
-
体外分离培养水牛原代单核巨噬细胞,置于37 ℃,5% CO2培养箱贴壁培养2~4 h后,洗去未贴壁细胞即可获得纯化的原代单核巨噬细胞,培养3~4 d,单核巨噬细胞鉴定采用墨汁吞噬实验和CD14特异性抗原免疫组化等,方法参见文献[27],细胞纯度和活性大于95%可用于后续实验. LBP-shRNA绿色荧光蛋白(GFP)慢病毒表达载体由本实验室设计合成,选取抑制效率最好者(基因位点774)[26]进行实验,阴性对照采用无序片段shRNA1864.慢病毒包装采用三质粒系统,磷酸钙法进行扩增并高速离心进行滴度浓缩.绿色荧光便于观察病毒感染效率.慢病毒感染原代单核巨噬细胞的具体方法:细胞接种于12孔板,约6×106个/孔,吸弃原培养上清液.每孔细胞中加入含慢病毒(MOI=300)的无血清培养液,置于37 ℃,5% CO2培养箱培养4~12 h,弃上清,换成含10% FBS+2.5%自体血清的培养液,继续培养5~7 d.最后,以终浓度为1 μg/mL LPS刺激6 h.收集细胞和培养上清液用于后续实验. LBP-shRNA774慢病毒感染水牛单核巨噬细胞实验分为6组:①空白组(Blank);② LPS刺激组(LPS);③ NC-shRNA1864组(NC);④ NC-shRNA1864+LPS组(NC+LPS);⑤ LBP-shRNA774组(774);⑥ LBPshRNA774+LPS组(774+LPS).实验各重复3次.
-
采用Trizol试剂提取细胞总RNA.以总RNA作为模板用于第一链cDNA的合成.引物设计借助Primer Premier 6.0软件设计,基因检测引物序列见表 1. Real-time PCR操作方法按试剂盒说明书进行.反应体系:Takara SYBR Green master mix (2×) 10 μL,正、反义链引物各0.5 μL,ROX solution 0.4 μL,DNA模板1 μL,加灭菌蒸馏水至20 μL.在ABI 7500仪器中按两步法进行扩增:第一步:50 ℃ 2 min,1个循环;第二步:95 ℃ 5 min,1个循环;95 ℃ 15 s,40个循环;60 ℃ 60 s,40个循环. GAPDH作为内参照.检测结束后,得到各样本的Ct值,用实验组减去该组内参的Ct值,得到ΔCt值;处理组所得ΔCt值减去正常对照组的ΔCt值,得到ΔΔCt值,再用2 -ΔΔCt计算出各组相对表达.
-
采用双抗体夹心酶联免疫技术检测细胞上清液TNF-α,IL-1β,操作过程按照南京奥青试剂盒说明书进行,每份标本取3个复孔,结果取均值.实验重复3次.
-
各目的基因的相对表达量采用ΔΔCt法计算,结果均用“平均值±标准差”表示,其中各基因表达量结果均经内参基因校正,数据采用SPSS 18.0统计软件进行t检验分析.
1.1. 主要实验材料
1.2. 慢病毒感染原代单核巨噬细胞方法
1.3. 荧光定量PCR(real-time PCR)验证
1.4. 酶联免疫反应(ELISA)
1.5. 数据统计分析
-
原代单核巨噬细胞培养24 h后,细胞完全贴壁,多数成长梭状或多边形,细胞边缘不平整,会伸展出伪足,呈不规则型.在干扰慢病毒感染指数MOI为300,感染持续7 d的条件下,利用荧光倒置显微镜观察细胞,发现细胞内表达大量绿色荧光蛋白,病毒感染效率约为60%(图 1).
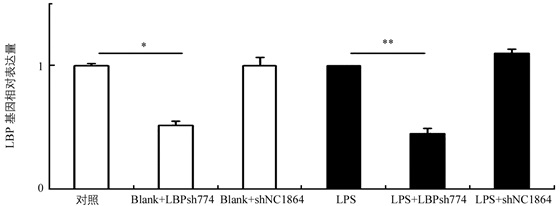
收取慢病毒感染细胞进行荧光定量PCR检测,结果发现与对照组比较,LBP shRNA774组可显著抑制内源性LBP基因表达,抑制率为49.2%(p<0.05);而在LPS诱导下,该组抑制率为58.9%,差异极具有统计学意义(p<0.01)(图 2).
-
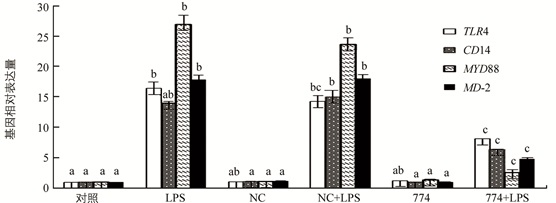
采用LBP shRNA慢病毒感染水牛巨噬细胞,收取各组细胞,采用荧光定量PCR方法检测LBP信号通路下游基因表达.结果发现,在LPS诱导条件下,LBPsh774+LPS组中TLR4,MYD88,CD14和MD-2基因表达均下调,且差异具有统计学意义(p<0.05);NC组、774组与对照组比差异不具有统计学意义(图 3).
-
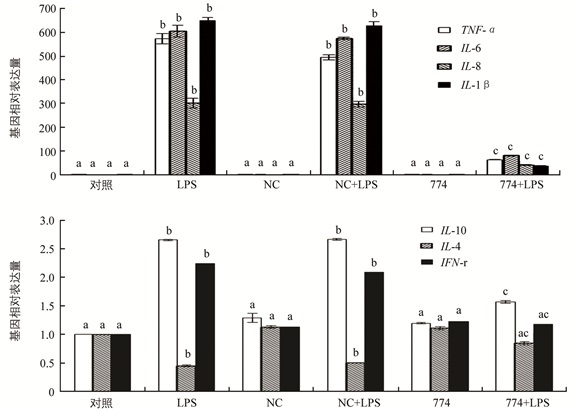
采用上述相同的方法,对LBP shRNA慢病毒感染后水牛巨噬细胞中的炎症细胞因子进行定量分析.结果表明,在LPS诱导条件下,LBPsh774处理组中的TNF-α,IL-6,IL-8,IL-1β等促炎细胞因子表达大幅降低,抑制LBP基因表达后,抗炎因子IL-4表达显著上升,IL-10及IFN-r基因表达显著下降(p<0.05)(图 4).
-
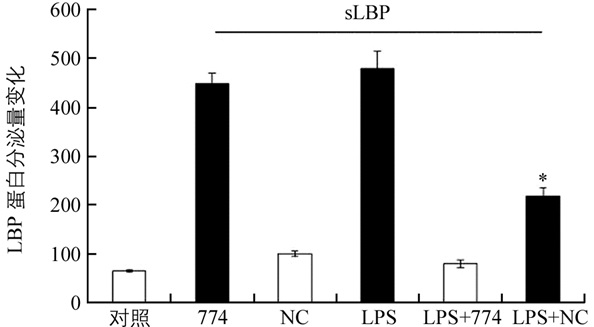
对各实验组水牛单核巨噬细胞中可溶性LBP蛋白分泌水平进行检测,经统计学分析发现,LPS刺激下LBPsh774干扰组样品中sLBP蛋白浓度为217.62 ng/mL,仅为LPS组(448.24 ng/mL)的48.54%,分泌量极显著降低(p<0.01),这与该基因定量PCR分析结果一致;NC组与对照组相比,sLBP蛋白量稍有上升,但差异不具有统计学意义(图 5).
-
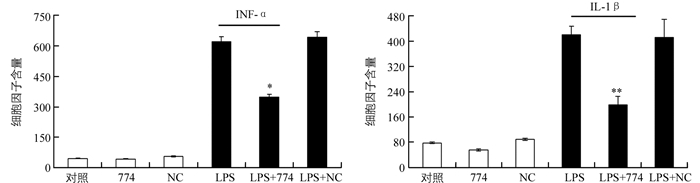
收集细胞上清液,采用ELISA方法检测实验各组细胞的TNF-α与IL-1β蛋白分泌量.结果表明,与LPS组相比,LBP基因沉默组(LPS+shRNA774)的促炎细胞因子TNF-α及IL-1β蛋白分泌量分别为(349.28±15.31) pg/mL[vs (623.92±36.23) pg/mL]和(198.39±26.85) pg/mL[vs (407.64±19.97) pg/mL],均显著降低.与对照组相比,NC组和774组差异不具有统计学意义(图 6).
2.1. LBP shRNA慢病毒感染细胞对目的基因抑制效果分析
2.2. 干扰LBP基因表达对其下游相关基因表达的影响
2.3. 干扰LBP基因表达对炎症细胞因子基因表达的影响
2.4. 干扰LBP基因表达对细胞分泌sLBP蛋白的影响
2.5. 干扰LBP基因表达对LPS介导的TNF-α与IL-1β蛋白分泌量的影响
-
单核-巨噬细胞对动物机体免疫至关重要,对其进行疾病及药物研究等意义重大.巨噬细胞来源于单核细胞,作为先天免疫系统的重要效应细胞,能识别和攻击外来入侵者.目前体外培养单核巨噬细胞技术已经比较完善,主要应用于免疫机制,疾病模型及治疗的药物靶点等机制研究,来源主要包括小鼠腹腔巨噬细胞、骨髓、小胶质细胞及鸡、羊、牛等外周血单核巨噬细胞等.由于人、鼠与大型家畜之间存在物种及组织差异性[28],故本研究采用水牛原代外周血单核巨噬细胞为材料.
LBP作为TLRs信号上游关键分子,调控炎症反应,与多种炎症疾病密切相关.目前有关LBP的绝大多数研究是以小鼠和人为对象,主要借助基因敲除小鼠、抑制肽、外源重组蛋白方法,未见有利用慢病毒介导的shRNA干扰技术研究LBP基因在水牛抗炎方面的报道.为此,本研究以水牛单核巨噬细胞为材料,采用慢病毒载体介导的RNAi技术抑制LBP基因表达,分析在LPS诱导条件下,LBP基因对LPS/TLR4信号通路相关基因表达的影响,为深入了解该基因在LPS跨膜信号传导及致炎过程中的分子机制奠定基础.
为了探讨在LPS诱导条件下,LBP基因沉默对水牛单核巨噬细胞TLR4信号通路关键基因表达的影响,采用荧光定量PCR方法检测了LBP,CD14,TLR4基因表达,发现干扰LBP基因表达后,CD14,TLR4,MYD88基因表达量显著降低,说明沉默LBP基因能有效抑制LPS/TLR4信号传导通路上游关键蛋白分子的表达,进而阻滞LPS信号传导. Ren等[29]发现,人源重组LBP蛋白可显著降低人牙龈纤维细胞IL-6及CD14表达,抑制大肠杆菌LPS诱导IL-1β,TLR2/4的表达,这与本实验结果基本一致.
细胞因子几乎涉及免疫和炎症的各个方面,在免疫应答和激活宿主防御网络中发挥重要作用,其活化后会发生应答级联反应.为了研究LBP基因沉默对TLR4信号传导通路下游炎症细胞因子表达的作用,我们定量检测了TNF-α,IL-6,IL-8,IL-1β等细胞因子的表达.发现干扰LBP基因表达,对LPS诱导的水牛单核巨噬细胞中TNF-α,IL-6,IL-8和IL-1β促炎细胞因子产生抑制效果,这与大多数报道发现的敲低或敲除LBP基因会抑制促炎相关细胞因子的表达、削弱疾病进程结果基本一致.不同的是,抗炎细胞因子IL-4表达显著上升,IL-10及IFN-γ基因表达显著下降.事实上,许多细胞因子同时具有促炎和抗炎潜力,由存在的免疫细胞和它们对细胞因子的应答状态来决定,对于IL-10和IL-10相关基因尤其如此,该家族高度多效.再者,巨噬细胞功能受局部组织环境和免疫应答类型的强烈影响,其功能极化对机体抗病原菌感染及损伤修复的质量和效率很关键[30].有报道指出,干扰素对猪巨噬细胞表型和功能具有调节作用,IFN-γ促进LPS诱导的IL-6和IL-12表达,增强促炎性的M1型巨噬细胞极化[30-31].笔者推测本实验中水牛IFN-γ基因表达降低,可能对LPS刺激巨噬细胞M1型极化造成削弱,抑制促炎因子基因表达,说明LBP基因沉默可抑制巨噬细胞炎性反应,维持细胞内稳态.鉴于物种之间的差异性,还需要深入探讨.
为了进一步研究LBP基因沉默对细胞因子蛋白分泌水平的影响,本实验中采用ELISA方法检测细胞上清液sLBP,TNF-α,IL-1β蛋白含量变化.发现相对于LPS组,IL-1β表达量极显著降低,sLBP,TNF-α含量也显著减少,说明干扰组可不同程度地削减促炎细胞介质及LBP蛋白分泌量,缓解炎症.目前在临床上,血清中sLBP作为多种炎症疾病如脓毒症[32]、子宫内膜炎[33]、帕金森[34]、多囊卵巢综合征[35]、肥胖[36-37]、癌症[38-39]预测诊断标志物,具有敏感性高、特异性强的优点,与疾病发生发展进程紧密联系. Bonsale等[33]发现,亚临床型子宫内膜炎组的泌乳荷斯坦奶牛子宫内膜组织中的TNF-α,IL-1β,CXCL8基因mRNA表达,以及血浆中TNF-α,sLBP蛋白平均浓度均高于健康奶牛组,这与我们的结果一致.由此可见,沉默水牛LBP基因对LPS刺激下的下游炎症相关基因核酸和蛋白水平均产生抑制效果,LPS/TLR4致炎信号传导受阻,可有效控制机体炎症损伤,维持机体稳态.
-
抑制水牛LBP基因表达对LPS诱导的单核巨噬细胞LPS/TLR4信号传导通路发挥抑制作用,显著降低促炎因子表达,LBP基因可作为靶基因进一步深入探讨其对水牛免疫应答的影响.




 下载:
下载: