-
白魔芋是天南星科(Araceae)魔芋属(Amorphophallus Blume)多年生宿根性草本植物,主要分布在亚洲和非洲的一些国家和地区[1],而我国主要栽培区域是南方各省的山地丘陵地区[2].魔芋富含人体所需的多种氨基酸和微量元素[3],是目前为止发现的唯一能大量合成葡甘聚糖的植物[4].而葡苷聚糖具有水溶性、增稠性等理化性质,以及改善脂质和糖类代谢、调节肠道功能等生理功能[5];此外,葡甘聚糖也常作为添加剂添加到保健食品中,尤其在现代“三高”人群日益增多的情况下,魔芋的功效就显得尤为显著.
目前,魔芋主要以球茎繁殖为主,用种量大,储藏、运输时极易受损伤,病菌感染几率增加[6-7].其次,魔芋长期无性繁殖,其种性严重退化,种芋长期带病菌栽培,导致抗病性下降,魔芋的品质及产量均受到严重影响[8].利用魔芋实生种子进行繁殖,不仅可以保持种性,发挥杂种优势,还可以减少病菌传播,提高繁殖系数[9].但是,在自然条件下,魔芋实生种子的休眠期较长,出苗率低且出苗不整齐[10],这成为魔芋实生种子栽培应用的主要限制因素,其原因尚不清楚.目前有关魔芋实生种子解除休眠的方法已有报道,彭凤梅[10]、李川[11]、陆红叶[12]等分别对解除魔芋种子休眠的方法进行了研究,但未对其作层积相关处理研究,且其休眠机制尚不清楚.本研究对白魔芋实生种子进行不同层积处理,探究内源激素的质量比变化对种子休眠与萌发的影响,了解魔芋实生种子的休眠特性,掌握休眠期间内源激素的变化规律,旨在对快速提高实生种子的发芽率提供理论依据,同时对实生种子栽培有一定的实践指导意义.
全文HTML
-
2016年12月采自四川省雷波县自然授粉的白魔芋实生种子.种子千粒质量为171.86 g,含水率为65.42%.
将刚采收的白魔芋实生种子洗去果浆、果皮后,于恒温干燥箱中35 ℃失水处理,失水10%左右后,用高温消毒处理后的干河砂分别进行4 ℃低温层积、室内常温层积和25 ℃暖温层积.层积处理前,即12月16日取材一次作为对照,之后每隔20 d随机取样一次,共取样6次,将取样后的种子迅速投入液氮中,然后置于-80 ℃超低温冰箱保存备用.
-
发芽试验前,用10%的NaClO溶液对种子浸泡15 min左右进行消毒处理.将处理后的种子均匀撒在培养皿中,3层滤纸作为发芽床,每皿30粒,3次质复.后置于25 ℃恒温恒湿培养箱中.发芽期间,保持滤纸湿润,每10 d喷洒一次多菌灵.每2 d统计种子发芽率.直到发芽结束.
-
种子在冰浴的磷酸缓冲液中漂洗,滤纸拭干,准确称取0.2 g~0.5 g,放入5 mL的匀浆管中.按质量(mg)与体积(mL)比为1:4的比例加入4倍体积的匀浆介质于匀浆管中,在冰浴条件下,快速剪碎种子.匀浆管下端置于冰水混合物中,将捣杆垂直插入套管中,上下转动研磨6~8 min,充分研碎,制成20%的匀浆液.接着用组织捣碎机以10 000~15 000 r/min的转速研磨制成20%组织匀浆,后进行镜检观察.将制备好的20%匀浆液用低温低速离心机以4 000 r/min的转速离心15 min,取上清液进行测定.测定方法采用酶联免疫法(ELISA),所用试剂盒购于上海优选生物公司.所有样品重复测定2次,取平均值.
-
所得数据用EXCEL作图并进行统计分析.
1.1. 材料及处理
1.2. 方法
1.2.1. 发芽率
1.2.2. 内源激素含量的测定
1.3. 数据统计
-
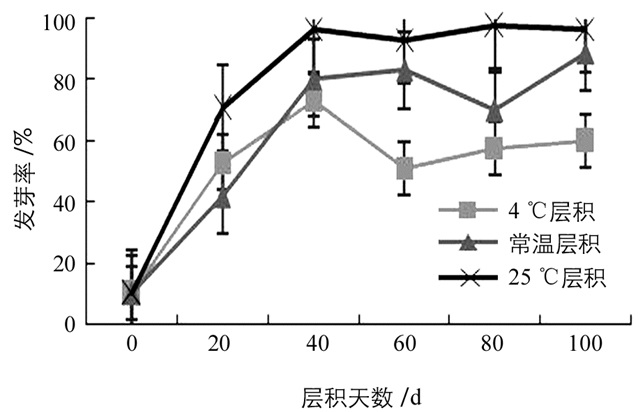
试验结果表明,白魔芋实生种子的发芽率在不同层积处理下存在差异.由图 1可知,未经层积处理的种子,其发芽率仅为10%;经过层积处理的种子,其发芽率有明显提高.其中,种子在4 ℃层积处理下层积60 d时,发芽率明显下降,且低于层积处理40 d的种子的发芽率.常温层积80 d时,发芽率有所下降,而在100 d时其发芽率又保持在一个较高水平.种子在25 ℃层积处理过程中,发芽率逐渐上升.以上结果表明,白魔芋实生种子经层积处理后均能有效解除种子休眠并促进萌发,在25 ℃层积处理下效果最好.
-
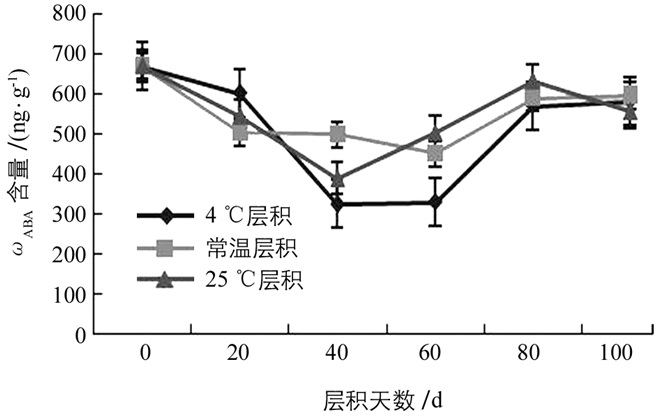
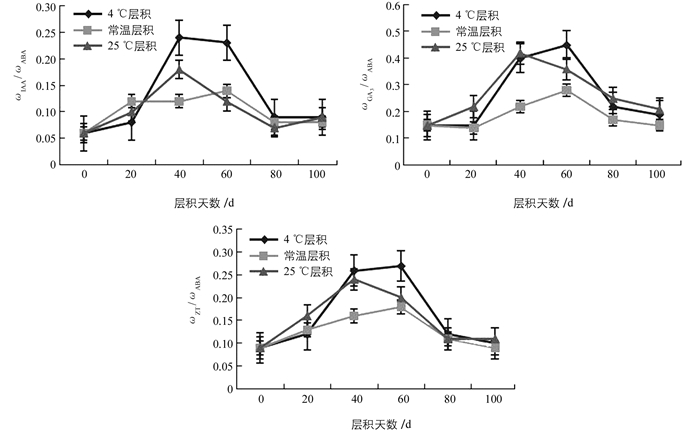
白魔芋实生种子中ABA质量比ωABA的变化呈现出“V”字型的变化趋势.在层积初期种子中IAA质量比ωIAA呈现出先明显下降,层积一段时间后,又明显上升的状态.由图 2可知,经层积处理后的种子其ωABA均低于对照.其中,4 ℃层积和25 ℃层积处理的种子其ωABA在层积处理40 d时达极值(326.17 ng/g和391.03 ng/g),分别是对照的0.5倍和0.6倍,常温层积处理的种子其ωABA在层积60 d时达峰值(452.54 ng/g),最小值是对照的0.7倍.在层积末期,经过不同层积处理的种子其ωABA均趋于一致.这3种不同层积处理中,4 ℃层积处理的种子其ωABA波动最明显,且峰值最小,而常温层积处理的种子ωABA波动最小.
-
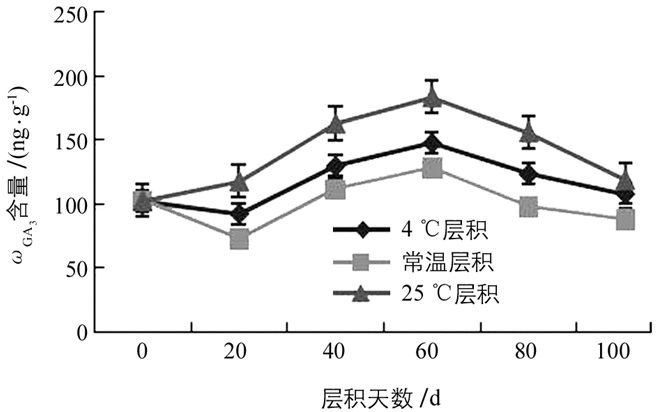
在不同层积处理过程中,白魔芋实生种子中GA3质量比(ωGA3)变化整体趋势是先逐渐升高,达到峰值后又逐渐降低的趋势(图 3).其中,4 ℃层积和常温层积在层积初期,种子中ωGA3下降至最低值(92.99 ng/g和73.19 ng/g),随着层积时间的延长,经层积处理的种子中ωGA3均升高,在层积60 d时达峰值(147.97 ng/g,128.8 ng/g和183.79 ng/g),分别是对照的1.4倍、1.3倍和1.8倍;在层积80 d时,ωGA3又逐渐降低,并在层积100 d时下降至与对照接近.这3种不同层积处理下,25 ℃层积处理的种子ωGA3在整个层积过程中均高于常温层积和4 ℃层积,而常温层积的种子中ωGA3在整个过程中处于最低值.
-
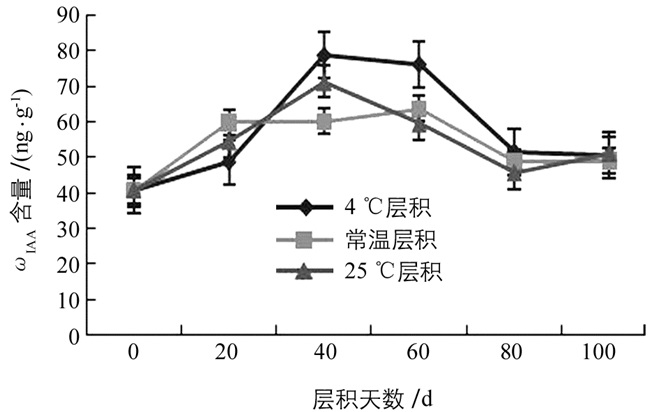
在层积过程中,从整体趋势看,不同层积处理下白魔芋实生种子中IAA质量比ωIAA变化是先升高后逐渐降低的趋势.在层积初期,ωIAA均是急剧升高,随着层积时间的延长,ωIAA达一峰值,接着ωIAA逐渐下降,在层积末期,ωIAA趋于平缓.由图 4可知,经过层积处理的种子中ωIAA均高于对照,其中4 ℃层积和25 ℃层积处理的种子中ωIAA均在层积40 d时达最大(78.83 ng/g和71.27 ng/g),分别是对照的1.9倍和1.6倍;常温层积处理的种子在层积60 d时ωIAA达最大(63.71 ng/g),是对照的1.8倍;在层积末期,不同层积方式下ωIAA无明显差异.在3种不同层积处理下,4 ℃层积处理的种子其ωIAA波动最大,且峰值最大,常温层积的种子其ωIAA波动最小.
-
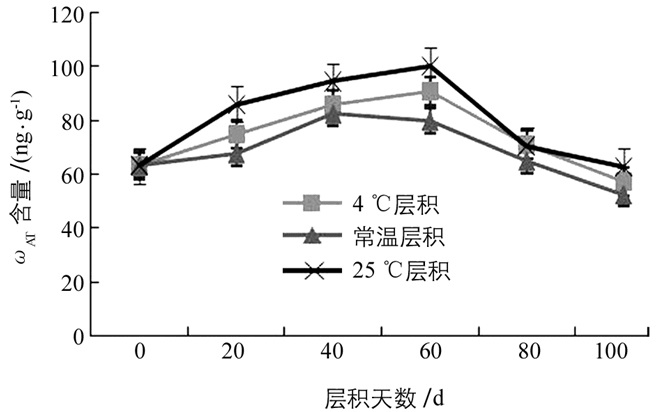
在层积处理中,白魔芋实生种子中ZT质量比ωZT的整体变化趋势是先逐渐升高,升高至一峰值后又逐渐降低的趋势.在层积初期,种子中ωZT逐渐升高,4 ℃层积和25 ℃层积处理的种子在层积60 d时上升至峰值(90.8 ng/g和100.15 ng/g),常温层积处理的种子在层积40 d时上升至峰值(82.45 ng/g),随着层积时间的延长,层积60 d时ωZT又逐渐降低,在层积100 d时均下降至最小值.由图 5可知,经过层积处理的种子中的ωZT在层积80 d前均高于对照(0 d),而在层积100 d时种子中的ωZT低于对照,分别是57.51 ng/g、52.52 ng/g、62.87 ng/g.在这3种不同层积处理下,种子中ωZT均呈显著性变化,其中,25 ℃层积处理的种子ωZT在整个层积过程中均高于常温层积和4 ℃层积,常温层积的种子中ωZT在整个过程中处于最低值.
-
随着层积时间的延长,不同层积处理下的种子中各激素含量的比值变化波动较大. ωIAA/ωABA,ωGA3/ωABA,ωZT/ωABA比值的变化趋势基本一致,在层积初期均逐渐上升,随着层积天数的增加,各激素比值均上升至一峰值,后逐渐下降(图 6).其中,ωIAA/ωABA比值的整体变化趋势与ωIAA的变化一致. 4 ℃层积和25 ℃层积处理的种子中ωIAA/ωABA比值在处理40 d时达最大,常温层积的种子中ωIAA/ωABA比值在处理60 d时达最大,但在层积结束时,ωIAA/ωABA比值处于一个较低水平.在4 ℃层积和25 ℃层积处理时ωGA3/ωABA和ωZT/ωABA比值均在处理60 d时达到峰值,后均逐渐下降至对照接近. 25 ℃层积处理时的ωGA3/ωABA和ωZT/ωABA在40 d时达到峰值.不同层积处理中种子的激素比值变化均是常温层积的波动最小,4 ℃层积和25 ℃层积处理的激素比值波动较大.由此可见,种子的休眠与萌发不仅与种子中内源激素的含量有关,还与各激素间的平衡关系有关.
2.1. 不同层积处理下白魔芋实生种子发芽率的变化
2.2. 白魔芋实生种子中ABA质量比的变化
2.3. 白魔芋实生种子中GA3质量比的变化
2.4. 白魔芋实生种子中IAA质量比的变化
2.5. 不同层积过程中种子中ZT质量比的变化
2.6. 白魔芋实生种子4种内源激素质量比的比值的变化规律
-
大量研究表明,激素对种子休眠的诱导和萌发的促进方面起着重要作用[13]. ABA作为种子休眠诱导的关键因子,主要通过促进种子贮藏蛋白和脂肪的合成,促进种子脱水耐性和种子休眠的诱导,从而抑制种子萌发[14].作为ABA的拮抗因子GA[15],它能促进核酸酶、蛋白水解酶等的表达,从而解除休眠,促进种子萌发[16].而IAA对种子的休眠同样有着有正向调控作用[17]. ZT是高等植物中存在的较多的细胞分裂素,有研究[18]认为,ZT能克服抑制物的作用,从而打破种子休眠,促进萌发.本研究中,种子中ωABA呈现先下降后逐渐升高,在层积结束时,ωABA低于对照的变化趋势,而ωGA3整体变化趋势呈现倒“V”型,先升高后逐渐降低,并在层积60 d时达峰值,在层积末期ωGA3高于对照,这可能是由于其增加了植物种子内部水解酶的合成,并对破损细胞膜进行了修复,从而提高种子的活力及发芽率[19]. ωIAA整体变化趋势是先升高后降低,与陆秀君[20]的试验结果类似,但在层积末期ωIAA高于对照,说明种子经过层积处理对于种子休眠的释放及萌发的促进有一定作用. ωZT的变化与紫椴种子[21]ωZT的变化一致,同样是倒“V”型,且在层积末期,ωZT高于对照.说明ZT具有抵消发芽抑制物质的作用,调控种子发育中的物质和能量代谢[22].
种子休眠的解除与萌发的过程中,不仅与某一类激素含量的高低有关,还取决于各激素直接的平衡关系[19].本研究中,ωGA3/ωABA,ωIAA/ωABA,ωZT/ωABA比值均呈现出先升高后逐渐降低的趋势,说明在这期间,种子中萌发促进物质与萌发抑制物质之间的平衡被打破,这对种子的休眠的解除有促进作用.种子在层积末期,ωGA3/ωABA,ωIAA/ωABA,ωZT/ωABA均较低,说明种子内含有较高ωABA可能是魔芋实生种子休眠的主要原因.在层积40~60 d时,各激素比值均达最大值,且4 ℃低温层积和25 ℃层积在层积40~60 d时,种子内ωABA值较小,而ωIAA,ωGA3,ωZT较大,种子休眠与萌发最关键激素ωGA3/ωABA比值也最大,说明此时有利于解除休眠,促进种子萌发.
综上所述,经过层积处理的种子,其促进种子萌发物质IAA、GA3、ZT均在层积一段时间后由一个峰值下降,而诱导休眠物质ABA在层积一段时间后下降至最低值后又上升,这可能是由于种子在层积40~60 d时休眠被解除,但继续层积,没有提供给种子适宜的环境萌发,导致种子进入了二次休眠.由种子发芽试验可知,经层积处理的种子发芽率均高于对照,其中25 ℃层积处理的种子有较高水平的发芽率.由此推断,25 ℃层积40~60 d时能有效破除魔芋实生种子的休眠,提高其发芽率.据此,本研究的结果可为魔芋实生种子的贮藏及实生苗的培育提供参考依据.



 下载:
下载: