-
猪圆环病毒Ⅱ型可引起断奶仔猪发生多系统衰竭、成年猪综合性肾病、成年猪坏死性肺炎、成年猪不孕不育、孕猪流产等多种疾病,对肉猪的繁殖饲养具有重大威胁[1-2]. 1974年,德国科学家首先发现了猪圆环病毒,经过大量的临床试验研究,不具有致病力的猪圆环病毒被称为Ⅰ型,具有致病力的猪圆环病毒被称为Ⅱ型[3-4]. 21世纪初,我国首次发现并从国内猪群中分离出了具有致病力的猪圆环病毒Ⅱ型.在短短的10多年时间里,我国已经成为猪圆环病毒Ⅱ型感染最为严重的国家之一[5].猪圆环病毒Ⅱ型不仅引发疾病的种类多,而且对两种性别、幼年到成年的猪均可感染,一旦感染发病率超过50%、致死率超过3%、个别区域的致死率最大达到40%[6].猪圆环病毒Ⅱ型的病毒粒子没有囊膜,粒子主要由核酸和衣壳蛋白构成,从形状上看呈现20面体的对称结构,直径大小为17个nm[7].从遗传特征上看,猪圆环病毒Ⅱ型的基因组是单股环状双向的DNA,其基因序列全长,或为1 767 bp或为1 768 bp[8].在世界各地发现的猪圆环病毒Ⅱ型,具有较为保守的遗传特性.从一些研究来看,猪圆环病毒Ⅱ型的核苷酸同源性介于93%~100%之间,这表明猪圆环病毒Ⅱ型核苷酸地域分布差异不明显[9-10].从组织亲嗜性来看,猪圆环病毒Ⅱ型的亲嗜性非常广泛,对于猪的淋巴结组织、心脏组织、肝脏组织、脾脏组织、肺脏组织、脑组织、胸腺组织、胰腺组织、肠管组织、膀胱组织都具有亲嗜性[11-12].感染后的猪体内,淋巴结组织和脾脏组织中的病毒含量最高.猪圆环病毒Ⅱ型一般通过消化道、呼吸道进入猪体内对淋巴细胞进行感染,这种感染会导致淋巴细胞的调亡进而损伤淋巴组织,白细胞随之减少、血清抗体无法有效中和病毒,最后病毒向猪体其他组织蔓延,从而导致临床症状的发生[13-15].因为个体差异、疫苗接种等因素,感染猪圆环病毒Ⅱ型的猪也可能不出现临床症状.感染猪圆环病毒Ⅱ型,一旦出现临床症状,猪的致死率将超过70%[16].本文将以猪圆环病毒Ⅱ型吉林株为研究对象,分析其对小鼠的致病力,并以此对猪圆环病毒Ⅱ型吉林株的致病力进行判断.
全文HTML
-
本次对于致病力的研究,主要针对笔者所在地区进行.因此,选取了吉林省4个县市的猪圆环病毒Ⅱ型病毒株,分别是磐石病毒株(PS0901)、蛟河病毒株(JH0901)、桦甸病毒株(HD0901)、舒兰病毒株(SL0901).在试验中还采用了猪圆环病毒Ⅱ型阳性血清和阴性血清,实验小鼠100只.所用的主要仪器包括荧光定量分析仪、超净工作台等.
-
选取5周大小的小鼠100只,分为5组,每组20只.其中,第1组小鼠注入浓度为2%的DMEM细胞培养液,第2组小鼠注入PS0901株细胞毒,第3组小鼠注入JH0901株细胞毒,第4组小鼠注入HD0901株细胞毒,第5组小鼠注入SL0901株细胞毒.病毒液的注入,采用腹腔注射方式为主,时间间隔周期为7 d,每隔7 d注射1次.第1组小鼠是其余4组小鼠的参照对象.
-
在小鼠第一次感染猪圆环病毒Ⅱ型吉林株后,对下一个注射周期内处死的小鼠,执行解剖处理并观察小鼠体内各个脏器的病变情况,包括肝脏组织、肺脏组织、脾脏组织、肾脏组织、肠道组织膜内淋巴结.对这些脏器组织采用TaqMan荧光执行定量的PCR检测,对检测结果进一步采用Eviews进行方差比较.
-
取出已经感染的小鼠各脏器组织进行石蜡切片制作,进一步经过染色处理便于各个脏器病理变化的观察.病理切片的制作过程为:①病理组织取材,组织大小设定为0.5 cm3;②病理组织固定,将病理组织投入到浓度为10%的甲醛溶液中固定处理24 h;③脱水处理,将固定好的病理组织脱水处理,分别采用浓度为30%,50%,70%,80%,95%的酒精处理;④透明化处理,采用二甲苯溶液对病理组织进行透明脱水处理;⑤浸蜡处理,将透明处理的病理组织分别放在一杯软石蜡和量杯硬石蜡中;⑥包埋处理,将浸蜡处理后的病理组织放置在包埋框中;⑦切片处理,将包埋后的病理组织蜡块运用切片机切成5~7 μm之间的切片;⑧贴片处理,让切片自然伸展后放在载玻片上烘干;⑨染色封装处理,将贴片处理的病理组织,采用二甲苯、各种浓度酒精、染色液执行脱蜡进水染色处理,进而盖上盖玻片完成封装,以备镜检.
2.1. 攻毒试验
2.2. 组织亲嗜性检测
2.3. 小鼠病理组织切片制作与观察
-
检测猪圆环病毒Ⅱ型吉林株的组织亲嗜性,分别考察小鼠肺脏、脾脏、肾脏3个部分的情况.
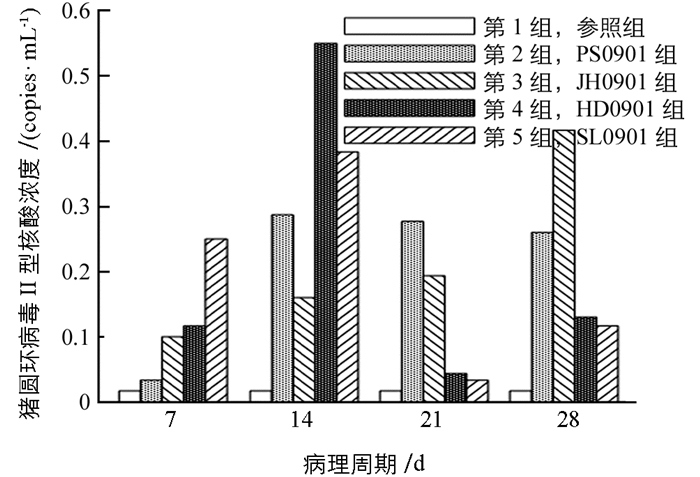
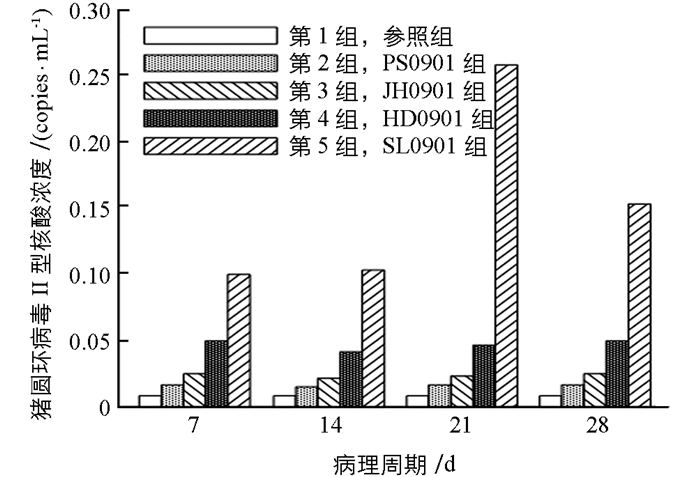
猪圆环病毒Ⅱ型吉林株对于肺脏组织亲嗜性的结果,如图 1所示.
图 1中分别显示了病毒感染后7 d,14 d,21 d,28 d,5组注入肺脏组织的病毒含量变化.从图 1中可以看出,SL0901组猪圆环病毒Ⅱ型的核酸浓度一直比其他3组高,并且在第21 d达到最大值,说明猪圆环病毒Ⅱ型吉林株SL0901对于小鼠肺部组织的亲嗜性最强.
猪圆环病毒Ⅱ型吉林株对于脾脏组织亲嗜性的结果,如图 2所示.
图 2中分别显示了病毒感染后7 d,14 d,21 d,28 d,5组注入脾脏组织的病毒含量变化.从图 2中可以看出,第4组HD0901、第5组SL0901猪圆环病毒Ⅱ型的核酸浓度都呈现出先升后降的趋势,随后又有一定程度升高.第2组PS0901猪圆环病毒Ⅱ型的核酸浓度先升后趋于平稳,第3组JH0901猪圆环病毒Ⅱ型的核酸浓度呈稳步上升的趋势.
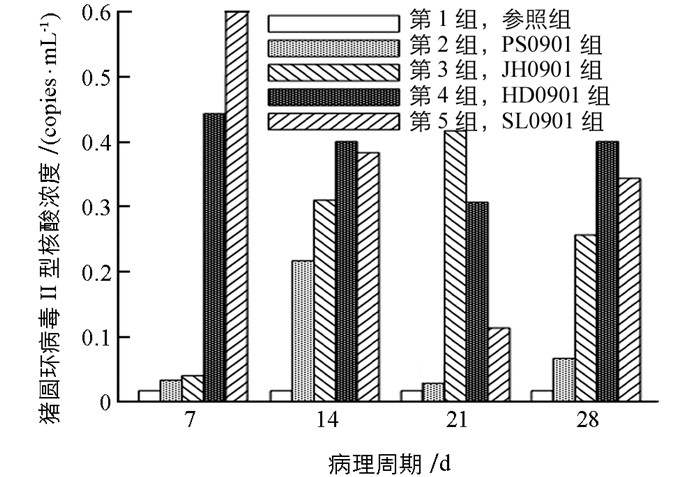
猪圆环病毒Ⅱ型吉林株对于肾脏组织亲嗜性的结果,如图 3所示.
图 3中分别显示了病毒感染后7 d,14 d,21 d,28 d,5组注入肾脏组织的病毒含量变化.从图 3中可以看出,第2组PS0901、第4组HD0901、第5组SL0901猪圆环病毒Ⅱ型的核酸浓度变化趋势接近,都在21 d最低,第3组JH0901猪圆环病毒Ⅱ型的核酸浓度则恰好相反,在第21 d达到最高.
-
分别对小鼠的脾脏和肾脏进行了H.E.染色观察.
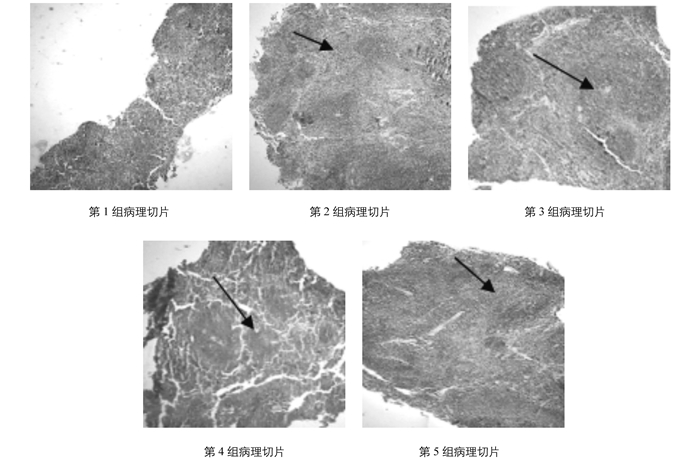
小鼠脾脏组织的5组切片结果,如图 4所示.
从图 4中可以看出,猪圆环病毒Ⅱ型吉林株对于小鼠脾脏组织的感染,大小及结构分布都表现得不均匀,并且出现了和小鼠脾脏小体融合的情况.其中,第2组PS0901、第3组JH0901出现的融合最为严重.
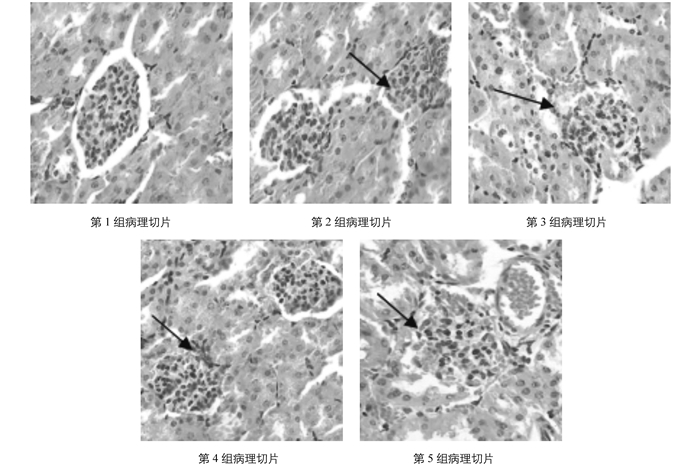
小鼠肾脏组织的5组切片结果,如图 5所示.
从图 5中可以看出,猪圆环病毒Ⅱ型吉林株对于小鼠肾脏组织感染,都造成了不同程度的细胞增生.第2组PS0901、第3组JH0901的情况最为严重,导致了较为明显的肾脏病变,包括肾小球囊腔出现萎缩、毛细血管出现破裂.
3.1. 组织亲嗜性
3.2. 病理组织切片结果
-
从组织亲嗜性来看,猪圆环病毒Ⅱ型的亲嗜性非常广泛,对于猪的多种组织具有亲嗜性,从而导致猪的某些脏器组织衰竭,诱发严重的疾病并导致高致死率.但是,猪圆环病毒Ⅱ型在不同地区的变种,以及侵入个体的不同会表现出一些差异.
本文重点考察了猪圆环病毒Ⅱ型吉林株的致病力影响,分别对比了磐石病毒株(PS0901)、蛟河病毒株(JH0901)、桦甸病毒株(HD0901)、舒兰病毒株(SL0901)的不同情况.通过一系列组织亲嗜性实验发现:
1) 猪圆环病毒Ⅱ型吉林株SL0901对于小鼠肺部组织的亲嗜性最强;
2) 猪圆环病毒Ⅱ型吉林株HD0901在第14 d时对于小鼠脾脏组织的亲嗜性最强;
3) 猪圆环病毒Ⅱ型吉林株SL0901在第7 d时对于小鼠肾脏组织的亲嗜性最强;
而从组织切片结果可以看出,猪圆环病毒Ⅱ型吉林株PS0901,JH0901一旦对脏器组织构成感染,其病变情况则更为严重,会出现肾小球囊腔萎缩、毛细血管破裂等病情.



 下载:
下载: