-
昆虫的肠道微生物种类和丰度会因食物、地域和生长发育等不同而出现差异,相同地域、相同食物的不同昆虫之间肠道微生物也会存在较大差异. Vanessa等人通过高通量测序研究表明,不同地区、不同环境下的果蝇肠道微生物的组成以及丰度存在差异,但主要优势菌属为乳酸杆菌属以及醋酸杆菌属[1].向芸庆等人通过传统培养的方法鉴定发现,从柘叶饲养家蚕肠道中分离出的优势菌群与桑叶饲养的家蚕相比,出现了较大差异且不如桑叶饲养家蚕的菌群丰富,并推测这种改变可能与柘叶饲养家蚕生长发育不良、容易患病具有相关性[2].此外邵勇奇课题组研究发现,家蚕、桑剑纹夜蛾以及桑螟3种以桑叶喂食的昆虫的肠道微生物的组成以及丰度都存在差异[3].
草地贪夜蛾(Spodoptera frugiperda),又名秋粘虫、行军虫,起源于美洲,被联合国粮农组织称为“全球重大跨国迁飞性农业害虫”,其食谱广泛,主要包括禾本科、菊科和豆科植物,于2019年初入侵中国并对中国的农业生产造成了巨大威胁[4-7].美国和巴西已经开展了草地贪夜蛾肠道优势细菌分离鉴定工作[8-9],但主要是对玉米地中的草地贪夜蛾肠道微生物进行的研究.本课题组前期研究对在重庆的巫山、巫溪、潼南等地区的玉米地捕捉的草地贪夜蛾进行了生物型以及肠道细菌鉴定分析,在巫山、巫溪地区分离得到了5个属的分离株,分别为克雷伯氏菌属(Klebsiella),不动杆菌属(Acinetobacter),假单胞菌属(Pseudomonas),肠杆菌属(Enterobacter)以及气单胞菌属(Aeromonas)[10-11].最近在重庆江津地区高粱地同时发现有少量草地贪夜蛾和大量玉米粘虫(Mythimna seperata)的存在,为我们研究取食同一食材的入侵昆虫与当地固有昆虫的肠道微生物提供了很好的素材.
本研究采集了重庆江津地区同一片高粱地中的草地贪夜蛾和玉米粘虫样本,通过传统培养法以及16S rDNA测序对草地贪夜蛾和玉米粘虫的肠道优势菌进行了初步分离鉴定,并对相同生境中两种昆虫肠道优势细菌类型进行了比较.同时我们也对不同食性的草地贪夜蛾肠道微生物优势菌进行了比较分析,以期为后续深入研究草地贪夜蛾核心肠道微生物群奠定基础.
全文HTML
-
草地贪夜蛾幼虫(5只)和玉米粘虫幼虫(24只)采自于重庆江津地区高粱地.
-
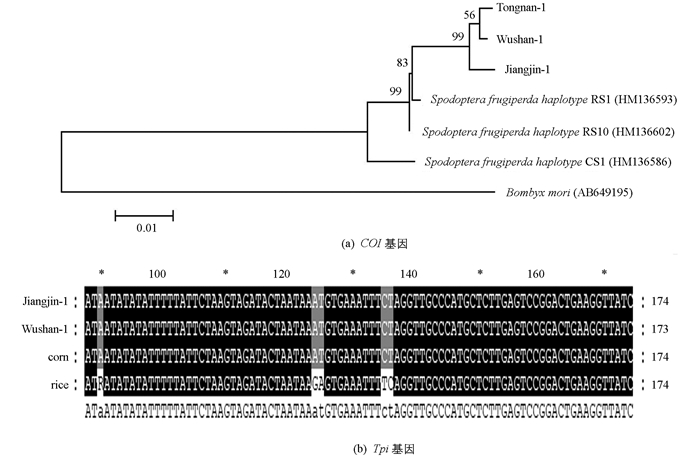
分别用COI和Tpi基因的引物对所提取的草地贪夜蛾基因组进行PCR扩增,扩增产物送华大基因科技股份有限公司测序,测序结果使用MEGA 6.0进行多重序列比对,剔除冗余的低质量序列后,进行进化树分析.根据COI和Tpi基因具有“水稻型”和“玉米型”的亚型,用ClustalX(1.83)软件分析所得序列的差异位点[7].
-
将采样得到的草地贪夜蛾幼虫和玉米粘虫幼虫分组,并喂食高粱叶饲养,收集粪便,加入1 mL灭菌的磷酸缓冲液(PBS)后震荡制取粪便原液;在超净工作台上解剖经酒精表面消毒的幼虫,取其中肠置于1.5 mL离心管中,加入1 mL灭菌的PBS,充分震荡制取肠道内容物悬液.
-
各取100 μL粪便原液与肠道原液分别加入900 μL PBS,梯度稀释,获得10-3-10-9稀释度的粪便液和肠液样本.取10-3-10-9稀释度的液体样本100 μL涂布于LB平板上,30 ℃培养箱培养24 h,36 h,48 h后,挑取不同形态的单菌落划线培养.
-
1) 吸取50 μL裂解缓冲液于PCR管中,挑取单菌落置于PCR管中.
2) 置于80 ℃水浴5 min充分裂解,吸取4 μL裂解液作为模板.
3) 用细菌通用引物27F和1492R进行PCR扩增,扩增反应体系如下:模板4 μL,引物27F/1492R各2 μL,1 ×TaqMasterMix(purple)42 μL. PCR反应程序为96 ℃,10 min;96 ℃,30 s;55 ℃,30 s;72 ℃,1 min 30 s,30个循环;72 ℃,10 min. PCR产物送至华大基因科技股份有限公司测序.
-
将得到的测序结果在NCBI(https://www.ncbi.nlm.nih.gov)中进行序列比对,下载同源性较高的序列,使用MEGA 6.0进行多重序列比对,并进行进化树分析.同时将获得的16S rDNA基因序列在RDP数据的Classifer程序(https://rdp.cme.msu.edu/classifier/classifier.jsp)中进行比对,获得同源性较高序列的相关信息.
1.1. 实验材料
1.2. 草地贪夜蛾的生物型鉴定
1.3. 草地贪夜蛾幼虫和玉米粘虫幼虫粪便及中肠内容物的收集
1.4. 肠道细菌的分离
1.5. 肠道细菌的分子鉴定
1.6. 数据分析
-
为了确定收集到的江津地区草地贪夜蛾的生物型,分别扩增草地贪夜蛾线粒体细胞色素C氧化酶亚基I基因(cytochrome c oxidase subunit I,COI)和磷酸甘油醛异构酶基因(triose phosphate isomerase,Tpi).分析测序结果发现,江津地区草地贪夜蛾COI基因为“水稻型”,Tpi基因为“玉米型”(图 1).
-
草地贪夜蛾与玉米粘虫肠道样品最佳稀释倍数为10-3,粪便样品的最佳稀释倍数为10-6.分别挑取不同大小、形态的单菌落划线培养,共分离得到19个菌株.将测序得到16S rDNA序列导入Blastclust做同源聚类分析,同源性大于97%为一个聚类单元,共得到了12个分类单元(表 1).
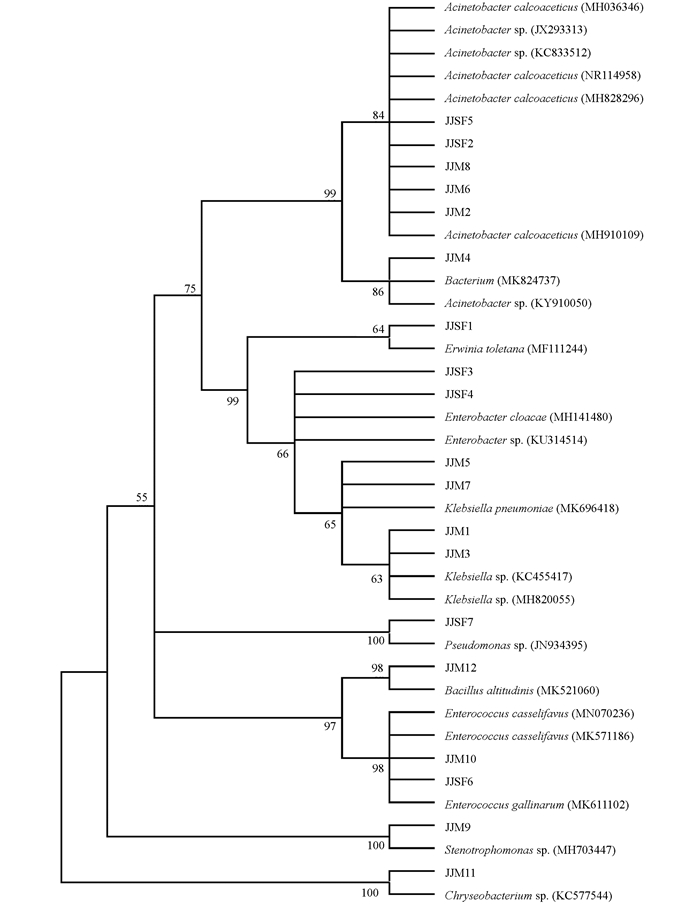
所得的测序结果导入NCBI及RDP数据库中进行比对分析,这19个细菌分离株的系统发育树归到了9个属,其中草地贪夜蛾分离株中,JJSF1分离株属于欧文氏菌属(Erwinia);JJSF2,JJSF5分离株属于不动杆菌属(Acinetobacter);JJSF3,JJSF4分离株属于肠杆菌属(Enterobacter);JJSF6分离株属于肠球菌属(Enterococcus);JJSF7分离株属于假单胞菌属(Pseudomonas).玉米粘虫分离株中,JJM1,JJM3,JJM5,JJM7分离株属于克雷伯氏菌属(Klebsiella);JJM2,JJM4,JJM6,JJM8分离株属于不动杆菌属(Acinetobacter);JJM9分离株属于寡养单胞菌属(Stenotrophomonas);JJM10分离株属于肠球菌属(Enterococcus);JJM11分离株属于金黄杆菌属(Chryseobacterium);JJM12分离株属于芽孢杆菌属(Bacillus).其中不动杆菌属分离株在聚类分析中分为了2个分类单元,肠杆菌属分为了2个分类单元,肠球菌属分为了2个分类单元.在所有草地贪夜蛾的分离株中,各个分类单元比例较为均衡.而在玉米粘虫的分离株中,克雷伯氏菌属和不动杆菌属占最大比例(33.3%).
为了进一步分析草地贪夜蛾与玉米粘虫肠道优势菌群的联系,对分离到的19株菌株进行系统发育树分析.结果显示,江津地区草地贪夜蛾与玉米粘虫肠道细菌组成差异较大.其中,欧文氏菌属和假单胞菌属仅在草地贪夜蛾中分离到,克雷伯氏菌属、金黄杆菌属和芽孢杆菌属仅分离自玉米粘虫(图 2).值得注意的是,尽管JJSF2和JJSF5,JJSF6和JJM10被分为了2个OTU,但它们在进化树上聚到了一枝,说明其在进化上差异不大.
-
为了探究食物的差异对草地贪夜蛾肠道细菌组成的影响,初步比较了江津地区以高粱为食的草地贪夜蛾与巫山、巫溪以玉米为食的草地贪夜蛾肠道细菌的组成,并以江津地区玉米粘虫肠道细菌作为参照,构建系统发育进化树.通过系统发育进化树可以发现,江津地区以高粱为食的草地贪夜蛾的肠道细菌组成与巫山、巫溪地区以玉米为食的草地贪夜蛾肠道细菌组成有相似性,但也有一定的差异(图 3).至本成果投稿为止,我们尚未在江津地区的草地贪夜蛾肠道中分离出克雷伯氏菌属,而克雷伯氏菌属在巫山、巫溪地区的草地贪夜蛾肠道中广泛存在.此外,仅在江津地区的草地贪夜蛾肠道中分离培养得到了欧文氏菌属.尽管存在着一定的差异,但江津地区的草地贪夜蛾与巫山、巫溪地区草地贪夜蛾肠道细菌也有相似之处,如都存在不动杆菌属(JJSF2,JJSF5,WS12和WX21)和假单胞菌属(JJSF7,WS3,WS4,WS15),这些结果说明,虽然草地贪夜蛾的肠道细菌组成会受到食物和环境因素的影响,但有一些类型的细菌则在不同地区的草地贪夜蛾内普遍存在.
2.1. 江津地区草地贪夜蛾生物型鉴定
2.2. 高粱地草地贪夜蛾与玉米粘虫肠道细菌分子鉴定
2.3. 以高粱为食的草地贪夜蛾肠道细菌与以玉米为食的草地贪夜蛾肠道细菌比较
-
肠道微生物在宿主的生长发育、生理状态和行为特征上起着重要的作用.在果蝇的肠道微生物研究中发现,果蝇共生菌植物乳杆菌可以通过胰岛素信号通路促进果蝇的生长发育,还可以通过与神经元的相互作用调控果蝇的运动,其肠道菌群的稳定对果蝇的寿命也有一定的影响[12-14].此外,肠道菌群可以促进宿主对食物的吸收利用[15],而饮食差异也会对宿主肠道微生物组成造成一定的影响[16].草地贪夜蛾是一种食性比较广的杂食昆虫,研究取食不同植物的草地贪夜蛾肠道微生物菌群差异,对于分析草地贪夜蛾的核心微生物群,阐明肠道微生物在草地贪夜蛾生长发育中的作用均具有重要的意义.
本文基于细菌培养结合16S rDNA测序的方法对重庆江津地区以高粱为食的草地贪夜蛾和玉米粘虫的肠道优势细菌进行了鉴定.在草地贪夜蛾的肠道中,共分离得到了7个分离株,属于5个属,包括欧文氏菌属、不动杆菌属、假单胞菌属、肠杆菌属和肠球菌属.在玉米粘虫的肠道中,共分离了12个分离株,属于6个属,包括克雷伯氏菌属、不动杆菌属、寡养单胞菌属、肠球菌属、金黄杆菌属和芽孢杆菌属.在已有的玉米粘虫肠道微生物报道中,肠球菌属、假单胞菌属、肠杆菌属等是玉米粘虫的肠道优势菌群[17],与我们的结果有一定的出入.有报道指出,食叶昆虫从土壤中获取肠道微生物,而不是植物[18].但我们的分离鉴定结果显示,虽然草地贪夜蛾和玉米粘虫生长在相同环境,取食对象相同,但他们的肠道细菌组成差异较大,仅有不动杆菌属和肠球菌属在二者的肠道中都存在.
随后,我们将江津地区的草地贪夜蛾肠道细菌与巫山、巫溪地区草地贪夜蛾肠道细菌进行比较,发现其肠道微生物组成有着一定的差异,在此前巫山、巫溪采食玉米的草地贪夜蛾的肠道细菌分离中,分离到了大量克雷伯氏菌属[8],而在江津采食高粱的草地贪夜蛾幼虫肠道中却没有分离到,但在同一生境下,玉米粘虫的肠道内却又分出了克雷伯氏菌,有可能与本次获得的取食高梁的草地贪夜蛾样本过少有关.在江津地区的草地贪夜蛾肠道中,第一次分离到了欧文氏菌.美国学者在宾夕法尼亚州的草地贪夜蛾中分离得到了克雷伯氏菌属,但在巴西对农药抗性的草地贪夜蛾中没有分离得到[3].
我们通过纯培养的方法分离得到了取食高粱的草地贪夜蛾和玉米粘虫的肠道优势细菌,初步探究了食物对草地贪夜蛾肠道细菌组成的影响,证明草地贪夜蛾肠道细菌组成会受到环境的影响,为后续研究奠定了基础.但细菌的纯培养受到了诸多因素的限制,如细菌的最适生长条件,培养基偏好性等因素,对肠道优势菌的鉴定造成了一定的影响.因此,我们将在后面的工作中结合细菌培养和16S rDNA测序、宏基因组测序的方法,以便更好地揭示微生物群落结构和多样性的组成,确定肠道优势菌群.



 下载:
下载: