-
普洱茶是以云南大叶种茶树[Camellia sinensis (Linn.) var. assamiea (Masters) Kitmaura]晒青茶为原料,经后发酵等工序加工而成的茶叶产品,具有汤色红浓明亮、滋味醇厚回甘、陈香显著等风味品质特点[1].除风味独特外,国内外研究还报道其具有降脂减肥、抗氧化、抗菌、抗突变、保护神经损伤、保护肝脏、抗疲劳和抗辐射等保健功能或生物活性[2-3].由于独特的风味和良好的保健功能,普洱茶在国内外有着较好的市场,不仅是云南茶叶的特色优势产品和最重要的组成部分,也是我国重要茶叶品种之一[4].
后发酵是普洱茶加工的关键工序,是形成其品质特征和保健功能的核心步骤[5].目前,普洱茶的后发酵一般是将晒青毛茶加入适量水分,混匀、渥堆,根据发酵进程,经过数次潮水、翻堆的过程[6].从微生物学角度来看,这是一个固态发酵(Solid state fermentation)过程.固态发酵是指微生物在没有或几乎没有游离水的培养基质上生长的过程[7].传统固态发酵食品有白酒、酱油、醋、豆豉、腐乳等,现代固态发酵技术生产的产品扩展至酶制剂、有机酸、风味调料、食用菌和功能性食品等[8].但是目前普洱茶的固态发酵采用数吨至数十吨茶叶渥堆的方法,存在茶叶基质热传递困难的问题,亟待改变.
为了解决传统渥堆普洱茶固态发酵存在的问题,课题组建立了PLC系统控制发酵室温度、湿度的浅盘发酵(25kg茶叶)普洱茶发酵系统[9].为评价该系统发酵普洱茶的可行性,本研究以同一批次晒青茶为原料分别进行了传统渥堆和浅盘发酵,并利用高通量测序技术分析比较发酵过程中微生物群落结构和化学成分的异同,为后期采用浅盘发酵方式发酵普洱茶提供理论依据和指导.
全文HTML
-
普洱茶发酵样于2017年10月28日-12月30日在云南省普洱茶树良种场开展.传统渥堆发酵为三级晒青茶3 t,堆高0.8 m,潮水量40%,覆盖湿麻布进行发酵,间隔7 d翻堆补水;浅盘发酵为三级晒青茶0.375 t,潮水量40%,潮水混匀后,将茶叶盛满大号塑料框,每框25 kg左右,放置在多层发酵架上置于发酵室发酵,发酵室全封闭,应用PLC系统对温度、湿度、供氧、排碳进行调控,实现发酵过程茶叶温度、湿度、氧气的自动化监测与控制,发酵间隔5 d,混合补水.每天8:00和17:30记录茶叶温度和环境湿度,取平均值,每隔5 d翻堆前,采用5点取样法,上、中、下3层分别取样混合,分为2份,一份于-80 ℃保存,进行微生物多样性高通量测序分析;一份自然风干,测定化学成分.样品具体信息、茶叶温度和环境湿度见表 1.
-
试剂:甲醇、硫酸亚铁、酒石酸钾钠、磷酸氢二钠、磷酸二氢钾、食用乙醇、茚三酮、三氯化铝、氢氧化钠等(以上药品试剂均为国产分析纯),去离子水;色谱纯乙腈为Sigma产品,咖啡碱(Caffeine CA)、儿茶素(Catechins,C)、表儿茶素(Epicatechin,EC)、表没食子儿茶素(Epigallocatechin,EGC)、没食子儿茶素(gallocatechin,GC)、表儿茶素没食子酸酯(Epicatechin gallate,ECG)、儿茶素没食子酸酯(catechin gallate,CG)、表没食子儿茶素没食子酸酯(Epigallocatechin gallate,EGCG)、没食子儿茶素没食子酸酯(gallocatechin gallate,GCG)、没食子酸(Gallic acid GA)、鞣花酸(Ellagic acid)、杨梅素(Myricetin)、槲皮素(Quercetin)、木樨草素(Luteolin)、山奈酚(Kaempferol)对照品均购自天津一方科技有限公司.
仪器:电子分析天平,北京赛多利斯天平有限公司;HH-S28S数显恒温水浴锅,金坛市大地自动化仪器厂;101A-2型电热鼓风恒温干燥箱,上海市崇明实验仪器厂;756CRT紫外可见分光光度计,上海菁华科技仪器有限公司;1200型高速液相色谱系统,美国安捷伦等;Illumina Miseq高通量测序由派森诺生物完成.
-
按2015版国标测定茶样水浸出物[10],茶叶茶多酚、茶多糖和茶色素(茶黄素、茶褐素和茶红素)的质量分数分别应用酒石酸铁比色法[11]、硫酸蒽酮法[12]和萃取比色法[13]测定.应用实验室建立的高效液相色谱法(HPLC)测定茶叶儿茶素、没食子酸、咖啡碱和黄酮的质量分数,主要方法如下:
样品处理:称取磨碎茶样0.2 g,加甲醇8 mL,盐酸0.8 mL,于圆底烧瓶85 ℃水浴回流90 min,过滤于10 mL容量瓶,用甲醇定容,摇匀,0.45 μm过滤膜过滤,待测.
高效液相色谱条件:使用TSKgel ODS-80TM色谱柱(4.6 mm×250 mm,5 μm,日本TOSOH)分离;儿茶素测定流动相A为0.261%磷酸,5%乙腈,流动相B为80%甲醇.洗脱梯度为0 min(5% B)→0.5 min(50% B)→25 min(20% B)→25.5 min(100% B)→29.5 min(100% B)→29.9 min(100% A),30 min程序停止并以10% B后运行6 min,进样量2 μL,流速0.8 mL/min,柱温30 ℃,检测波长280 nm.黄酮测定流动相A为0.2%磷酸,流动相B为80%甲醇.洗脱梯度为0 min(10%B)→0.5 min(45% B)→10 min(50% B)→18 min(85% B)→18.2 min(100% B)→21.5 min(100% B)→21.9 min(10% B),22 min程序停止并以10% B后运行6 min,进样量5 μL,流速0.8 mL /min,柱温40 ℃,检测波长360 nm,由保留时间确定化合物,使用外标法根据峰面积定量.
应用软件SPSS 22.0进行统计分析和数据处理,每个处理重复3次,每个测定重复2次,以平均值±标准差(M±SD)表示平均值.
-
将样品充分混匀,每份样品随机取样3次(每次2 g)分别用液氮充分研磨,通过磁珠组织DNA提取试剂盒提取样品基因组,利用微量核酸蛋白分析仪检测DNA浓度及纯度,将3个重复提取的基因组DNA混合,利用Illumina Miseq高通量测序平台对真菌DNA片段18S V4区、细菌16S V3-V4区进行双末端测序.
-
下机数据经过滤,首先运用QIIME软件识别疑问序列,随后,通过QIIME软件检查并剔除嵌合体序列,去除可能含有模糊碱基(ambiguous)、单碱基高复区(homologous),得到有效序列(序列长度大于150 bp),利用软件UCLUST对前述获得的序列按97%的序列相似度进行归并和OTU划分,并选取每个OTU中丰度最高的序列作为该OTU的代表序列[14],通过RDP classifer软件将OTU代表序列与真菌ITS数据库(UNITE)、真菌18S rRNA数据库(Silva)和细菌16S rRNA数据库(Greengenes)比对进行物种注释,基于OTU的表达谱数据和物种注释结果对样品中微生物物种丰度与多样性进行分析,用软件Canoco5.0进行主成分分析(principal component analysis,PCA).
1.1. 样品的采集与处理
1.2. 试剂与仪器
1.3. 化学成分测定与数据处理
1.4. 基于高通量测序的微生物多样性分析
1.4.1. DNA提取及高通量测序
1.4.2. 高通量测序数据分析
-
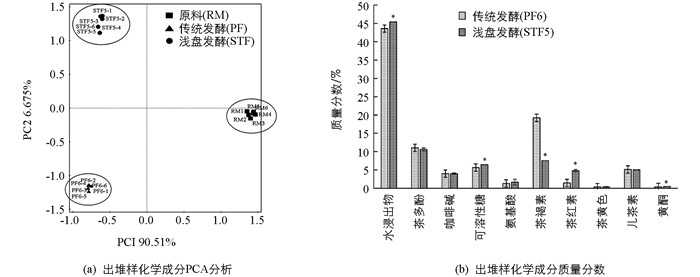
测定2种发酵方式普洱茶样品及发酵原料的水浸出物、茶多酚、氨基酸、咖啡碱和没食子酸等质量分数见表 2.由表 2可知,经发酵后,茶多酚、游离氨基酸、茶红素质量分数均降低(p<0.05),茶多酚由原料的29.84%下降为出堆样的11.01%和11.60%,游离氨基酸由3.12%下降为1.31%和1.69%,茶红素由2.71%下降为0.97%和1.61%. 2种发酵方式水浸出物、茶黄素和没食子酸质量分数先升高后降低,均显著低于原料质量分数(p<0.05);而可溶性糖和咖啡碱质量分数较原料显著升高(p<0.05).另外,传统渥堆发酵茶样中游离氨基酸和茶红素下降较浅盘发酵明显,出堆样中鞣花酸质量分数也显著高于浅盘发酵(p<0.05).
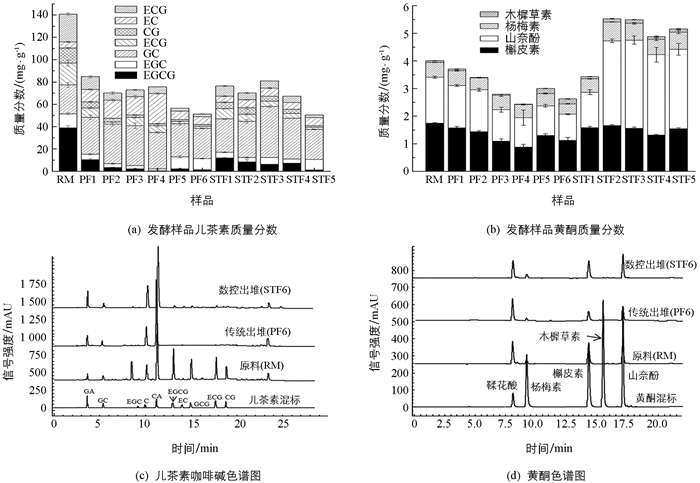
应用HPLC测定各样品的儿茶素和黄酮单一组分质量分数见图 1,由图 1可知,除表儿茶素(EC)和没食子儿茶素(GC)外,随着发酵进行其他儿茶素组分质量分数均降低(p<0.05),2种发酵方式出堆样的儿茶素总量差异无统计学意义(p>0.05);传统渥堆发酵黄酮质量分数总体呈下降趋势,且显著低于发酵原料(p<0.05),浅盘发酵中、后期黄酮质量分数较原料和渥堆发酵显著升高(p<0.05),其中山奈酚增加最为明显,出堆样质量分数达到2.87 mg/g,是原料的1.72倍、渥堆发酵的3.02倍.
以发酵原料和发酵出堆样的茶多酚、儿茶素总量、游离氨基酸、可溶性糖、水浸出物、咖啡碱和黄酮等化学成分质量分数进行PCA分析(图 2a),2种发酵方式的出堆样品分别聚为一簇,样品化学成分质量分数差异较大;比较2种方式发酵出堆样品化学物质质量分数(图 2b),可知浅盘发酵出堆样(STF5)的水浸出物、可溶性糖、茶红素和黄酮显著高于传统渥堆发酵出堆样(PF6)(p<0.05),而茶褐素质量分数显著低于PF6(p<0.05).
-
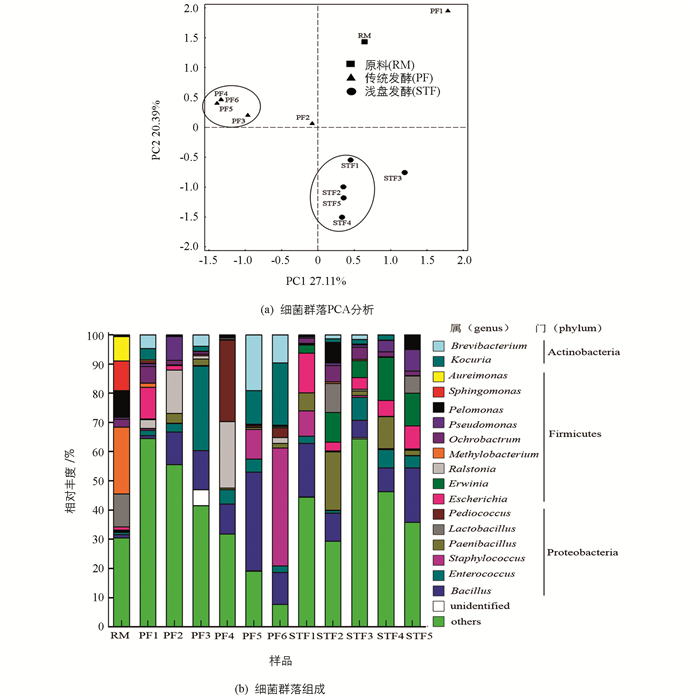
每个样品得到33 839~68 663条有效序列,在97%的相似水平,进一步聚类为405~2 249 OTUs;各样品shannon、simpson、Chao1和ACE指数见表 3.由表 3可知发酵前期样品细菌多样性较高,其中传统渥堆发酵第1翻(PF1)、浅盘发酵第3翻(STF3)中细菌数量最多,传统渥堆发酵出堆样细菌多样性和数量均高于浅盘发酵.每个样品得到44 921~58 919条真菌有效序列,在97%的相似水平,进一步聚类为166~311个OTUs;各样品shannon、simpson、Chao1和ACE指数见表 3.由表 3可知传统渥堆发酵过程中真菌多样性及数量在后期较高,浅盘发酵在第2翻(STF2)时真菌多样性和数量达到最大.
-
将上述聚类得到的OTU代表序列与细菌16S rRNA数据库(Greengenes)比对进行物种注释,各发酵样品超过90%的序列被鉴定到属的水平,因此后续在属水平分析群落组成.对各样品所有属的相对丰度进行PCA分析(图 3a),样品间越靠近,说明两个样品的物种组成越相似,由图可知样品RM(晒青茶)与其他发酵阶段的样品细菌多样性相差最远,传统渥堆发酵中后期PF3,PF4,PF5,PF6和浅盘发酵前期、后期STF1,STF2,STF4,STF5分别聚成一簇,较相近.
选取相对丰度大于5%的细菌属进行分析,各发酵样品属水平的物种表达谱见图 3b.由图可知,发酵普洱茶样品中细菌主要以厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)和放线菌门(Actinobacteria)为主,各样品属级分类单元细菌的结构变化为,发酵原料的优势菌是甲基杆菌属(Methylobacterium)、青枯菌属(Ralstonia)和鞘脂单胞菌属(Sphingomonas),传统渥堆发酵前期,3翻、4翻样品的优势菌为肠球菌属(Enterococcus)、乳杆菌属(Lactobacillus)和片球菌属(Pediococcus);出堆样的优势菌是芽孢杆菌属(Bacillus)、葡萄球菌属(Staphylococcus)、短杆菌属(Brevibacterium)和考克菌(Kocuria),相对丰度分别为10.85%,40.40%,9.57%和21.35%;浅盘发酵前期,1翻、2翻的优势菌为芽孢杆菌属(Bacillus)、埃希氏菌属(Escherichia)和类芽孢杆菌属(Paenibacillus),发酵出堆样中欧文氏菌属(Erwinia)和芽孢杆菌属(Bacillus)成为优势菌,分别占8.06%和18.64%.
-
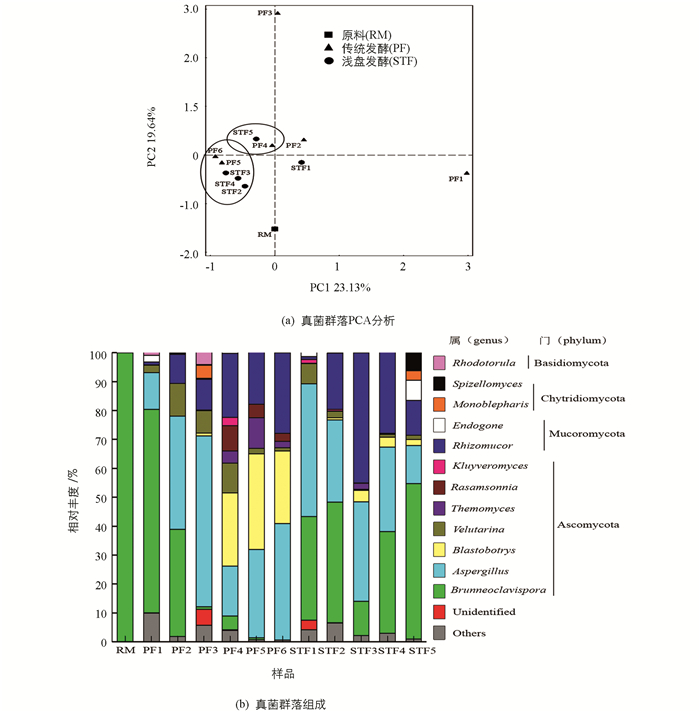
将聚类得到的OTU代表序列与真菌ITS数据库(UNITE)、真菌18S rRNA数据库(Silva)比对进行物种注释,各发酵样品超过90%的序列被鉴定到属的水平,因此后续在属水平分析群落组成.对各样品所有属的相对丰度进行PCA分析(图 4a),由图可知样品RM(晒青茶)与其他发酵阶段的样品真菌多样性相差最远,浅盘发酵前、中期STF2,STF3,STF4和传统渥堆发酵后期PF5,PF6聚成一簇,较相近.
发酵样品真菌主要以子囊菌门(Ascomycota)和毛霉门(Mucoromycota)为主,各样品属级分类单元真菌结构为,发酵原料以Brunneoclavispora为主,占99.97%,随着发酵的进行,其在2种发酵方式中的相对丰度均降低,变为0.01%和53.84%;Brunneoclavispora,根毛霉(Rhizomucor)和曲霉属(Aspergillus)共同成为2种发酵方式的优势菌,除Brunneoclavispora外,均是后发酵产生的真菌;传统发酵出堆样品优势真菌是曲霉属(Aspergillus)、芽生葡萄孢酵母属(Blastobotrys)和根毛霉(Rhizomucor),相对丰度分别为40.28%,25.17%和27.89%;浅盘发酵出堆样品的优势真菌是Brunneoclavispora和曲霉属(Aspergillus),相对丰度分别为53.84%和13.17%.此外,在浅盘发酵出堆样中检测到了内囊霉属(Endogone)和棘孢霉属(Spizellomyces),相对丰度分别为7.02%和6.15%,这两属真菌在传统渥堆发酵出堆样中并未检测到.
2.1. 两种发酵过程茶叶生化成分测定与比较
2.2. 发酵样品微生物群落结构与动态变化分析
2.2.1. 微生物多样性与变化
2.2.2. 细菌群落结构与变化
2.2.3. 真菌群落结构与动态变化
-
本研究应用浅盘系统和传统渥堆方法进行普洱茶发酵,通过测定发酵样品的化学成分发现,2种发酵过程茶多酚、游离氨基酸、茶红素和儿茶素质量分数降低;茶褐素、咖啡碱质量分数增加;水浸出物、茶黄素、没食子酸质量分数先升高后降低,研究结果与罗龙新等[15]报道基本一致,传统渥堆总黄酮质量分数变化与李家华等[16]研究结果相符,而浅盘发酵出堆样中总黄酮质量分数较李家华等[16]研究结果高.以生化成分进行PCA分析发现浅盘发酵与传统发酵出堆样品聚成不同的簇,进一步比较发现浅盘发酵出堆样的主要呈味物质茶多酚、水浸出物和咖啡碱等质量分数高于传统渥堆发酵,表明2种发酵方式化学成分变化规律类似,但是出堆样品化学成分质量分数差异有统计学意义.
目前已从普洱茶发酵产品中分离鉴定出曲霉属、青霉属等真菌,以及放线菌和芽孢杆菌等多种细菌[17, 18].另外,应用PCR变性梯度凝胶电泳[19-21]、454焦磷酸测序等免培养技术[19],基本阐明了发酵过程微生物多样性与动态变化,已有研究表明,阐明微生物在后发酵中的作用是研究普洱茶品质形成的前提与关键.本文应用Illumina Miseq高通量测序,结合生物信息学分析了2种发酵方式普洱茶的微生物多样性差异,发现普洱茶发酵原料的优势细菌为甲基杆菌属、青枯菌属和鞘脂单胞菌属,Brunneoclavispora为原料中绝对优势真菌,占99.97%;发酵初、中期优势细菌为肠球菌属、片球菌属和类芽孢杆菌属,后期优势细菌为芽孢杆菌;发酵初期优势真菌为Brunneoclavispora和曲霉属,发酵中、后期根毛霉大量繁殖,与曲霉属真菌共同成为优势真菌,以上研究结果与已有研究结果基本一致[22-24].此外,传统渥堆发酵出堆样品中检测到大量优势细菌考克菌、葡萄球菌属和短杆菌属,而浅盘发酵中丰度很低,囊霉属、欧文氏菌属和棘孢霉属为浅盘发酵出堆样中特有的真菌群落.
本研究测定发现两种方式普洱茶发酵过程化学成分与微生物存在差异,但感官审评表明发酵普洱茶均具有甘滑、醇厚的特点,表明浅盘发酵系统也可以进行发酵,缩短发酵时间,得到品质符合要求的普洱茶.但是,发酵过程的条件控制,微生物变化及其与化学成分之间的关系还需要进一步研究.



 下载:
下载: