-
微粒子(Microsporidia)广泛分布于自然界,是一类专性寄生的单细胞真核生物,可以寄生于脊椎动物和无脊椎动物,是一些动物和经济昆虫的常见病原,危害极大[1-2]. 由于微粒子还能够机会性感染具有免疫缺陷的病人,近年来备受关注[3-4]. 家蚕微粒子病(pébrine)是一种由家蚕微粒子(Nosema bombycis,Nb)感染、寄生引起的蚕病,传播方式为食下传染和胚种传染,是蚕丝业的重大威胁之一[5-6]. 家蚕微粒子曾给欧洲养蚕业带来毁灭性打击,致使其一蹶不振[7]. 因此,在蚕业生产上家蚕微粒子被定为唯一法定检疫对象.
在家蚕品种对微粒子的抗性研究中,日本学者谷贤三郎于20世纪30年代就指出不同的家蚕品种对微粒子的抗性存在差异,且这种差异会遗传给子代[8]. 刘仕贤等[9]、张远能等[10]研究了相关家蚕品种对微粒子的抗性差异,结果表明这种差异有强弱之分,且抗性强的品种可以作为宝贵的育种亲本材料. 为了充分了解现有实用品种的抗性,徐兴耀等[11]研究学者对广东生产常用的品种进行微粒子抗性研究,结果表明其均对微粒子敏感,属于易感品种. 沈中元等[12]对中系、日系、欧洲系统和多化性系统进行微粒子抗性研究,表明不同系统抗性存在差异,少数品种间存在极显著差异. 近些年各级蚕业科研单位及蚕种场均集中力量选育强健、优质、高产及易繁等家蚕素材,致使实用品种的原种对微粒子抗性及胚传规律研究相对较少. 目前家蚕微粒子病胚种传染研究主要问题集中在以下3个方面:①当前微粒子防控主要通过药物消毒手段,难以从源头切断微粒子传播;②对微粒子抗性研究目前主要集中于育种素材方面,对生产的指导意义不大[13];③现有实用品系微粒子抗性不强,导致无法实施针对性防控微粒子. 因此结合目前成品卵检疫标准,迫切需要分析生产过程中家蚕常用实用品系对微粒子的抗性.
为了进一步了解当前生产过程中常用家蚕原种对微粒子的抗性差异,本文利用8个家蚕常用原种对微粒子胚传特性进行研究,以期分析家蚕原种抗微粒子的规律,进一步创新发展家蚕微粒子病防控技术体系. 本研究一方面有助于确定微粒子具体检验标准,进一步为家蚕微粒子病的风险评估和检测防控奠定理论基础,另一方面为筛选高抗性低胚传的家蚕实用品系提供新的思路.
全文HTML
-
家蚕微粒子CQ1分离株,由西南大学家蚕基因组生物学国家重点实验室分离,保存于中国兽医微生物菌种保藏管理中心(CVCC),保藏号CVCC102059. 供试家蚕品系为871和872(四川省农业科学院蚕业研究所提供)、芙蓉932和湘753(广西蚕业推广总站提供)、菁松B×A和皓月B×A(重庆市蚕业科学研究院提供)、苏菊(江苏大学提供)、云7(云南省农业科学院蚕蜂研究所提供),蚕种确认均未感染家蚕微粒子病.
-
3龄起蚕添食含有新鲜家蚕微粒子的桑叶,添食剂量为104个/头蚕. 取感染后5龄4 d幼虫的丝腺进行匀浆离心,差速离心法获得家蚕微粒子粗提液,再以不连续的Percoll梯度(25%,50%,75%和100% v/v)10 000 g离心20 min后获得纯化孢子[11].
蚕种经催青后幼虫在25 ℃用新鲜桑叶饲育,在5龄眠起时添食纯化后的家蚕微粒子5×105个/头蚕,待其化蛹成蛾备用.
-
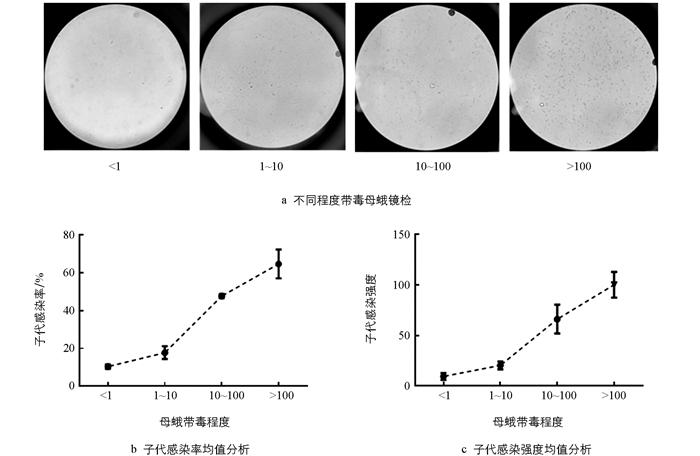
母蛾产卵后研磨镜检,每个样品观察10个视野,并统计每个视野中微粒子的数目,计算其平均值. 将母蛾带毒情况分为4类:平均值<1粒、1~10粒、10~100粒、>100粒,分析比较同一添食浓度下不同家蚕原种母蛾的带毒程度.
-
为研究各家蚕原种中母蛾带毒与子代带毒情况的关系,选取8个原种母蛾,分别与不带毒的雄蛾交配,母蛾产卵后研磨镜检,根据镜检结果每个原种选取4种不同的带毒情况母蛾(单个视野平均微粒子数目:<1/ 1~10/ 10~100/>100),将每种带毒情况的母蛾每个原种选3头,随机镜检所产蛾圈孵化的蚁蚕90头. 样本总量为8×4×3=96组,对单独设置的检测组每天取90头蚁蚕镜检,同时检测每个蛾圈每天的蚕沙是否带毒,避免二次感染.
子代感染率分析:将二次感染发生前的蚁蚕逐头镜检,每个样品统计10个视野,只要有一个视野微粒子>1粒即计为阳性.
子代感染强度分析:将二次感染发生前的蚁蚕逐头镜检,同样每个样品统计10个视野,感染强度按镜检时10个视野的平均孢子数计分(平均值<1粒记1分;1~10粒计2分;10~100粒计4分;>100粒计8分).
-
利用SPSS 19.0软件对得到的数据进行处理,采用方差分析进行差异显著性分析(ANOVA分析和Kruskal-Wallis分析),同时进行两两比较(Dunnett T3法和LSD法).
1.1. 家蚕微粒子与家蚕品系
1.2. 方法
1.2.1. 带毒母蛾的准备
1.2.2. 母蛾带毒程度检测
1.2.3. 子代感染率和感染强度分析
1.2.4. 数据统计分析
-
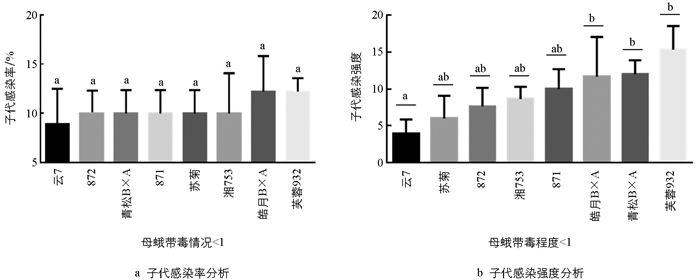
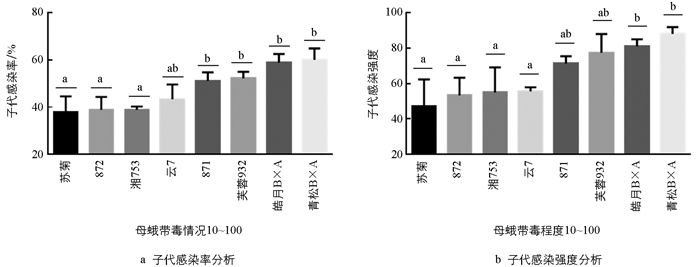
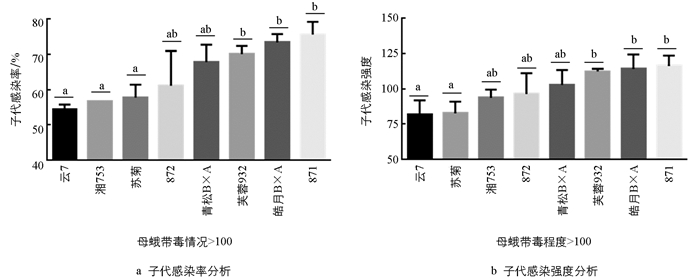
对8个感染微粒子的家蚕原种子代感染率和感染强度平均水平进行分析发现,子代感染率及子代感染强度与母蛾带毒程度呈正比(图 1). 在母蛾带毒程度分别为<1,1~10,10~100和>100这4种情况时,其子代感染率分别为10.4%,17.7%,47.6%和64.5%,子代感染强度分别为9.5,20,66和100. 在4种不同带毒母蛾情况下子代感染率均值约为35%,子代感染强度均值约为49. 当母蛾带毒情况由<1上升到1~10时,子代感染率和感染强度的变化不明显,表明低带毒母蛾对胚传影响不大. 而当母蛾带毒情况由1~10上升到10~100时,子代感染率和感染强度的变化最明显,即此时母蛾的带毒程度对子代带毒造成的变化最为显著. 虽然带毒程度相同的原种母蛾胚传会出现一定的差异,但总体而言高带毒的原种母蛾胚传带毒也相应升高.
-
在母蛾带毒<1时,各原种间子代的感染率均未超过15%,感染强度均未超过15(图 2). 这些原种的子代感染率之间无显著差异,但子代感染强度云7与其他原种存在显著差异. 具体表现为:与其他原种相比,云7的子代感染率和子代感染强度均最低,分别为8.9%和4,即云7在极低感染情况下表现出一定的抗性. 相较于其他原种,芙蓉932、菁松B×A、皓月B×A抗性较差. 但在极低感染情况下,当前生产实用原种间并不存在明显差异.
-
相较于母蛾带毒<1,当母蛾带毒程度增大为1~10时,子代感染率和子代感染强度均有一定升高(图 3). 云7依旧为相对抗性原种,子代感染率和子代感染强度分别为13.3%和15. 其中871的子代感染率有显著上升,达到和芙蓉932相同的子代感染率,芙蓉932、871与云7存在显著性差异,表明该带毒情况下871和芙蓉932胚传最为严重. 但此时871的子代感染强度却低于芙蓉932,且存在显著性差异,表明母蛾原种的类型也会影响微粒子在子代的增殖,同时也暗示出在寻找家蚕抗性原种中,子代感染强度也是一个重要的参考指标. 除此之外,在子代感染强度上,云7、菁松B×A、872及871与皓月B×A、芙蓉932存在显著性差异.
-
当母蛾带毒程度为10~100时,子代的感染率和感染强度均表现出相对一致的趋势,由低到高分别为苏菊、872、湘753、云7、871、芙蓉932、皓月B×A和菁松B×A. 子代感染率数据表明,871、芙蓉932、皓月B×A和菁松B×A与苏菊、872和湘753具有显著性差异;其中皓月B×A、菁松B×A与苏菊、872、湘753和云7在子代感染强度上具有显著性差异(图 4). 在母蛾带毒程度<1和1~10时,表现出抗性的原种云7在该带毒程度下子代感染率和感染强度均低于苏菊,表明相对抗性原种在母蛾带毒程度改变时,其子代感染率、子代感染强度也均会改变,表现为不显著抗微粒子. 该带毒程度下母蛾原种的部分子代间感染率具有显著性差异,但在子代感染强度上却表现不明显.
-
在母蛾带毒>100时,子代感染率由低到高依次是云7、湘753、苏菊、872、菁松B×A、芙蓉932、皓月B×A和871,而子代感染强度具有较为一致的趋势(图 5). 高程度带毒母蛾(>100)子代感染率均高于50%,感染强度均大于80,两项数据皆高于低程度带毒母蛾组;其中云7、苏菊与芙蓉932、皓月B×A和871在子代感染率和子代感染强度上存在显著性差异. 相较于母蛾带毒10~100时,871子代感染率和子代感染强度急剧上升且明显高于其他组,为最易感品系,云7和苏菊为相对抗性品系,表明不同原种间对微粒子的抗性确实存在差异.
2.1. 不同带毒母蛾的胚传特征
2.2. 母蛾带毒<1时对子代感染率和子代感染强度的影响
2.3. 母蛾带毒1~10时对子代感染率和子代感染强度的影响
2.4. 母蛾带毒10~100时对子代感染率和子代感染强度的影响
2.5. 母蛾带毒>100时对子代感染率和感染强度的影响
-
家蚕微粒子病对蚕业生产具有毁灭性危害,是检疫蚕种质量的唯一指标[14]. 当前,家蚕微粒子病在蚕种生产上有抬头的趋势[15],该疫病一方面通过食下水平传播,另一方面利用胚传垂直传播. 在防控家蚕微粒子方面,首先应做到严防胚种传染,其次对卵、蚕、茧、蛹、蛾进行筛选,最后要做好消毒防病工作[16]. 在胚种传染中,母蛾的带毒程度是次代蚕遗传毒率的重要影响因素[17],因此掌握母蛾感染程度与胚传带毒之间的规律,了解原种间的抗性差异对防控家蚕微粒子具有重要的意义[18].
微粒子检疫方法众多,为生产无毒蚕种,杜绝胚种传染,生产上常用母蛾镜检法,通过淘汰带毒母蛾杜绝带毒卵的产生达到目的. 因单蛾检验的工作量大、时间性强,且需要耗费大量的人力、物力,在省时效率上不可避免地存在缺点. 目前以显微镜能否看到微粒子来判断母蛾是否带毒,而能否观察到微粒子,则受观察人员技术水平及经验等诸多因素的影响. 在此情况下,逐渐发展出母蛾集团检验,根据统计概率学原理计算母蛾感染率. 1979年在日本编著的《微粒子病检查指南》中规定,允许病蛾率为0.5%. 在现有母蛾检测的抽样方案和判别标准下,因家蚕微粒子病实际流行程度(母蛾感染率或感染程度)的不同,所以同一判断标准(允许病蛾率0.5%,30%的平均胚传率)对检测结果也有不同的影响[8]. 由8个家蚕原种感染微粒子胚传子代平均趋势分析可知,4种不同程度的带毒母蛾子代感染率均值约为35%(图 1),高于现行30%的平均胚传率,所以需要制定更加合理的成品卵检疫标准. 目前生产实践中母蛾检验大多只统计感染率,但在一定程度上感染率只是一个定性标准,其受到样本与本体不一致、自身的可变性、显微镜检验技术和带毒雄蛾等诸多因素的影响[19]. 在王裕兴等[20]对家蚕成品卵检疫技术的可靠性分析研究中,发现成品卵毒率、微粒子病遗传毒率、当代母蛾毒率以及蚕茧质量间存在明显的相关性,且成品卵检疫可基本排除人为因素对蚕种检疫结果错判的影响,比母蛾检疫更具有质量保证. 在本研究中母蛾带毒1~10时,871和芙蓉932的子代感染率均为22.22%,但871的子代感染强度却低于芙蓉932. 因此与先前研究不同,本文在母蛾检验时将孢子密度(子代感染强度)也作为蚕种质量判断因素之一. 目前,微粒子检疫在分子生物学方面展现出巨大潜力,利用PCR反应设计家蚕微粒子特异引物以达到检测微粒子的目的,且逐渐向快速、灵敏、低成本靠拢[21-22]. 在免疫学方面,利用抗原抗体特异性结合的原理,研制家蚕微粒子单克隆抗体,设计出对微粒子高灵敏的检测试纸[23]. 在药物治疗方面,除了防微灵等传统的农药,目前也向高效、广谱及安全等方面发展[24].
在本研究中母蛾带毒程度为<1和1~10时,云7的子代带毒率和子代感染强度均最低,表现出相对明显的抗性. 当母蛾带毒程度增大为10~100时,云7对微粒子的抗性则有所减弱. 这表明当前研究中的8个实用品系,没有一个品系在任何带毒程度下可以达到对微粒子的最大抗性,即母蛾带毒情况不同时,有不同的原种相对抗性较强. 这与王裕兴等[20]研究结果一致:不同家蚕原种、不同母蛾带毒情况均会对胚传产生影响. 母蛾带毒程度是影响胚传最为关键的因素,且在不同带毒情况下母蛾带毒与子代带毒呈正相关[25]. 总体而言,本研究8个实用品系中871抗性相对较弱,若针对性防控微粒子应尽量选用云7、苏菊等抗性较强的品系. 通过把现有实用品系中抗性较强的原种当作育种素材,培育抗性品系还任重道远. 值得思考的是,不同的家蚕原种与母蛾感染程度对胚传造成的影响是否存在一定的关系?即低胚传的原种是否也具有高抗性,两者之间是否有必然联系?相关问题还需要进一步深入研究.



 下载:
下载: