-
γ-氨基丁酸(Gamma-aminobutyricacid,GABA)是中枢神经系统中非常重要的一种抑制性神经递质,GABA与受体结合后调节抑制性神经传递[1-2]. 在癫痫发作中,兴奋性神经递质系统与抑制性神经递质系统平衡被打破,使脑内神经元兴奋性增加,从而导致放电频率增加、幅度增高以及同步化放电,造成癫痫疾病的发生[3].
崁烯氯噻嗪(Cyclothiazide,CTZ)不仅可以阻滞兴奋性神经递质谷氨酸AMPA受体的去敏感化作用[4-5],而且也会对抑制性神经递质GABA的释放和受体表达有减少作用[6],因此CTZ癫痫模型的双机制特征使其优于其他癫痫动物模型[7]. 前期研究已经发现CTZ慢性癫痫模型中海马结构GABA能神经元减少、GABA的合成酶GAD和转运酶GAT都有明显减少[8],但是对于海马神经元中GABA表达情况仍不清楚. 本研究通过侧脑室注射CTZ建立慢性癫痫动物模型,研究CTZ慢性癫痫大鼠海马神经元中GABA的表达情况,进一步研究慢性自发性癫痫模型的发生发展机制.
全文HTML
-
Sprague-Dawley大鼠,250~280 g,由腾鑫生物技术公司购入. 标准动物房饲养,温度23~26 ℃,12 h:12 h昼夜循环光照,自由饮食. 适应环境1周后进行实验.
-
大鼠用3%戊巴比妥钠麻醉后,剪掉头皮和脑膜,双氧水处理颅骨,以前囟为坐标原点,在前囟后0.3 mm,中缝旁1.3 mm处钻孔,将套管埋置进左侧脑室内(深4.0 mm),并用两颗螺丝和牙托粉进行固定. 埋管后恢复1周进行后续实验.
-
恢复1周后进行癫痫诱导及癫痫行为学观察实验. 18只大鼠随机分为两组:CTZ癫痫模型组13只和二甲基亚砜(DMSO)对照组5只,分别通过微量注射器在侧脑室内注射CTZ和DMSO. 大鼠置于鼠笼内,自由活动,通过预埋置套管向侧脑室内注射CTZ(0.25 μmol,5 μL),连续注射3 d,对照组大鼠侧脑室内连续3 d注射DMSO 5 μL.
-
在给药后,每天给实验动物注射CTZ和DMSO后3 h观察动物行为并记录,按照Racine评分标准对癫痫发作程度将其行为分为0-V级:
0级:无任何异常行为,自然状态;
Ⅰ级:咀嚼、眨眼、立须、耳动、流涎、面部抽搐;
Ⅱ级:点头运动、湿狗样抖动、颈部抽搐;
Ⅲ级:单侧肢体抽搐;
Ⅳ级:双侧肢体抽搐的同时伴随出现站立、全身僵直;
Ⅴ级:在Ⅳ的基础上失去平衡,出现摔倒、身体完全强直.
大鼠的癫痫行为评分达到了Ⅳ级及以上,可认为是构建癫痫模型成功[9]. 成功的癫痫动物模型,进一步通过录像记录实验动物注射CTZ或DMSO后6个月内慢性癫痫行为的发作情况,其情况按照上述Racine评分标准进行记录分组.
-
在行为学实验结束后,所有实验动物在3%戊巴比妥钠麻醉后,4 ℃生理盐水快速灌注冲出血液,4%多聚甲醛灌注进行内固定,之后断头取脑组织. 4%多聚甲醛后固定24 h,梯度酒精脱水后,石蜡包埋,进行石蜡切片,厚度为6 μm,每只大鼠间隔取4~6片进行后续染色.
-
切片进入梯度酒精脱蜡后,蒸馏水润洗5 min,0.1%硫瑾溶液染色10 min,蒸馏水快速润洗几秒钟,95%盐酸酒精分色2~10 min,梯度酒精脱水,二甲苯透明,中性树胶封片.
-
二甲苯10 min,梯度酒精脱蜡,蒸馏水10 min,TBS缓冲液润洗5 min,3%双氧水消除内源性过氧化物酶活性,0.125%的胰蛋白酶修复抗原活性,山羊血清封闭,加一抗anti-GABA(Abcam,浓度为1∶100)置4 ℃冰箱过夜. 次日,加入辣根过氧化物酶标记的山羊抗兔二抗(SP-9001,北京中杉金桥生物技术公司)37 ℃水浴箱内孵育1 h,最后DAB显色. 在每两个过程中间均使用TBS缓冲液润洗5 min,各3次. 梯度酒精脱水,二甲苯透明,中性树胶封片.
-
每只大鼠取4~6片染色切片使用Nikon显微镜在200倍明场视野下拍照,对Nissl染色和免疫组化图片中海马CA1和CA3区中全部阳性神经元进行细胞计数和神经元胞体染色进行光密度分析,取每张切片平均值代表该大鼠海马中阳性神经元的分布情况.
-
所有数据采用SPSS 13.0进行统计分析,实验结果均以x±s表示,DMSO和CTZ之间的差异采用独立样本t检验. p<0.05认为有统计学意义.
1.1. 实验动物
1.2. CTZ慢性癫痫大鼠模型建立
1.2.1. 侧脑室内埋管
1.2.2. 侧脑室注射
1.2.3. 癫痫行为观察
1.3. 组织学染色
1.3.1. Nissl染色
1.3.2. 免疫组化染色
1.3.3. 图片分析
1.4. 统计学分析
-
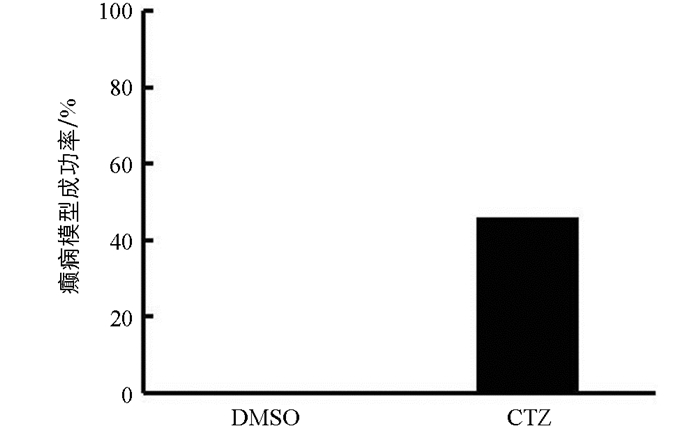
5只DMSO对照组大鼠只有洗脸等正常行为,无异常行为出现. 13只CTZ癫痫模型组大鼠在注射CTZ后全部出现Ⅳ级及以上行为,癫痫模型建立成功. 之后6个月观察期中,10只大鼠出现自发性癫痫行为,其中6只达到Ⅳ级及以上行为. 根据Racine分级法,大鼠的癫痫行为评分达到Ⅳ级及以上,可认为是构建癫痫模型成功[9]. 因此在13只CTZ急性癫痫模型中,其中6只出现了Ⅳ级及以上癫痫行为的CTZ癫痫动物达到了慢性自发性癫痫模型标准,确定为慢性自发性癫痫动物模型,成功率为46%(图 1). 本文使用6只出现自发性癫痫行为发作的CTZ癫痫大鼠和5只DMSO对照组大鼠进行后续组织学染色研究.
-
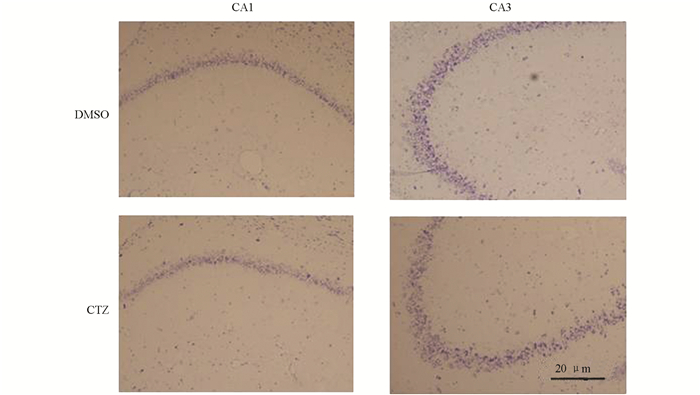
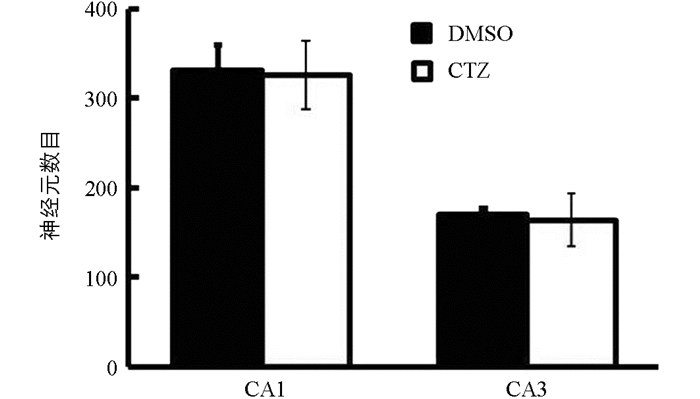
Nissl染色是神经元染色常用的一种方法,通过Nissl染色可以对神经元结构及神经元数目进行检测[10]. 实验结果显示,海马结构中DMSO对照组和CTZ慢性癫痫模型组CA1和CA3区锥体神经元被染成紫色(图 2). 两组神经元分布相似,CA1区锥体神经元3到4排,CA3区锥体神经元4到5排,排列整齐,仅少量神经元结构异常. 对CA1区和CA3区Nissl染色神经元进行计数,DMSO对照组海马CA1区和CA3区神经元数目分别为331.04±29.38和169.73±7.21,CTZ慢性癫痫模型组海马CA1区和CA3区神经元数目分别为325.94±38.42和163.87±29.73,两组神经元数目差异无统计学意义(图 3),CTZ慢性癫痫模型海马CA1区和CA3区并无明显神经元损伤和死亡. 在既往研究中,KA致痫模型等模型动物海马中会出现大量的神经元凋亡[11, 12],但CTZ慢性癫痫模型尽管在慢性期出现了自发性癫痫发作,但海马神经元并未出现明显的损伤和死亡,因此癫痫疾病发生机制不仅和神经元损伤、死亡相关,还与其他机制有关.
-
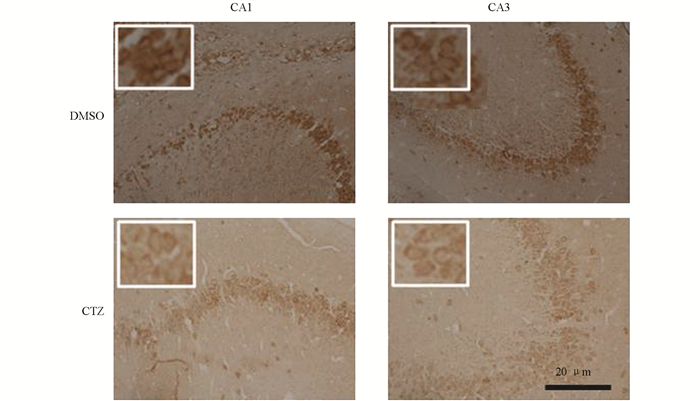
GABA能神经元是海马结构中非常重要的抑制性神经元,可以释放抑制性神经递质GABA调节海马神经元兴奋性的发生. GABA释放到突触间隙后,与突触后受体结合介导抑制性调节,因此海马神经元中GABA含量对于抑制性调节有着至关重要的作用[13]. 图 4免疫组化染色显示,DMSO对照组大鼠海马CA1和CA3区GABA阳性神经元被染成棕色,主要分布在海马锥体细胞层,锥体细胞层各层中均有GABA阳性神经元分布. 棕色的GABA免疫阳性颗粒主要分布在锥体神经元细胞浆中,说明在GABA能神经元内大量的GABA分泌储存在胞浆中. 在DMSO对照组大鼠海马CA1和CA3区,GABA阳性染色除了分布在神经元细胞浆中之外,分子层突起内也有大量的GABA阳性染色,棕色染色的突起呈平行分布在分子层内. CTZ慢性癫痫大鼠模型海马CA1和CA3区也有大量GABA免疫阳性神经元存在,GABA免疫阳性颗粒主要分布于神经元的胞浆内,但与DMSO对照组相比染色较浅,而且分子层内突起无棕色GABA免疫阳性颗粒分布,说明CTZ慢性癫痫模型海马CA1和CA3区神经元胞浆和神经元突起内GABA含量下降.
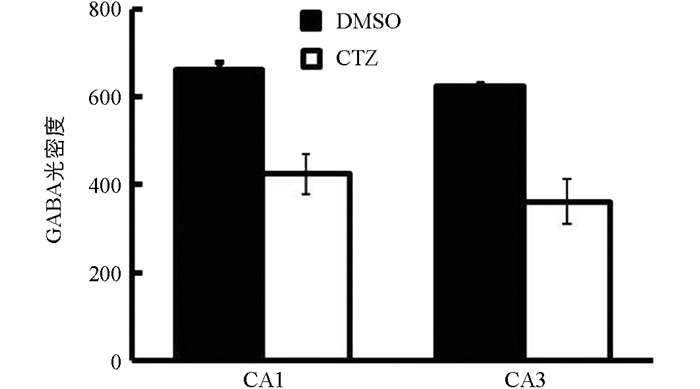
对海马CA1和CA3区GABA免疫阳性染色进行光密度分析(图 5),结果显示,DMSO对照组大鼠海马CA1和CA3区神经元胞体GABA免疫阳性光密度分别为661.40±17.65和625.07±7.39,说明在DMSO对照组大鼠海马CA1和CA3区神经元胞体内有大量的GABA分布. 对CTZ慢性癫痫模型大鼠海马CA1和CA3区神经元胞体进行GABA免疫阳性光密度分析后结果分别为424.48±45.10和361.82±51.30,与DMSO对照组大鼠相比下降了35.82%和42.12%,两组差异有统计学意义(p<0.05). 通过光密度分析可以看出,CTZ慢性癫痫模型中海马CA1和CA3区神经元胞体内GABA含量急剧下降.
2.1. CTZ癫痫模型建立
2.2. CTZ慢性癫痫大鼠模型海马中神经元无明显变化
2.3. CTZ慢性癫痫大鼠模型海马神经元中GABA减少
-
在中枢神经系统中,兴奋性神经递质系统和抑制性神经递质系统处于平衡状态,共同调节大脑的兴奋性传递等活动. 一旦兴奋性神经递质系统功能增强或者抑制性神经递质系统功能下降,都会引起平衡打破,大脑内兴奋性增强,引起癫痫的发生. 在抑制性神经元中,20%~30%的抑制性神经元是GABA能神经元[14],其轴突末端可以通过谷氨酸脱羧酶将兴奋性神经递质谷氨酸脱羧形成抑制性神经递质GABA[15]. GABA释放到突触间隙后,突触后受体结合增加突触后神经元Cl-的通透性诱发抑制性突触后电位,或者与G蛋白偶联受体结合介导抑制性神经传导作用[16]. 因此,当大脑内GABA含量减少或者受体表达下调,都可能造成兴奋性神经递质系统占优势导致神经元放电增加,引起癫痫发生.
本研究结果显示,CTZ慢性癫痫模型组海马CA1区和CA3区Nissl染色神经元与DMSO对照组相比差异无统计学意义,说明CTZ慢性癫痫组神经元并未出现明显的损伤或死亡等情况,因此CTZ慢性癫痫模型组癫痫行为发生并非是由海马内神经元损伤或神经元丢失所致,很可能和神经元释放神经递质及受体的改变有关. 通过免疫组化染色发现,CTZ慢性癫痫模型组大鼠海马CA1和CA3区神经元胞体和树突内GABA含量明显下降,分别下降了35.82%和42.12%,因此会造成其介导的抑制功能大幅度下降,引起CTZ慢性癫痫模型慢性期明显的癫痫行为反复性发作.
海马神经元中GABA的减少可能与谷氨酸脱羧酶含量或功能下降有关. 谷氨酸脱羧酶将兴奋性神经递质谷氨酸脱羧形成抑制神经递质GABA. 谷氨酸脱羧酶含量减少或者功能下降,造成其脱羧过程效率降低,引起GABA合成减少. 既往研究中发现,CTZ慢性癫痫模型中GAD阳性神经元明显减少,GAD含量降低[7]. 由于海马CA1区和CA3区GAD含量减少,造成了CTZ慢性癫痫模型大鼠海马内神经元GABA合成大幅度减少,与受体结合下降,造成突触后抑制功能下降,兴奋性神经递质系统功能占优势,海马内神经元兴奋性增加,造成慢性期CTZ慢性癫痫模型大鼠自发性、反复性癫痫行为发作.
本研究通过侧脑室注射CTZ诱发癫痫行为发作,并观察慢性期内大鼠出现自发性癫痫行为发作,建立慢性癫痫动物模型. 采用Nissl染色和免疫组化染色方法对海马CA1区和CA3区神经元数目和GABA表达情况进行了研究,发现CTZ慢性癫痫模型中GABA表达减少可能是造成自发性癫痫发作的重要原因之一. 在治疗癫痫的药物研究中,有多种药物是通过调节GABA递质系统的作用而发挥作用,如苯二氮卓类和巴比妥类药物通过延长氯离子通道开放时间增强GABA的抑制作用[17],地塞米松可以通过调节基因转录增加GABA合成[18],褪黑素对GABA有正向调节作用[19],丙戊酸钠通过GABA通路上调抑制性神经元功能[20],通过增加神经元GABA合成或释放,增加GABA与受体结合增强抑制性调节作用,减轻或阻止癫痫的发生,对癫痫疾病进行治疗. 因此CTZ癫痫模型中GABA递质系统功能受损,尤其是GABA含量减少,对于促进GABA合成和释放药物的开发为治疗癫痫提供了重要的理论依据.



 下载:
下载: