-
开放科学(资源服务)标识码(OSID):

-
人工湿地因净化性能良好、运营成本低和生态友好等优点,被广泛用于受污水体治理[1]. 然而,人工湿地在去除污染物的同时,会产生大量N2O温室气体,降低其环境和生态效益[2]. 人工湿地释放N2O与湿地填料、进水浓度等多种因素有关[3]. 近年来,生物炭由于比表面积大、芳香化程度高等特点[4],被广泛应用于人工湿地以改善湿地内部环境条件[5],强化污染物的去除和调控湿地N2O的排放[6]. 研究表明,在人工湿地中添加生物炭可以为微生物提供良好的定植环境,改善微生物群落结构和多样性[7],提高amoA,hao,nirS和nosZ等硝化-反硝化相关酶的活性[8-9],降低N2O排放量.
尽管已有研究探明了生物炭对实现人工湿地N2O减排的重要作用,但N2O减排途径尚不清晰. 目前,区分N2O产生途径的研究方法主要有抑制剂法和同位素示踪法等. 抑制剂法能有效阻断氮转化过程中某单一酶活性,量化N2O排放途径[10]. Castro-Gonzalez等[11]采用抑制剂法评估了湿地旱/雨季硝化作用在脱氮作用过程中的占比;Starr等[12]发现天然湿地真菌反硝化速率比人工湿地高出30%. 近年来,15N同位素标记法因环境适宜性和对微生物影响小等优点,被用于识别N2O来源和跟踪氮素转化[13]. Wang等[14]采用同位素示踪技术发现湿地中80%的氮通过硝化-反硝化进行循环;Tortosa等[15]的同位素示踪结果表明,湿地反硝化产生的N2O与人类活动和降雨量相关. 将抑制剂法和稳定同位素法联用不仅可以甄别硝化和反硝化过程对N2O排放的贡献,还能量化硝化过程中不同环节N2O的释放量. 本研究通过构建室内间歇曝气生物炭湿地系统,采用化学抑制剂耦合同位素特征值法,研究间歇曝气人工湿地N2O的产排途径,解析生物炭投加对湿地N2O排放的影响,以期为生物炭调控湿地N2O排放提供理论依据.
全文HTML
-
湿地装置采用聚乙烯圆筒容器(图 1),填料以1~2 cm碎石为主,以未添加生物炭的湿地系统作对照(命名为CW),按30%体积投加比构建生物炭湿地系统(命名为BW). 生物炭制备方法及物理性质参考团队前期Huang等[16]的研究. 生物炭投加前经2~3次水洗并去除表面污垢和杂质后,选取粒径约1~2 cm的生物炭投加至湿地内部. 系统中央设置直径为5 cm的PVC穿孔管用于虹吸排水、取样及各参数测定. 为保证湿地植物生长,在装置外侧设置水浴加热保温系统,以控制湿地温度在(26±1) ℃. 常规试验设置2组反应器,抑制剂与同位素试验另设置6组反应器,所有系统分别设置2个平行,共计16个湿地反应器.
湿地植物驯化、污泥驯化和人工配水方法参考Liang等[8]的研究. 反应器均采用间歇进水,有效进水量10 L,水力停留时间24 h. 曝气方式为间歇曝气,进气量为0.4 L/min,采用电子流量计(AST10-DX,阿斯特,北京)控制,进水完成时刻记为“0”时刻,曝气段和非曝气段均为3 h,交替循环.
-
湿地运行稳定后测定进出水水质指标. 具体包括氨氮(NH4+-N)、亚硝态氮(NO2--N)、硝态氮(NO3--N)、总氮(TN)、化学需氧量(COD)、溶解氧(DO)、pH值和电导率(Cond). 进出水COD,NH4+-N,NO3--N,NO2--N,TN测定按标准方法进行[17],DO,pH值和Cond测定参考文献[6].
-
N2O的采集方法根据已有研究基础建立,具体方法参考文献[18]. N2O质量浓度采用气相色谱仪(Agilent 7890A,美国)测定,气相色谱设置参数详见文献[8]. N2O释放速率和累计释放量计算方法参考文献[19].
-
分别设置无抑制剂添加、添加0.1 g/L氯酸钠、同时添加0.1 g/L氯酸钠与0.01 g/L丙烯基硫脲3个处理组[20],分别命名为M1,M2和M3,待装置稳定运行后进行试验. 硝化过程和反硝化过程的N2O产排贡献采用如下公式计算:
式中:CN2O为N2O释放量,而NF和DD分别为硝化作用和反硝化作用.
-
为进一步量化硝化途径中NH2OH氧化和AOB反硝化N2O产排,在装置稳定运行后采集气样送样至中国农业科学院进行同位素特征值(δ15Nbulk,δ18O)测定. 同位素值采用同位素质谱仪(IRMS,赛默飞,德国)配合痕量气体浓缩系统(Delta V Plus-Precon,赛默飞,德国)测定,δ15Nbulk和δ18O的精度都在0.5‰以下. NH2OH氧化和AOB反硝化途径对总N2O产量的相对贡献采用如下公式计算[21]:
式中:FNN为NH2OH氧化过程产生N2O所占比例(%);FND为AOB反硝化过程产生N2O所占比例(%);SP值为分子内15N的位点偏好值(‰),其中SPNN对应NH2OH氧化过程,SPND对应AOB反硝化过程. SPNN和SPND分别取(33±4)‰和(-1±5.5)‰[21].
-
试验数据通过Origin 9.1整理作图,并由SPSS 24.0进行数据分析. 所有试验数据均采用平均值加减标准差表示. 对象之间的差异性分析采用One-way ANOVA(水平包括显著p<0.05和极显著p<0.01).
1.1. 系统的构建与运行
1.2. 水质的测定方法
1.3. N2O的采集与测定
1.4. 不同途径N2O贡献率
1.4.1. 硝化和反硝化过程N2O产排贡献
1.4.2. NH2OH氧化和AOB反硝化途径N2O释放量
1.5. 数据分析
-
湿地系统运行期间DO,pH,Cond,COD,NH4+-N,NO3--N,NO2--N和TN的平均进出水特征如表 1所示. 从表 1可以得出,生物炭湿地系统出水DO质量浓度较对照湿地略有降低,但差异不显著(p>0.05),这与之前的研究结果一致[22]. 生物炭湿地较高的DO水平使硝化作用得到强化,释放更多的H+,使系统pH值更低[23]. 此外,生物炭投加可以显著降低湿地系统出水Cond.
湿地系统COD出水质量浓度均在50 mg/L以下,投加生物炭一定程度上强化了COD的去除. BW中NH4+-N的去除率达到了89.08%,相比于CW提高了9%. 所有湿地系统出水未检出NO3--N和NO2--N,这可能与曝气的方式有关,间歇曝气实现了好氧/厌氧交替进行,促进了硝化-反硝化作用[24]. CW和BW中TN的出水质量浓度分别为(10.56±2.04) mg/L和(6.21±2.15)mg/L,TN去除效果良好. 这是因为生物炭具有较大的表面积,能改善湿地内部环境,进而显著提高湿地系统对氮素污染物的去除效果(p<0.05).
-
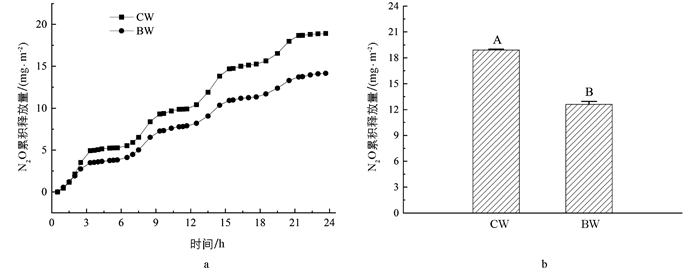
湿地系统N2O累积释放量均在曝气段呈上升趋势(图 2). 进水3 h后,CW与BW的N2O释放量出现明显差异. 总体来看,生物炭投加显著降低了N2O排放;整个反应周期内(24 h),CW的N2O累积释放量为18.91 mg/m2,而BW的N2O累积释放量为12.60 mg/m2,较CW减少了33.37%. 通常认为,微氧环境条件造成的不完全硝化和反硝化是人工湿地系统N2O释放的主要原因. 添加生物炭改善了湿地内部DO环境,硝化作用更加彻底,减少了N2O的排放[25].
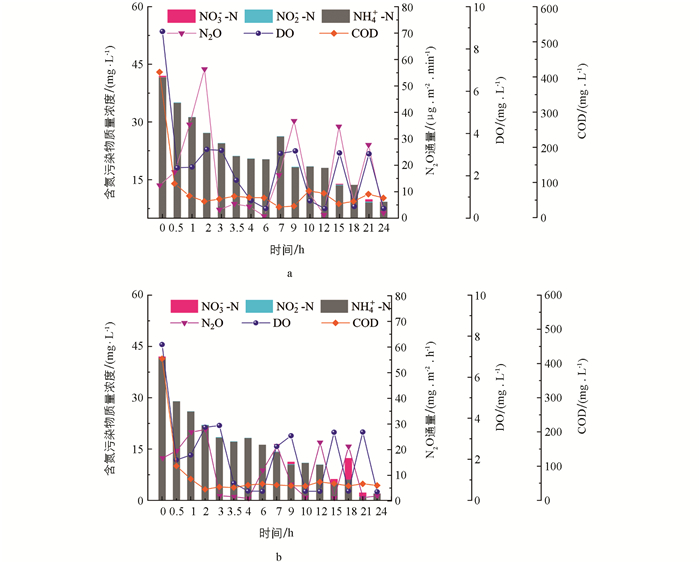
湿地典型周期内运行效果与N2O释放通量如图 3所示. CW和BW中N2O释放通量与NH4+-N质量浓度变化一致,在进水0~3 h内达到最高,分别为56.38,27.86 μg/(m2·min). 这可能是因为进水后DO较高且NH4+-N负荷较大,大量NH4+-N被AOB氧化成NO2--N,而产生的NO2--N被还原成N2O[26]. 随着反应进行,系统NH4+-N被消耗殆尽,N2O释放通量因硝化-反硝化缺乏所需反应底物而逐渐降低.
N2O释放主要集中在曝气阶段,非曝气段N2O释放较少. 适当的曝气可以为湿地系统同时进行硝化和反硝化提供较好的好氧-厌氧条件[27]. 本研究中NO3--N和NO2--N在曝气阶段均无累积,可能是湿地内部发生了同步硝化-反硝化作用导致N2O释放较多,而在非曝气段DO迅速下降,反硝化作用彻底,导致N2O释放较少. Liang等[8]发现在间歇曝气湿地中曝气阶段N2O平均排放通量是非曝气阶段的1.78~158.88倍,与本研究结果一致. 另外,各湿地系统在反应后期有少量NO3--N释放,且BW中NO3--N累积质量浓度较高,这可能是因为生物炭可以促进氧气传输,水中DO较高,硝化反应与反硝化反应竞争碳源,导致硝化反应后期碳源不足.
-
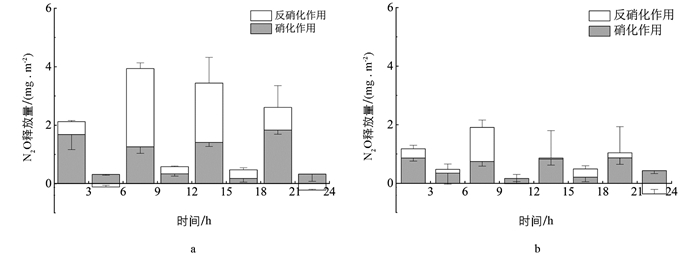
当NH4+-N作为唯一进水氮源时,N2O可以通过硝化作用、反硝化作用和其他作用(包括异化还原成氨和化学反硝化等)产生. 本试验通过添加不同抑制剂,量化N2O产生途径. 如图 4所示,在CW和BW中,硝化作用N2O累积释放量分别为7.34,4.44 mg/m2,反硝化作用N2O累积释放量分别为6.77,2.23 mg/m2,生物炭的添加使硝化和反硝化作用N2O减排率分别达到39.51%和67.06%. 生物炭能为脱氮菌属提供良好的附着条件,促使硝化-反硝化作用更加彻底,减少N2O排放[7, 28]. 由于硝化细菌的世代周期较反硝化细菌长,反硝化菌属对生物炭的响应更加敏锐[22, 29],因此,投加生物炭对反硝化过程N2O减排作用更加明显. 周期内CW和BW通过其他作用的累积释放量分别为3.89,4.03 mg/m2,无显著差异(p>0.05).
通过对比两组湿地系统典型周期内硝化和反硝化作用N2O释放量可以发现(图 5),在反应前期,N2O释放主要以硝化作用为主;在反应中期,N2O产生途径则逐渐以反硝化作用为主;在反应后期,反硝化作用表现出弱汇. 反应初期湿地DO和有机物充足,硝化作用占主导地位,随着有机物不断消耗,异养反硝化作用不完全,导致N2O释放[30]. 反应后期处于非曝气阶段,部分N2O以溶解态存在,并通过反硝化作用转化成N2,表现出N2O弱汇.
对比CW和BW,在曝气段和非曝段硝化作用的N2O释放量分别为0.33~1.83 mg/m2和0.05~0.87 mg/m2,反硝化作用的N2O释放量分别为-0.22~2.68 mg/m2和-0.36~1.17 mg/m2. 生物炭作为一种疏松多孔的富碳材料,不仅能改善湿地内部环境条件,还能为后期异养反硝化作用提供碳源,促进N2O转化为N2而被消耗[31],因此生物炭能在整个周期内有效降低硝化和反硝化过程的N2O排放量.
-
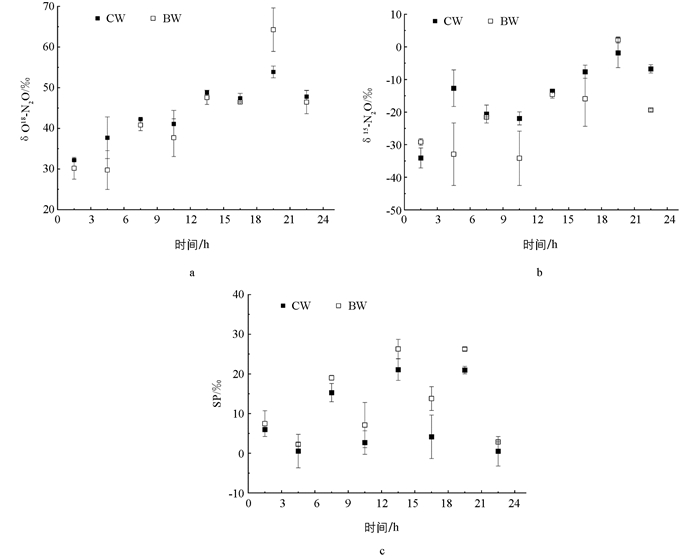
为进一步明确生物炭对硝化过程中N2O减排途径的作用,采用SP值法作为反映指标,区分N2O的产生途径[32-33]. 图 6为CW和BW中N2O的同位素特征值(δ18O,δ15Nbulk和SP). 除19.5 h外,CW的δ18O值δ略高于BW,但无显著差异(p>0.05). 随着反应的进行,15Nbulk不断升高;15Nbulk值与δ18O的变化趋势类似,总体来看CW的15Nbulk值高于BW. 值得注意的是,生物炭湿地的SP值为2.251‰~26.273‰,显著高于对照湿地(0.505‰~21.080‰),且曝气段SP值显著高于非曝气段,说明两组湿地N2O排放特征存在区别,曝气段与非曝气段的N2O产生机制也可能不同.
一般将δ18O和δ15Nbulk,δ18O和δαN之间斜率(k1和k2)大于1作为判别N2O还原对SP影响的依据[34-35]. 拟合得到CW和BW的k1和k2均小于1,说明N2O还原对SP值影响不显著. 因此,采用SP值法可以较好地区分湿地硝化过程中NH2OH氧化和AOB反硝化途径.
根据SP值计算N2O的产生途径可以发现(图 7),在曝气段,两种湿地系统NH2OH氧化途径与AOB反硝化途径N2O累积释放量相当,NH2OH氧化和AOB反硝化对N2O的产生均有重要作用;在非曝气段,N2O释放主要以AOB反硝化途径为主,主要是因为低DO质量浓度限制了NH2OH氧化. BW中NH2OH氧化和AOB反硝化的N2O累积释放量分别为2.21,2.22 mg/m2,较CW分别减少了29.40%,47.12%.
如图 7所示,随着反应的进行,曝气段NH2OH氧化途径的累积释放量逐渐上升,可能是因为进水初期湿地中碳源充足,有机物分解导致DO迅速降低,NH2OH氧化途径的贡献较低,而反应后期缺乏有机碳源,DO随曝气逐渐上升,NH2OH氧化途径的贡献比逐渐增加[36-38]. 本研究中,曝气段BW中NH2OH氧化和AOB反硝化释放的N2O均低于CW,投加生物炭增加了湿地DO水平,且反应周期内各系统中NO2-和NO3-无明显积累,生物炭在提升NH2OH氧化的同时,削弱了AOB反硝化,有效控制了曝气段硝化过程N2O的释放. 在非曝气段,BW中NH2OH氧化途径产生的N2O略高于CW,而AOB反硝化途径的结果与之相反. 这是因为生物炭作为一种多孔结构的生物质材料,不仅能提高非曝气段湿地内氧气传递效率,增强NH2OH到N2O的氮转化过程[39],还能为AOB提供碳源,促进AOB反硝化作用完全,降低AOB反硝化途径在非曝气段中贡献[40]. 因此,生物炭可以通过减少硝化过程中NH2OH氧化和AOB反硝化的N2O排放量,实现系统N2O减排.
2.1. 湿地运行效果
2.2. N2O释放量及其与污染物的关系
2.3. 生物炭湿地中N2O减排途径
2.3.1. 硝化和反硝化过程
2.3.2. NH2OH氧化和AOB反硝化途径
-
1) 生物炭能改善湿地内部环境条件,增强污染物去除效果. 添加30%的生物炭后,NH4+-N和TN的去除率分别提升9%和10%,且NO3--N和NO2--N在整个周期无明显累积.
2) N2O释放主要集中在曝气阶段,在整个周期投加生物炭显著降低了湿地N2O的释放速率;与对照湿地相比,生物炭湿地N2O排放量减少了33.37%.
3) 投加生物炭能为后期脱氮过程提供碳源,有效降低硝化和反硝化过程中N2O的排放量,减排率分别为39.51%和67.06%,对硝化和反硝化外的其他途径无显著影响.
4) 在间歇曝气人工湿地中,生物炭可以通过影响曝气段NH2OH氧化和AOB反硝化,实现硝化过程N2O减排,减排率分别为29.40%和47.12%.




 下载:
下载: