-
开放科学(资源服务)标识码(OSID):

-
据统计,2018年全球新增1810万癌症病例,但只有亚洲和非洲的癌症死亡率(分别为57.3%和7.3%)高于癌症发病率(分别为48.4%和5.8%),其中乳腺癌是全球第二大致死癌症类型[1]. 纳米技术的快速发展带动着纳米生物技术的进步,其中纳米材料的研究领域已扩展到农业、能源、医疗等行业[2-5]. 化学动力学治疗(Chemodynamic Therapy,CDT)作为近年来新兴的一种“特洛伊木马”抗肿瘤策略,即铁、铜、锰和钴基利用Fenton或类Fenton效应产生高效率活性氧,诱导细胞凋亡. MnO2纳米粒子本身可以利用类Fenton效应产生最具毒性的羟基自由基(·OH),但由于肿瘤内部H2O2不足等原因,导致CDT对肿瘤治疗效果有限. 由于MnO2还能消耗肿瘤细胞中重要的还原性物质谷胱甘肽(GSH),因此大大提高了CDT疗效[6-10],并同时产生O2缓解肿瘤乏氧微环境[4]. 此外,体系中加入的丝素蛋白作为肿瘤治疗的天然药物递送载体,具有良好的生物相容性、副作用小以及易于降解等优点[11].
由于纳米材料本身能对肿瘤起到增强的渗透性和滞留性(EPR)效应以及易于功能化、高生物相容性等原因,纳米药物成为肿瘤治疗的热议话题. 但是由于单一的纳米材料无法主动靶向肿瘤,因此药物无法高效积累到肿瘤部位并发生作用[12-14]. 近年来,研究发现通过在纳米材料表面修饰各种特异性抗体、整合素配体以及肽等,能够实现特异性靶向癌细胞[15-16]. 据报道,cRGD能与癌细胞表面过表达的整合素αVβ3特异性结合[17]. 因此,在MB-SF上修饰cRGD可以有效提高药物利用率[15]. 基于此,本研究构建的MB-SF/cRGD化学动力学治疗体系,在肿瘤治疗领域具有一定应用潜力.
全文HTML
-
仪器:动态光散射粒度仪(Nano ZS90),透射电子显微镜(JEM-2100),紫外可见分光光度计(UV-2550),多功能酶标仪(Tecan Infini Spark-10M),共聚焦激光显微镜(Zeiss LSM 800),流式细胞仪(NovoCyte 2060R),倒置荧光显微镜(IX73),X射线光电子能谱仪(ESCALAB 250Xi),傅里叶变换红外光谱仪(FT-IR Nicolet 6700).
试剂:Bi(NO3)·5H2O(AR),MnCl2·4H2O(AR),CaCl2(AR),HNO3(AR),NaOH(AR),NHS(AR),EDC(AR)以及乙醇、DMSO等,直接用于实验.
-
将蚕茧剪成小块,在0.5%的Na2CO3溶液中煮沸60 min,之后用大量的去离子水冲洗除去丝胶,并将脱下的脱胶丝素在常温下干燥. 在三元体系中(氯化钙/乙醇/水)溶解脱胶丝素(0.8%),各组分的摩尔比为1∶2∶8,并将其放在90 ℃恒温水浴锅中溶解2 h. 趁热将丝素混合溶液进行抽滤除杂,用分子量为3.5 kDa的纤维素半透膜透析3天,获得丝素蛋白溶液,取部分冻干定量,放入4 ℃冰箱储存[18].
-
取50 mg的丝素蛋白溶液,加入NHS和EDC(比例为1∶6∶6)活化1 h,再加入0.2 mg cRGD溶液(1 mg/mL),室温避光搅拌12 h,即获得SF/cRGD.
-
先提前将19.4 mg的Bi(NO3)·5H2O溶于2 mL的HNO3溶液中,并将15.76 mg的MnCl2·4H2O溶于2 mL的去离子水中. 随后,将Bi(NO3)·5H2O加入到50 mg的丝素蛋白溶液或SF/cRGD溶液中,并用NaOH调节pH值到12,再加入MnCl2·4H2O,置于37 ℃下搅拌12 h,转移至透析袋中透析24 h,得到产物MnO2/Bi2S3-SF以及MnO2/Bi2S3-SF/cRGD(分别简写为MB-SF、MB-SF/cRGD),置于4 ℃储存[19].
-
用透射电子显微镜观察MB-SF/cRGD纳米材料的形貌. 通过傅里叶变换红外光谱仪检测各样品的特征峰. 通过动态光散射粒度仪测量纳米粒子的流体动力学尺寸以及表面电势. MB-SF/cRGD的化学元素以及元素价态由X射线光电子能谱仪表征.
-
亚甲基蓝(MB)被·OH氧化后在655 nm波长处有特征吸收峰,可用于测试过氧化物酶活性. 在25 mmol/L NaHCO3缓冲体系中,使用MB(10 μg/mL)探究MB-SF/cRGD在不同体系中产·OH的性能. 检测MB-SF/cRGD分解H2O2产生O2性能的具体步骤如下:将MB-SF/cRGD溶解于磷酸盐缓冲溶液,设置一系列浓度梯度后,加入10 mmol/L H2O2,使用溶解氧测定仪检测溶液中的氧浓度,利用GSH能与2-硝基苯甲酸(DTNB)反应生成黄色GSSG,检测谷胱甘肽过氧化物酶活性;将DTNB溶解在磷酸缓冲溶液(pH=8,EDTA 1 mmol/L)中,终浓度为4 mg/mL;将MB-SF/cRGD分散在0.2 mg/mL GSH中,随后加入200 μL DTNB,室温孵育0~4 h,利用紫外可见分光光度计测量.
-
使用鼠源成纤维细胞(L929)评估MB-SF/cRGD对小鼠正常细胞的生物相容性. 实验步骤为:将L929细胞以1×104每孔接种到96孔板中(37 ℃,12 h);随后使用不同浓度MB-SF/cRGD与细胞共培养24 h,弃去培养液,PBS洗涤3遍;接着每孔加入200 μL MTT(0.5 mg/mL)培养4 h,弃去上清液,加入200 μL DMSO,震荡15 min使紫色甲臜完全溶解;最后使用酶标仪检测每孔在490和630 nm波长处的吸光度(OD值). 按照式(1)计算每孔细胞存活率:
溶血率实验是先取BALB/c雌鼠眼眶血,使用PBS离心洗涤3遍(3 000 rpm,5 min). 然后,将红细胞按4%(v/v)的比例与一系列浓度梯度的MB-SF/cRGD(PBS体系)混合. 同时,设置阳性对照组,将去离子水与红细胞混合. 在37 ℃条件下反应6 h后,10 000 rpm离心10 min,取上清液在酶标仪上检测570 nm处的吸光度. 然后根据式(2)计算小鼠细胞溶血率:
-
使用小鼠乳腺癌肿瘤细胞(4T1)评估MB-SF/cRGD对肿瘤细胞的毒性. 将4T1癌细胞以1×104个细胞每孔接种到96孔板中(37 ℃,12 h),然后用不同浓度MB-SF/cRGD与细胞分别共培养24,48,72 h,后续按照MTT法测量细胞活力.
-
为了分析cRGD对肿瘤细胞摄取的影响,使用二氢卟吩e6(Ce6)作为荧光标志物修饰纳米粒子. 具体操作如下:先将30 mg EDC和20 mg NHS溶解于MB-SF或MB-SF/cRGD的水溶液体系中(1 mg/mL),并在搅拌状态下进行30 min的羧基自由基活化;使用去离子水离心洗涤3遍后,将沉淀物与Ce6(1 mg/mL)混合,室温避光搅拌24 h;最后通过离心洗涤获得与Ce6共价连接的MB-SF和MB-SF/cRGD,并使用流式细胞仪检测癌细胞对其的吞噬效果.
将4T1细胞接种到12孔板(5×104个细胞/孔)中,在37 ℃培养箱培养12 h. 使用浓度为100 μg/mL的MB-SF、MB-SF/cRGD的培养液与不同孔细胞分别共培养0~6 h. 然后使用含0.25% EDTA的胰蛋白酶消化,PBS清洗后,重悬于含有Ca2+、Mg2+的PBS中,使用流式细胞仪进行单个细胞荧光强度分析.
-
为了检测MB-SF/cRGD在癌细胞中产活性氧性能,将4T1癌细胞接种到12孔板(1×105个细胞/孔)中培养过夜,加入浓度均为100 μg/mL的MB-SF、MB-SF/cRGD材料,共培养8 h,空白对照组加入等体积PBS. 共培养结束后使用PBS洗涤3遍,与DCFH-DA(10 μM)处理30 min,再用PBS洗涤3遍,用DAPI染色10 min,进行共聚焦拍照.
为检测细胞水平MB-SF/cRGD对谷胱甘肽的消耗能力,将4T1细胞与MB-SF、MB/cRGD在96孔板(1×104细胞/孔)中共培养8 h,然后加入50 μL提前预冷的6.5% TCA,在4 ℃条件下裂解细胞30 min,随后加入250 μL的DTNB(4 mg/mL),避光震荡5 min,最后使用酶标仪检测412 nm波长处的吸光度.
-
为进一步研究MB-SF/cRGD的抗肿瘤效果,通过免疫荧光评估ICD生物标志物CRT和HMGB1. 具体步骤如下:将12孔板(3×105个细胞/孔)中的4T1细胞在37 ℃条件下培养过夜,后续步骤与检测活性氧的处理步骤相似;然后使用多聚甲醛(4%)固定细胞15 min,再加入Triton X-100(0.1%)孵育15 min,使用BSA(1%)进行封闭1 h;随后使用CRT(2 μg/mL)或HMGB1(2 μg/mL)一抗与处理过的细胞孵育过夜(4 ℃),然后继续在4 ℃条件下用携带有Cy3或FITC(2 μg/mL)的二抗孵育4 h;经DAPI染色10 min后,使用共聚焦显微镜分析不同组间荧光差异.
另一方面,通过ATP试剂盒检测细胞内ATP释放情况,将处理后的悬浮细胞(与GSH消耗能力实验处理相似)使用ATP裂解液在冰上裂解1 h,然后在4 ℃条件下12 000 rpm离心10 min,取上清,并按照说明书步骤检测ATP含量.
-
为了直观观察MB-SF/cRGD对癌细胞的杀伤效果,将4T1细胞接种到12孔板(2×105个细胞/孔)中培养12 h后,分别加入等体积PBS、MB-SF、MB-SF/cRGD共培养. 随时观察细胞形态,待细胞变为圆形且大小均一时,按照Calcein AM/PI试剂盒步骤对细胞进行染色. 清洗过后使用倒置荧光显微镜拍照.
-
所有动物实验流程均通过西南大学动物保护和使用委员会的批准,并遵循《实验动物动物实验通用要求》(GB/T 35823-2018). 购买4周龄小鼠,饲养1周后,将对数生长时期的4T1细胞注射进入雌性BALB/c小鼠右侧后背皮下,等待1周左右,肿瘤体积达到200 mm3左右,成功构建实体瘤模型. 根据下式计算肿瘤体积:
式中:V为肿瘤体积;l为肿瘤最长直径;w为肿瘤最短直径.
-
在动物水平上研究MB-SF/cRGD对小鼠肿瘤生长的抑制作用. 将小鼠分为生理盐水、MB-SF、MB-SF/cRGD 3组,在第0、5 d分别静脉注射生理盐水100 μL,MB-SF、MB-SF/cRGD组按照浓度为5 mg/kg注射100 μL到小鼠体内,每两天测量一次肿瘤体积. 到第14 d时,将所有老鼠进行安乐死处理. 取小鼠实体肿瘤称重,并将肿瘤用于H&E染色,Ki67、CRT、HMGB1免疫组化染色以及TUNEL、CD8+免疫荧光染色等组织学病理分析. 根据肿瘤生长抑制率(TGI)计算肿瘤抑制生长程度:
式中:RTGI为肿瘤抑制生长程度;VC为注射生理盐水组小鼠的肿瘤体积;VT为不同药物处理组的肿瘤体积.
1.1. 实验仪器与试剂
1.2. MB-SF、MB-SF/cRGD的合成
1.2.1. 丝素蛋白的制备
1.2.2. SF/cRGD的合成
1.2.3. MB-SF和MB-SF/cRGD的合成
1.3. 材料的表征
1.4. 体外性能分析
1.5. 生物相容性
1.6. 体外细胞毒性
1.7. 细胞摄取
1.8. 产活性氧能力和GSH消耗能力
1.9. ICD生物标志物检测
1.10. 活/死细胞染色
1.11. 建立4T1皮下瘤模型
1.12. 体内抗肿瘤
-
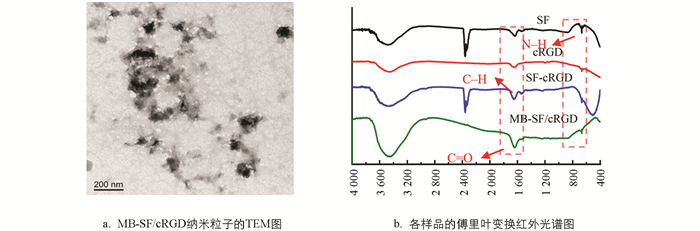
图 1a是合成MB-SF/cRGD纳米粒子透射电子显微镜(TEM)图片,由此可以看出由三步合成的MB-SF/cRGD呈现出不规则形状且粒径小于200 nm. 图 1b是各样品的傅里叶变换红外光谱图,MB-SF/cRGD具有酰胺V带(N-H,665 cm-1)、酰胺III带(C-H,1 228 cm-1)以及酰胺Ⅰ带(C=O,1 640 cm-1),与丝素蛋白(SF)的特征峰完全符合,证实了MB-SF/cRGD中包含有丝素蛋白[20-21].
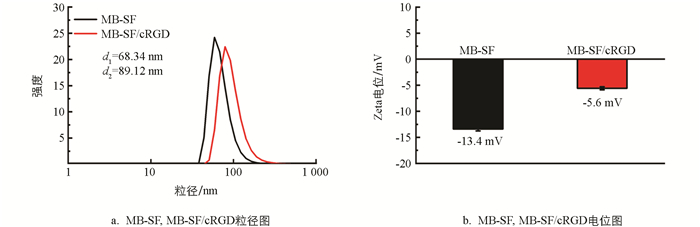
图 2a、2b分别是MB-SF与MB-SF/cRGD纳米粒子在纯水中的流体动力学粒径图以及电位图,MB-SF修饰cRGD后,MB-SF/cRGD的流体动力学直径比MB-SF增大约20 nm. 由图 2b可以看出,MB-SF修饰cRGD后电位从-13.4 mV变为-5.6 mV. 以上结果均说明了cRGD成功共价连接在MB-SF表面从而改变纳米材料粒径大小以及电位.
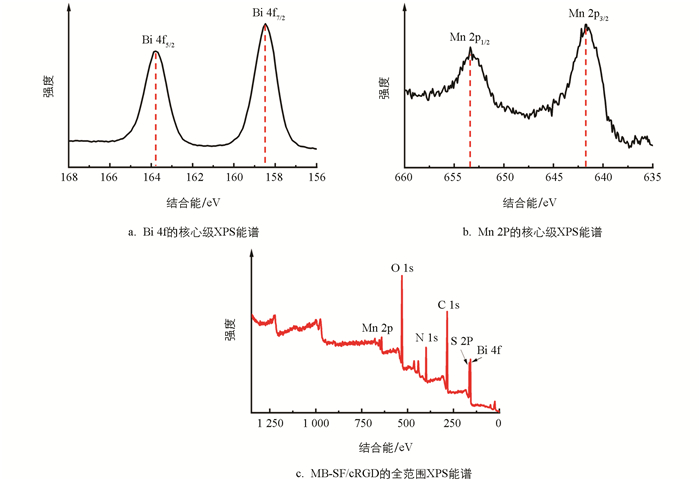
图 3是MB-SF/cRGD的X射线光电子能谱图(XPS). 图 3a是Bi 4f的核心级XPS能谱图,164.8 eV和159.4 eV结合能分别对应Bi 4f5/2和Bi 4f7/2,与其相对应的是Bi3+[22]. 图 3b是Mn 2P的核心级XPS能谱图,641.8 eV和653.3 eV结合能分别对应Mn 2p3/2与Mn 2p1/2,与其相对应的是Mn2+/Mn3+[23-24]. 全范围的XPS能谱图证实了MB-SF/cRGD由Mn、Bi、C、S、O、N和O元素组成(图 3c). 上述数据证明了Bi2S3/MnO2-SF/cRGD纳米材料成功合成.
-
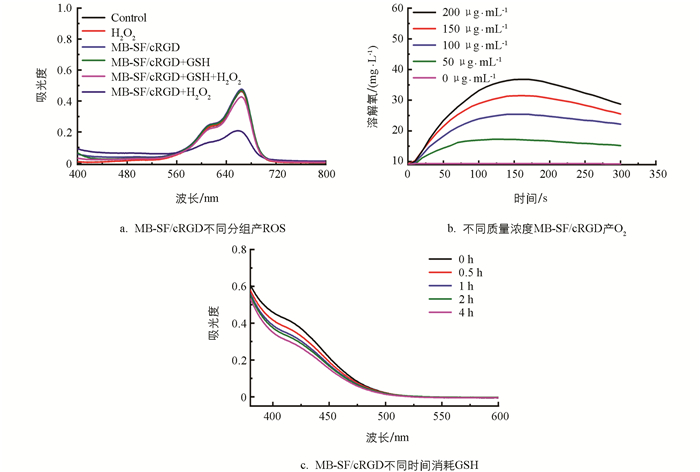
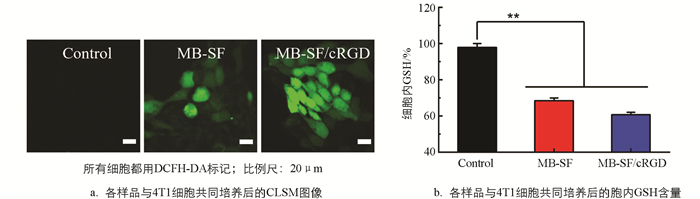
根据上述数据表明MB-SF/cRGD纳米药物中MnO2具有+2和+3价,因此MB-SF/cRGD具有多种酶活性,包括CAT、POD. 这对O2和·OH的产生、GSH的消耗至关重要. 在富含HCO3-的情况下,Mn2+能够发挥类Fenton效应,发生MnO2+HCO3-+H2O2→·OH+H2O反应,从而分解内源性H2O2产生·OH[23]. 因此,在探究MB-SF/cRGD产ROS的性能实验中采用25 mmol/L NaHCO3缓冲液体系. 首先,为探究MB-SF/cRGD在不同环境中产活性氧的效率,按Control、H2O2、MB-SF/cRGD、MB-SF/cRGD+GSH、MB-SF/cRGD+GSH+H2O2、MB-SF/cRGD+H2O2分组,其中MB-SF/cRGD质量浓度为200 μg/mL,使用MB试剂检测·OH产生情况,可以明显看到MB-SF/cRGD+H2O2组活性氧产率最高,Control、H2O2、MB-SF/cRGD、MB-SF/cRGD+GSH组几乎没有产生活性氧,MB-SF/cRGD+GSH+H2O2组由于GSH的存在产活性氧效率大大降低(图 4a). 然后为探究不同质量浓度MB-SF/cRGD产O2的效率,配置了0、50、100、150、200 μg/mL的MB-SF/cRGD溶液,并在室温条件下检测溶解氧产率与时间的关系. 由图 4b可以看出,溶解氧产率随着MB-SF/cRGD浓度增大而升高. 此外,MB-SF/cRGD在肿瘤微环境中还会发生2GSH+MnO2+2H+→GSSG+Mn2++2H2O反应. 因此,使用DTNB试剂检测MB-SF/cRGD与还原性谷胱甘肽分别孵育0,0.5,1,2,4 h后,在412 nm波长处的吸光度. 由图 4c可以看出,MB-SF/cRGD随时间增加消耗越来越多的GSH,证明了MB-SF/cRGD具有类谷胱甘肽过氧化物酶(GSH-Px)活性,可以消耗内源性GSH.
-
上述实验结果表明本研究所构建的MB-SF/cRGD体系具有良好的活性氧生成能力、产生氧气的能力以及消耗GSH能力. 于是进一步对MB-SF/cRGD的生物应用展开研究. 首先,为了确保MB-SF/cRGD在生物应用时的安全性,进行了生物相容性实验. 分别将0,12.5,25,50,100,200 μg/mL质量浓度的MB-SF/cRGD与L929细胞共培养24 h. 当药物浓度达到200 μg/mL时,细胞存活率仍然高达70%以上,根据此数据可以推出MB-SF/cRGD具备良好的生物相容性(图 5a). 相比之下,在相同药物剂量以及时间处理下,小鼠乳腺癌细胞(4T1)活力大大降低. 当浓度为200 μg/mL,处理时间为72 h时,大量肿瘤细胞被杀死,存活率仅24.3%(图 5b). 这种特异性抗肿瘤特性可能是由于cRGD介导的主动靶向肿瘤以及Mn2+/Mn3+对肿瘤内部高H2O2水平引发的CDT效应等原因[25-26].
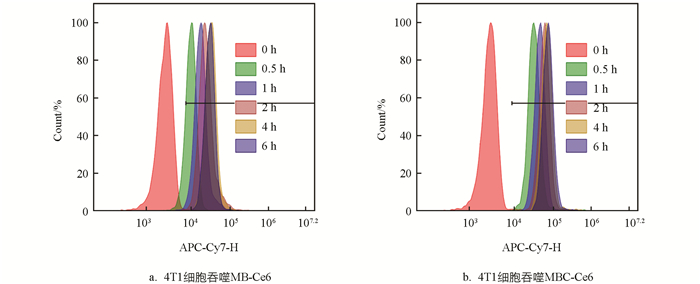
紧接着分别将连接有Ce6的MB-SF和MB-SF/cRGD与4T1细胞按0,0.5,1,2,4,6 h共培养后,再使用流式细胞仪取样分析. 从图 6a、6b可以看出,MB-SF/cRGD-Ce6在与细胞共培养0.5 h时,几乎所有细胞都已成功吞噬纳米材料,而MB-SF-Ce6还有一部分细胞未吞噬材料. 由此成功证明了cRGD主动靶向肿瘤细胞的特性增强了4T1细胞对MB-SF/cRGD纳米材料的吞噬效果,并由此推断较强的吞噬效果有利于提高药物对肿瘤的治疗效果[27].
为验证这个推论,实验分为Control、MB-SF、MB-SF/cRGD 3组进行研究. 从图 7a、7b可以看出,修饰了cRGD的MB-SF/cRGD比MB-SF产生更多的ROS,消耗了细胞内更多GSH. 证明了cRGD增强了4T1细胞对纳米材料的吞噬,从而提高了产活性氧效率以及消耗谷胱甘肽的能力. 因此,在这一研究基础上,推断MB-SF/cRGD与MB-SF相比,MB-SF/cRGD对肿瘤治疗效果有着显著的提升(*p<0.05,**p<0.01,***p<0.001).
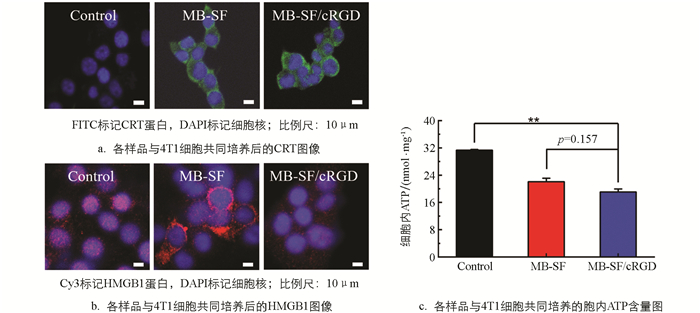
据报道,肿瘤细胞在受到药物刺激时,会引发免疫原性细胞死亡(ICD). 在免疫原性细胞死亡过程中,会有一系列损伤相关分子(DAMPs)发生变化. 钙网蛋白(CRT)从内质网迁移到细胞表面,释放“eat”信号,被免疫细胞识别进而杀伤肿瘤细胞. 高迁移率族蛋白B1(HMGB1)从细胞核易位到细胞质,起到促进免疫细胞成熟的功效. 三磷酸腺苷(ATP)从细胞中释放出来. 图 8a可以明显看到MB-SF/cRGD导致4T1细胞中大量CRT释放出来. MB-SF/cRGD组比MB-SF组也发生了更显著的HMGB1易位(图 8b). 图 8c表明经过MB-SF/cRGD药物处理后,细胞内ATP含量较少,表明细胞中更多的ATP释放出去. 上述数据均表明4T1细胞在MB-SF/cRGD药物刺激下,激发了比MB-SF组更强的免疫原性细胞死亡(*p<0.05,**p<0.01,***p<0.001)[28].
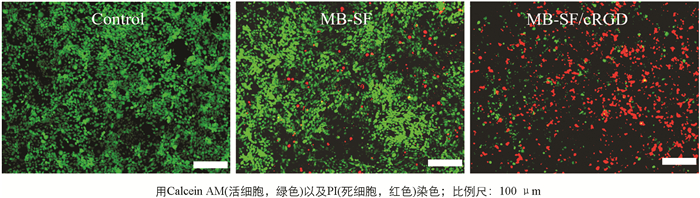
为了更直观地观察细胞水平抗肿瘤效果,使用钙黄绿素乙酰甲酯对活细胞进行染色(绿色),使用碘化丙啶对死细胞进行染色(红色),用荧光显微镜记录并观察样品,结果如图 9所示.
图 9可以直观地看到,MB-SF/cRGD药物处理组的红色荧光数量最多,同时绿色荧光也是最少的. 表明MB-SF/cRGD杀死癌细胞数量最多,MB-SF效果次之. 该实验结果与上述活性氧、胞内谷胱甘肽以及ICD生物标志物实验结果一致. 以上数据表明所构建的MB-SF/cRGD体系因为cRGD的存在,在细胞水平高效发挥化学动力学治疗疗效,提高了细胞水平肿瘤治疗效果.
-
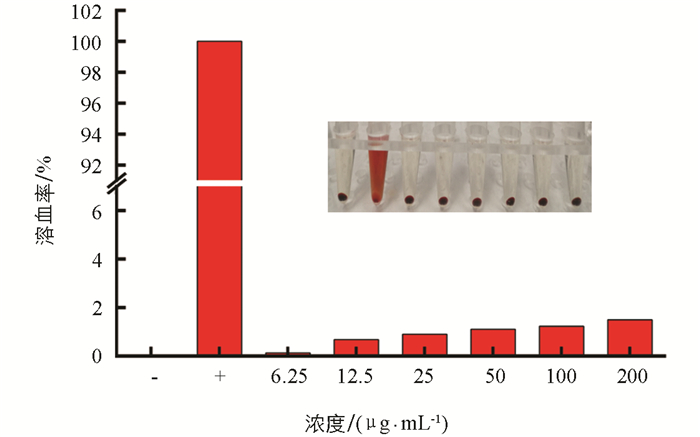
在动物水平探究了MB-SF/cRGD对小鼠血液的生物相容性. 将0、6.25、12.5、25、50、100、200 μg/mL浓度梯度的MB-SF/cRGD与红细胞共培养. 根据比浊法测定的结果显示,MB-SF/cRGD浓度为200 μg/mL时,溶血率为1.45%,远小于5%,这表明MB-SF/cRGD对小鼠血液也具有良好的生物相容性(图 10).
为进一步验证MB-SF/cRGD药物的抗肿瘤性能,在动物水平上作进一步的研究. 在2周的治疗时间里记录小鼠肿瘤体积变化以及治疗结束后离体肿瘤重量. 图 11a可以看出MB-SF/cRGD组肿瘤不仅与生理盐水组形成鲜明对比,与MB-SF治疗组也形成显著差异. 此外,与生理盐水组和MB-SF组相比,在肿瘤体积方面MB-SF/cRGD起到了较强的肿瘤治疗效果. 根据式(4)计算肿瘤生长抑制率(TGI),到第14 d时MB-SF/cRGD药物处理组TGI指数高达90.9%(图 11b)(*p<0.05,**p<0.01,***p<0.001).
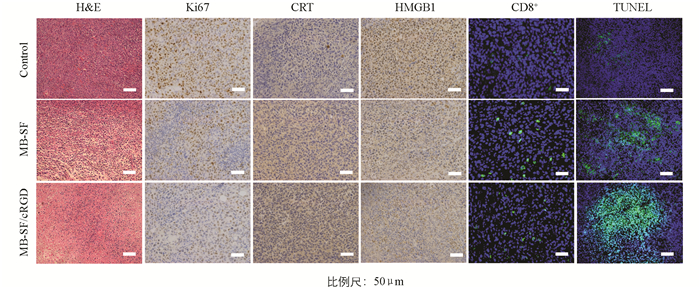
将小鼠实体瘤用于H&E、TUNEL、Ki67、CRT、HMGB1、CD8+染色并进行组织学分析(图 12). 在H&E切片中,MB-SF/cRGD药物处理组切片表现出最严重的组织损伤,表现为严重的核破裂、核溶解. 在TUNEL以及Ki67切片中,MB-SF/cRGD药物处理组分别表现出高水平的绿色荧光凋亡信号和阳性细胞的显著减少,证明了MB-SF/cRGD抑制肿瘤细胞生长和侵袭的能力显著提升. 此外,在动物水平上也激发了强烈的免疫原性细胞死亡(ICD),CRT和HMGB1切片数据分别表明MB-SF/cRGD药物处理组可以引发显著的CRT暴露、HMGB1易位[29]. CD8+细胞作为免疫的主力军,发挥了重要作用. 从CD8+免疫荧光切片可以看出,MB-SF/cRGD药物处理组CD8+免疫细胞表达更多,说明修饰了cRGD能有效激发免疫应答,进行高效肿瘤治疗[30].
2.1. 形貌、物相和元素分析
2.2. 性能分析
2.3. 细胞水平抗肿瘤性能分析
2.4. 动物水平抗癌性能分析
-
本研究构建的MB-SF/cRGD纳米材料分别在细胞以及动物水平上进行肿瘤治疗性能研究,并且从多角度证明MB-SF/cRGD与MB-SF相比抗肿瘤效果更加显著. 由于MB-SF/cRGD修饰有cRGD,因此赋予了该材料主动靶向癌细胞的功能,实现了高效的ROS产率以及GSH消耗能力,从而击溃肿瘤细胞的抗氧化系统. 同时消耗内源性H2O2产生O2,缓解了内部乏氧. 当材料浓度仅为200 μg/mL时,肿瘤细胞死亡率高达75.7%. 在动物水平,MB-SF/cRGD浓度仅为5 mg/kg时,肿瘤抑制率达到90.9%. 此外,MB-SF/cRGD复合体系中还含有Bi2S3,Bi2S3由于具有1.33 eV带隙宽度,成为一种优良的光热剂,可用于抗肿瘤光热治疗. 但在本文中并未对Bi2S3功能开展进一步的探究,在未来的研究中会深入探索. 总之,本文报道的MB-SF/cRGD体系能够通过主动靶向癌细胞实现高效的化学动力学治疗,在肿瘤治疗领域有巨大的应用潜力.



 下载:
下载: