-
苹果(Malus domestica Borkh.)作为一种世界性水果, 栽培历史悠久, 种植范围虽然广泛, 但主要分布在温带地区[1]. 世界苹果的种植栽培模式经历了3个阶段: 乔化稀植乔化密植矮化密植[2]. 目前, 我国矮砧密植苹果园占比非常少, 甚至不足10%, 优良矮化砧木高效繁育技术体系尚未很好建立[3-4]. 造成这一局面的原因是矮化砧木在实际生产中受不定根形成困难的限制, 以至于矮化砧木目前多以中间砧的形式在苹果栽培上利用[5]. 由此看来, 苹果园的矮化集约栽培的关键在于矮化砧木的选用, 因此加强无性砧木育种技术对促进我国矮化苹果的种植, 提高果业效率, 增加果农收入等具有重要意义[6].
植物的根系是土壤和植物茎等地上部分进行物质交换的媒介[7]. 植物的根系包含了主根、侧根和须根, 此外, 不定根也是植物根系的一部分. 根系中不定根是在茎、叶或胚轴等组织发生的根, 发生的位置并不固定[8-9]. 不定根形成是薄壁细胞或根原基与维管束之间的细胞经过分化, 随后经过薄壁细胞分裂增大形成形成层, 而后不定根原基分化形成不定根[10-11]. 研究发现苹果砧木M9不定根的发育可分为3个阶段: 形成层细胞分裂阶段、不定根原基形成阶段和不定根原基分化形成不定根阶段[11]. 多种因素可影响不定根发育, 其中植物基因型是该生长发育过程的主要决定性影响因素[12]. 此外, 多种内源激素影响不定根的发生, 如细胞分裂素(cytokinin, CTK), 它的主要生理功能为促进细胞分裂, 生长素(IAA)与细胞分裂素共同调控植物不定根的发生, 两者对不定根发育具有相互拮抗作用[13]. 在植物组织培养条件下, CTK/IAA比值较大时不利于不定根的分化和形成, 当CTK/IAA的比值较小时能有效地促进苹果砧木不定根的发生[14]. 通过上述现象可以得知, 细胞分裂素显著影响了苹果砧木不定根的发生. 细胞分裂素信号转导途径是一种具有双组分的激素信号通路, 组氨酸激酶(HK)是位于生物膜上的CTK信号受体, 通过表达出组氨酸激酶蛋白参与非生物胁迫从而调控植物发育的过程[15]. 在拟南芥中, 有3个HK基因(AHK4/CRE1/WOL, AHK2和AHK3);玉米中有3个HK基因(ZmHK1, ZmHK2和ZmHK3a);水稻中有6个HK基因(OsHK1~OsHK6). 它们的共同特点为结构保守, 均含配体结合位点(ligand binding site)、激酶结构域(His kinase domain)和接收结构域(receiver domain)3个主要组成部分[16-20]. 拟南芥中CRE1功能缺失, 降低了对CK的敏感度[18];AHK2超表达后提高了CK诱导基因的表达[21];AHK2, AHK3和AHK4的单突到多突变体表型逐渐严重, 尤其是同时缺失时对根的发育具有重要影响[22-23].
总体而言, 大量研究表明AHK在调节植物的生长发育方面具有重要作用, 但对AHK家族基因分析和鉴定工作目前主要集中在拟南芥和水稻等模式植物上. 苹果中MdAHK家族成员参与植物一些生长发育过程的原理尚未有试验明确说明, 尤其是MdAHKs在调控苹果砧木不定根发育的过程尚未有人获得研究成果. 因此本试验通过对苹果MdAHK家族成员进行系统鉴定并定量验证了MdAHKs各家族成员在“M9-T337”砧木不同组织(果、花、叶、茎、花芽、腋芽、侧根和须根)及不同时期的表达情况;进一步解析苹果中MdAHK的潜在功能, 有助于开展MdAHK调控不定根发育的后续分子机理的研究, 从而丰富调控不定根发育的理论依据.
全文HTML
-
试验材料为“M9-T337”苹果砧木组培苗. 设置组培环境为湿度70%~80%;昼间温度为(25±1) ℃, 夜间温度为(15±1) ℃;光照16 h和黑暗8 h. 基本培养基配方为MS+30 g/L蔗糖+8 g/L琼脂(pH值5.8);第1种对照培养基配方为基本培养基基础上另外加入0.5 mg/L IBA;第2种6-BA处理的培养基配方为基本培养基中加入0.6 mg/L的6-BA和0.5 mg/L的IBA;第3种细胞分裂素抑制剂处理的培养基配方为基本培养基中加入0.5 mg/L IBA和0.6 mg/L细胞分裂素抑制剂(Lovastatin). 后期的图表中分别以I, I+6-BA和I+Lov表示上述3种处理.
取样的时间分为5个时期, 即不定根发育1 d, 3 d, 7 d, 11 d和19 d, 每种试验处理和各个取样时期分别设有3个生物学重复. 每次取样时需要50株苹果组培苗, 要求这些苹果组培苗的生长状态良好且相似, 样品选取完成后, 在每个组培苗样品茎的基部位置(长度约0.5 cm)取试验材料. 此外, 在国家苹果改良中心杨凌分中心种质资源圃采集“M9-T337”植株不同部位组织(侧根、侧根上的细小根毛、茎、叶、花、果、花芽和腋芽)用于组织特异性表达分析. 将上述采集的所有试验材料均放入液氮进行冷冻处理, 保存在-80 ℃的超低温冰箱内以便接下来的试验使用.
-
登录拟南芥生物信息资源官方网站(TAIR, https://www.arabidopsis.org/), 在该信息资源网站上直接下载拟南芥组氨酸激酶蛋白的一级结构序列, 之后可以直接访问NCBI(https//www.rosaceae.org/tools/ncbi_blast), 然后以拟南芥AHKs氨基酸序列搜索苹果序列, 两者进行分析和对比, 去除其中的相同序列部分, 于是在整个苹果基因组中还剩下11个MdAHK基因. 根据这11个基因在染色体上的位置, 将这11个MdAHK基因按次序命名.
下载拟南芥和苹果蛋白序列构建系统进化树, 选用MEGA5.10软件[24]进行分析;进化树生成算法采用邻接法(Neighbor-Joining, NJ), 校验参数Bootstrap设置为1 000, 缺口设置“complete deletion”, 模式采用“poisson correction”, 具体参数设置参考前人的研究方法[25].
-
登录在线的MEME数据库(http://meme.nbcr.net/meme/), 在该数据库中下载AHK蛋白的保守基序. 基序的数量参数设置为10, 其余的参数为默认. 在PlantCARE数据库(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析MdAHK基因转录区域的起始位置上游1 500 bp的基因序列区域启动子顺式作用元件[26].
-
登录GEO数据库(http://www.ncbi.nlm.nih.gov/geo/;登录号: GSE42873), 在该数据库上下载苹果10个不同基因型(M67, M74, M20, M49, M14, GD, X8877, X442×X2596, X4102和X3069×X922)在苹果不同组织(花、果、幼苗、种子、叶、根和茎)中的基因表达量, 并将得到的基因表达数据利用MEV4.9.0软件制图.
-
利用实时荧光定量PCR技术可测定苹果MdAHK家族的每个成员在组培条件下“M9-T337”砧木的不同组织(茎、叶、花、果、花芽、腋芽、侧根和须根以及不定根)发育的5个时期(1 d, 3 d, 7 d, 11 d和19 d)的表达模式并进行分析. 利用Primer premier 6.0软件, 设计基因的特异性定量引物(表 1), 苹果内参基因特异性引物(EF-1α-F: 5′-ATTCAAGTATGCCTGGGTGC-3′;EF-1α-R: 5′-CAGTCAGCCTGTGATGTTCC-3′)的分析方法参照前人的研究[27].
以上述的各种组织材料所提取的RNA进行反转录即可直接得到反应材料cDNA, 以此cDNA为qPCR模板, 利用实时荧光定量PCR试剂盒在实时荧光定量PCR仪上进行RT-qPCR试验. 反应体系见表 2.
反应程序为: 95 ℃预变性3 min, 94 ℃变性15 s, 60 ℃复性20 s, 72 ℃延伸20 s, 40个循环. 采用2-ΔΔCT法计算基因的相对表达量[28].
利用Excel 2010和SPSS 17.0软件对RT-qPCR的测定结果数据进行整理, 每组数据在t-test为0.05水平上进行统计分析, 最后通过SigmaPlot 13.0软件进行图表绘制.
1.1. 植物材料及处理方法
1.2. 试验方法
1.2.1. 苹果MdAHKs基因鉴定及系统进化分析
1.2.2. 苹果MdAHKs保守基序及启动子顺式元件分析
1.2.3. 苹果基因型及组织表达分析
1.2.4. 实时荧光定量PCR(RT-qPCR)分析
-
通过生物信息学的分析, 苹果全基因组中共鉴定出11个属于MdAHK基因这一家族的基因, 并将它们依据其染色体位置依次命名为MdAHK1~MdAHK11. MdAHK家族的11个成员分别定位到了2号、8号、9号、11号、13号、15号、16号和17号染色体上. 其中有3个染色体(13、15和16号)上分别定位了2个基因, 而其他的染色体分别定位了1个基因. 此外, MdAHK的CDS序列为2 706 ~3 693 bp, 其中, MdAHK4的蛋白质编码区序列最短, 为2 706 bp, MdAHK1的蛋白质编码区序列最长, 达到3 690 bp. MdAHK蛋白氨基酸长度为901(MdAHK4)~1 230(MdAHK8). MdAHK分子量为10 049.36~138 022.11 Da, 其中MdAHK4的分子量最小, MdAHK1分子量最大. MdAHK蛋白的等电点为4.95(MdAHK7)~ 8.56(MdAHK10). 在11个苹果AHK蛋白家族中, 不稳定性指数为37.77(MdAHK8)~50.70(MdAHK7), 均大于35, 说明它们是不稳定性蛋白. MdAHK蛋白的亲水指数最小为-0.601(MdAHK7), 最大为-0.094(MdAHK10), 亲水指数越小的蛋白亲水性越强, 疏水性越弱(表 3).
-
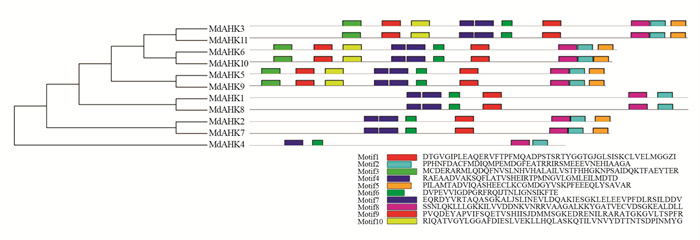
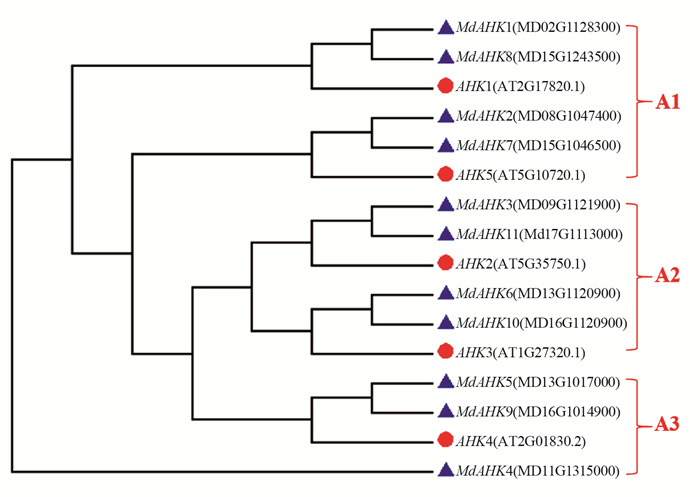
利用苹果中鉴定出的MdAHK蛋白(11个)的蛋白序列和拟南芥中的AHK(5个)的蛋白序列构建系统进化树, 并将其分为A1, A2和A3共3个蛋白序列亚组, 其中A1和A2分别包含6条蛋白序列, A3含有4条蛋白序列(图 1). 由图 1可知, 苹果中MdAHK1, MdAHK8与拟南芥中AHK1同源性较高, 可能存在相似的功能;苹果中MdAHK2, MdAHK7与拟南芥中AHK5同源性较高;MdAHK4, MdAHK5, MdAHK9与拟南芥中AHK4同源性较高, MdAHK3, MdAHK11与拟南芥中AHK2同源性较高;MdAHK6, MdAHK10与拟南芥中AHK3同源性较高可能具有相似的功能. 上述的系统进化关系分析结果为后续开展苹果中MdAHKs家族基因的研究提供参考依据.
保守基序分析发现, 11个MdAHK基因的保守基序数量在4~10之间不等, 其中保守基序数量最少的MdAHK4只有4个保守基序, MdAHK1和MdAHK8保守基序数均为6个, MdAHK2和MdAHK7具有7个保守基序. 而其他MdAHK成员具有10个保守基序(图 2).
-
通过对MdAHK基因家族转录起始位置上游1 500 bp的启动子序列进行启动子元件分析, 搜索其顺式作用元件的种类及其数量, MdAHK启动子共鉴定筛选出9种顺式作用元件, 其中包括光信号、赤霉素、茉莉酸甲酯、玉米素、生长素、脱落酸、水杨酸和胁迫反应等相关的顺式作用元件. 而且每个MdAHK基因启动子对应的顺式作用元件种类和数目均存在较大的差异. 其中MdAHK5, MdAHK6, MdAHK8和MdAHK9的顺式作用元件最少, 只有14个;MdAHK7顺式作用元件数量最多, 有27个;其余成员基因的顺式作用元件数量介于17和25个之间(表 4).
-
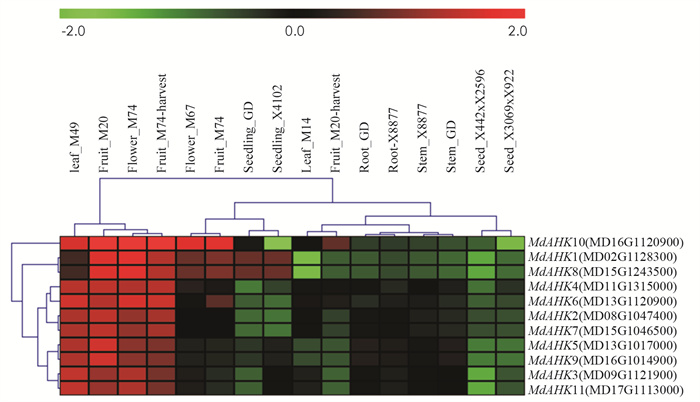
为了初步验证预测结果, 探究苹果MdAHK基因家族的各个成员在不同组织中的表达量, 从GEO数据库提取并下载了来自于10个基因型的苹果不同组织(花、果、幼苗、种子、叶、根和茎)中的表达量. 总体的结果分析如图 3所示, 其中11个MdAHKs基因在M49叶、M20幼果、M74花和M74果中均具有较高的表达, 而在M14叶、X442×X2596种子和X3069×X922种子中的表达量相对较低. 其中MdAHK1, MdAHK8, MdAHK10在M20幼果、M74花、M74果中高表达, MdAHK5, MdAHK9在根和茎中低表达. 值得一提的是, 本研究主要是针对苹果砧木不定根发育研究, 应重点分析和关注不同基因在苹果砧木根和茎生长发育过程中的表达情况. 通过图 3的结果显示, 其中MdAHK4, MdAHK5和MdAHK9在根(GD和X8877)和茎(GD和X8877)中的表达水平相对高于其他家族成员. 这也预示MdAHK4, MdAHK5和MdAHK9基因在调控苹果根发育方面可能存在着潜在功能. 这些结果为进一步研究MdAHK基因的功能提供了参考依据.
-
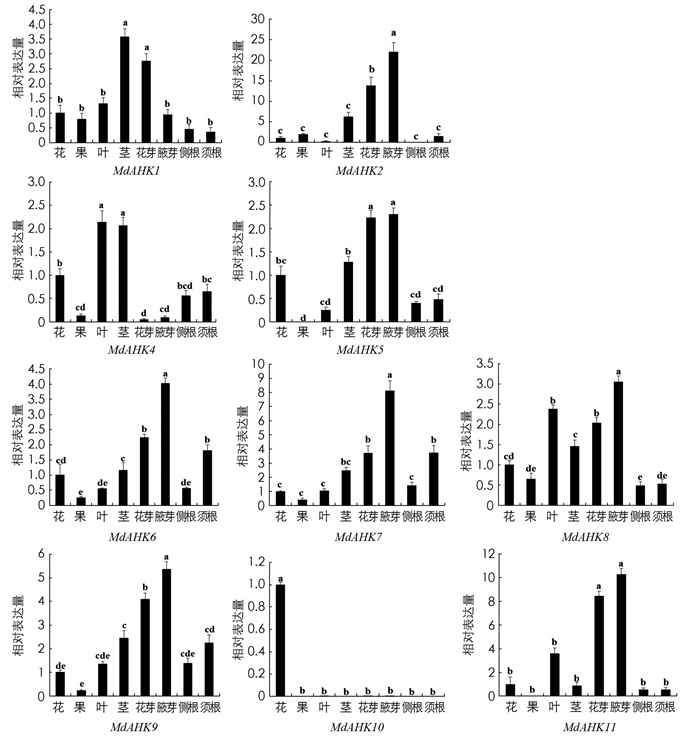
以砧木“M9-T337”为试验材料, 测定了苹果MdAHKs在果、花、叶、茎、花芽、腋芽、侧根和须根中的表达模式, 可将其大致分为5类. 第1类: MdAHK10在花中表达量最高, 而在其他组织部位的表达量较低或不表达;第2类: MdAHKs所有家族成员均可以在果实中表达但在果实中仅具有较低的表达水平, 其中MdAHK5, MdAHK11在果实中甚至不表达, 但在苹果的腋芽和花芽中的表达较高且显著高于其他组织部位;第3类: MdAHK2, MdAHK6, MdAHK7和MdAHK9在苹果腋芽和花芽中的表达水平较高, 而在其侧根和须根中表达量较低;第4类: MdAHK8在腋芽中的表达量最高, 其次是在叶中高表达, 而在茎、侧根和须根中表达量较低;第5类: MdAHK1和MdAHK4在茎中具有较高表达水平, 其中MdAHK4在叶中同样高表达, 而在其他组织中的表达量较低(图 4).
-
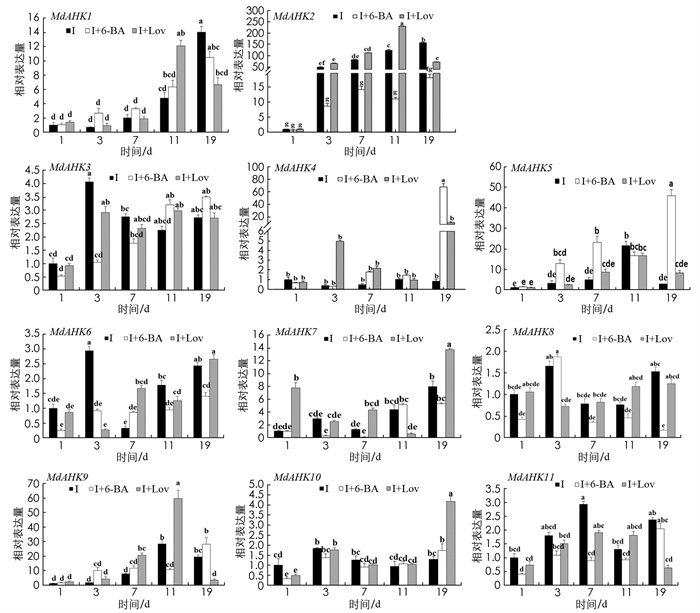
试验测定了“M9-T337”苹果砧木组培苗在不同处理条件下的1 d, 3 d, 7 d, 11 d, 19 d时各基因的表达情况, 总体的表达趋势可分为5大类. 第1类: 在IBA处理下, MdAHK1和MdAHK7在不定根发育19 d时表达量最高, MdAHK1在不定根发育19 d时的表达显著高于经过IBA+Lov处理下的表达量, MdAHK7在不定根发育19 d时的表达量显著低于IBA+Lov处理下的表达量;第2类: 在不定根发育1~11 d内, 3种处理下的MdAHK4, MdAHK10表达量较低且两者之间差异无统计学意义, 而在不定根发育19 d时, MdAHK4在IBA+6-BA处理下的表达量显著高于IBA和IBA+Lov处理, 此外, IBA+Lov处理下, MdAHK10的表达量显著高于经过IBA和IBA+6-BA处理的砧木;第3类: IBA+6-BA处理下, MdAHK2的表达量较低且差异无统计学意义, 而在IBA和IBA+Lov处理下的表达量显著高于IBA+6-BA处理;第4类: 在IBA+6-BA处理下, MdAHK5, MdAHK9和MdAHK11在不定根发育19 d时表达量最高;第5类: 在IBA对照处理下, MdAHK3, MdAHK6和MdAHK8在不定根发育3 d时表达量最高, 且高于IBA+6-BA处理, 差异有统计学意义(图 5).
2.1. 苹果MdAHK基因家族成员鉴定和理化特性分析
2.2. 苹果MdAHK基因系统进化及保守基序分析
2.3. 苹果MdAHK基因家族启动子元件分析
2.4. MdAHK在不同品种和不同器官中的表达
2.5. MdAHK在苹果砧木“M9-T337”不同组织部位的表达
2.6. MdAHK在苹果砧木“M9-T337”不定根发育过程中的表达
-
细胞分裂素在植物根系发育过程中发挥着重要功能, 主要通过抑制不定根原基的萌发来抑制不定根的发育. 目前在拟南芥中已经成功地发现了3个组氨酸蛋白激酶(AHK), 它们都参与了拟南芥中细胞分裂素的激素信号转导过程[18]. AHKs已经在拟南芥中被证明仅仅是一类功能冗余的CTK信号转导途径的正调节因子[29], 而且AHKs启动子上富含激素及胁迫响应进而参与调控植物生长发育[19]. 又因主根、侧根和不定根组织结构与生理功能的相似性, 因此开展不定根发生的分子机制研究更倾向在侧根基础上开展[30]. 此外, 在拟南芥中的研究发现组氨酸激酶AHK4作为受体蛋白能够有效介导CTK信号的产生和感应[31]. 苹果中的MdAHK家族成员与拟南芥中的AHK基因的同源性越高推测其功能越相似, 因此推测本研究中与AtAHK4同源性较高的基因(MdAHK4, MdAHK5, MdAHK9)可能通过介导细胞分裂素信号的产生参与不定根发育的调控. 结合RT-qPCR结果对可能参与调控不定根发生的MdAHK关键基因进行初步筛选. 组织特异性表达分析发现, MdAHK2, MdAHK5, MdAHK6, MdAHK7, MdAHK8, MdAHK9和MdAHK11在腋芽和花芽中高表达, 在须根和侧根中低表达, MdAHK10只在花中高表达, 只有MdAHK1和MdAHK4在茎中的表达量最高且与其他组织之间差异有统计学意义, 而不定根原基形成的主要组织又位于茎基部, 因此推测MdAHK1, MdAHK4可能参与调控不定根原基的形成. 不定根发育过程中MdAHK3, MdAHK7和MdAHK10的表达量不受IBA+6-BA处理和IBA+Lov处理的影响, 可以初步推测它们有可能不参与调控不定根生长发育的过程. IBA+6-BA处理和IBA+Lov处理都促进了MdAHK4在不定根发育19 d时的表达, 同时也抑制了MdAHK6在诱导期时的表达;IBA+6-BA处理促进了MdAHK5在不定根发育7 d和19 d时的表达, 同时抑制了MdAHK1在不定根发育19 d时的表达;IBA+Lov处理促进了MdAHK1在不定根发育11 d时的表达, 但抑制MdAHK9在不定根发育19 d时的表达. 初步分析判定MdAHK1, MdAHK4, MdAHK5, MdAHK9参与调节不定根的发育过程且主要在不定根的伸长生长期发挥作用, 而只有MdAHK6在不定根形成的诱导期发挥作用. 综上所述, 推测MdAHK1, MdAHK4, MdAHK5, MdAHK6和MdAHK9可能参与调节不定根发育.
通过启动子顺式元件分析可知, MdAHKs中存在9种顺式作用元件, 表明其家族的每一个成员不仅受到外界环境, 如冷、光、干旱等的影响, 而且还受多种激素, 如脱落酸(ABA)、生长素(IAA)、茉莉酸(JA)、赤霉素(GA)等的影响和调控, 进而参与苹果砧木不定根的生长发育过程. 此外, MdAHK家族成员MdAHK4与拟南芥AtAHK4同源性较高, 且该基因在茎中的表达水平较高, 结合GEO数据库中下载的基因表达数据可知MdAHK5, MdAHK9在根、茎中同样高表达. 综上研究结果推测MdAHK4, MdAHK5, MdAHK9可能参与调控不定根的生长发育. 本研究对苹果中MdAHKs家族成员进行了系统鉴定并对其调控不定根的关键成员进行了初步筛选, 但具体的功能还需后期深入研究.



 下载:
下载: