-
2016年12月,在全国高校思想政治工作会议上,习近平同志指出“把思政工作贯穿教育教学全过程”,要求高校无论是基础课还是专业课教师,无论是理论课还是实践课教师,结合所授课程的特点,对学生进行全方位的思政教育[1-3]. 聚焦科技前沿,践行生态环境观念,将绿色化学实验设计理念融入到基础化学实验教学,成为东华大学化学课程思政教育改革项目的主要建设目标之一[4-6].
利用热分析方法绘制二元液-固平衡相图是经典的物理化学实验之一,对学生了解固-液相平衡并确定其低共熔点及相应的组成具有重要的指导意义. 然而该实验中经常采用Bi-Sn,Pb-Sn,Bi-Cd二元凝聚金属体系,熔融温度高达300 ℃以上,存在操作温度较高、实验耗时较长以及合金对环境污染严重且成本较高等问题. 近年来,各高校对该实验主要从操作方法与原料选择方面进行了相关绿色化改革,胡善洲[7]指出二元合金相图的实验温度很难控制,操作不便且数据误差大,故采用温度控制仪对该实验温度进行了改进;杨涛[8]采用Zn-Sn体系代替Pb-Sn和Bi-Cd体系,减少了实验室的环境污染,降低了成本,将这一实验改造为绿色实验. 近年来,利用步冷曲线热分析方法等对有机相变材料体系的相变温度、相图和传热性能等进行的研究成为关注热点[9-11]. 同时,利用脂肪酸、脂肪醇等低熔点相变材料替代二元体系组分也成为“二元液-固体系相图绘制”实验的绿色化改进方向[12].
固-液相变材料是指在温度高于相变点时,物相由固相变为液相吸收热量,当温度下降时物相又由液相变为固相放出热量的一类相变材料,在热能储存和控温方面具有广泛的应用,利用相变材料储能是提高能源利用效率和保护环境的重要手段之一,可以解决热能供给与需求失配的矛盾,在能源、航天、农业、建筑、化工和纺织等领域展现出十分广阔和重要的应用前景. 相变材料可分为无机、有机和混合相变材料,有机相变材料主要包括石蜡类、烷烃类、脂肪醇和脂肪酸等,其中,脂肪酸由于具有相对较大的相变潜热、过冷度小、热稳定性好以及无腐蚀性等优点,受到广泛关注[13-15]. 一种脂肪酸的相变温度往往难以与实际需求相匹配,由于脂肪酸具有较好的相混性,通过形成二元或多元的共熔体系,以降低材料的熔点,得到熔化温度范围较宽、性能优越的相变材料,常通过脂肪酸与另一种脂肪酸或脂肪醇的的复合以获得适宜的相变温度[16].
本研究结合东华大学的纺织专业特色,以科研促教学和教学科研相长为理念,选用在蓄热调温功能纺织品中应用较多的低共熔有机相变材料为二元体系的主要组成,在石蜡烷烃、脂肪酸和多元醇等有机物中进行筛选,利用实验室现有设备与装置并进行改装,设计了“基于低共熔有机相变材料的二元液-固体系相图绘制”的教学内容:以有机相变材料组合癸酸-十二醇作为二元液-固体系相图绘制实验的研究对象,利用施罗德公式对不同组成的混合物的理论相变温度进行计算;采用“凝固点降低法测物质摩尔质量”测量不同摩尔组成的混合物冷却过程中相变温度,绘制温度-组成(T-x)相图,从图中获得低共熔点温度和组成的实验值,并与理论值与文献值进行比较;利用红外和差热分析测试方法对低共熔混合物进行简单的结构与性能表征.
全文HTML
-
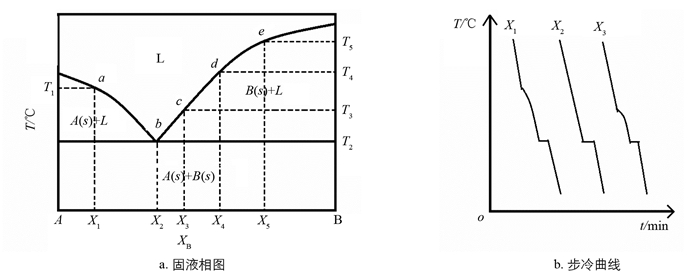
不同的应用领域对相变材料的相变温度有不同的要求. 因此,在应用之前首先必须对相变材料进行具体的选择,蓄热调温纺织品研制所使用的相变物质的相变温度通常在0~50 ℃[17]. 当单一相变材料的相变温度无法达到所需求的温度时,将两种相变材料按照一定的比例进行复合配比,以满足应用领域需求,一般采用低共熔体系理论对复合配比的确定进行指导. 在一定的压力下,二组分系统在固相时完全不互溶的固-液平衡体系,其组成体系的理论熔点见图 1a. 图 1a为二组分系统固-液相图,T2所示温度为低共熔体系的最低共熔点,在一定压力下体系的自由度表达式为
式中,f代表体系自由度,K代表组分数,Φ代表体系的相态数. 对于二元固-液体系,K=2;图 1a中b点存在三相,即液相和两个固相共存,故Φ=3,体系的自由度为f=3-3=0,即温度和组成都已固定. 二组分体系的最低共熔点是否满足应用领域温度是二组分相变材料选择的重要前提[17].
步冷曲线法是一种热分析的方法,是绘制二组分体系固-液相图的常见方法之一,该方法的依据是随着体系温度的降低,固相从液相中析出时,由于放出潜热而使体系温度变化的进程发生转折,故可根据转折位置确定凝固温度. 实施方法为:配制含有B组分的摩尔分数分别为x1,x2,x3,…的样品,升高温度至A和B组分形成完全互溶的液体,然后将其降温,过程中观察或记录温度的变化(可作出各样品的步冷曲线见图 1b),记录发生转折变化的温度得到T1,T2,T3,…,绘制出二组分体系的T-x图. 本研究选取具有较适宜的相变温度和较大的相变潜热的癸酸和十二醇作为研究对象,通过冷却降温方法记录转折温度绘制二者构成相变体系的相图,以达到加深本科生对相图信息的理解、对相律规律的掌握以及对低共熔点温度和组成确定方法的了解的目的.
-
实验试剂:癸酸和十二醇,均为分析纯,从上海国药集团化学试剂有限公司购买.
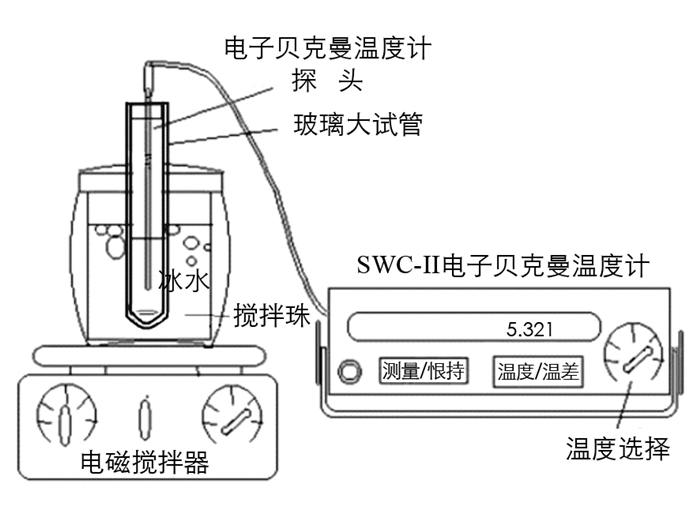
实验仪器:SWC-IIc数字贝克曼温度计(南京桑力电子设备厂)、电子分析天平(AB204N,梅特勒托利多仪器(上海)有限公司)、磁力搅拌计(RH basic,艾卡(广州)仪器设备有限公司)、双层玻璃试管、保温杯.
-
(1) 打开“凝固点降低法测物质摩尔质量”实验装置(图 2)中的数字贝克曼温度计,预热5 min.
(2) 分别称取癸酸摩尔分数x癸酸=0,0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0的癸酸-十二醇混合物于双层玻璃试管中.
(3) 将装有癸酸摩尔分数x癸酸=0.1样品的试管放入热水中融化,待其彻底融化后将其取出,用数字贝克曼温度计测量其温度变化,观察温度下降情况,记录发生变化的第一个转折温度(平台温度或转折温度).
(4) 测量当癸酸摩尔分数x癸酸=0,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,1.0的癸酸-十二醇混合物时,重复(3)、(4)步骤,并记录其第一个转折温度.
-
(1) 红外测试
采用傅利叶红外光谱仪测定样品癸酸、十二醇及癸酸-十二醇(x癸酸=0.49)的FT-IR,采用KBr压片,扫描范围为4 000~400 cm-1.
(2) 差热分析
采用德国耐驰有限公司差示扫描量热仪对样品进行测试,测试样品癸酸、十二醇及癸酸-十二醇(x癸酸=0.49)的熔点及相变潜热. 根据差热分析(DSC)的测试要求,称取1~5 mg的样品到铝制干锅中,采用液氮对样品降温,氮气作为保护气,升降温区间为-20~60 ℃,升降温速率为5 ℃/min.
2.1. 实验仪器与试剂
2.2. 实验步骤
2.3. 表征测试
-
假设由A和B二组分组成二元液-固体系,固液平衡时固相是纯A或纯B,液相中A和B完全互溶,可视为理想溶液(即理想液态混合物). 该二组分体系能达到一个最低的熔点即低共熔点,理论低共熔点温度可由施罗德(Schroder)公式[18-19]确定.
(2) 式和(3)式中,ΔHm,i为纯物质i的相变焓(J/mol),ΔHm为低共熔混合物的相变焓(J/mol), xi为物质i在液相中的摩尔组分,Ti为纯物质i的相变温度(K),Tm为低共熔混合物的相变温度(K),R=8.314 J/(K·mol)为气体常数. 参照文献值,癸酸熔点31.5 ℃,熔化潜热154 J/g,相对分子质量172.27;十二醇熔点23.7 ℃,熔化潜热220.4 J/g,相对分子质量186.38[20].
为了确定最低共熔的温度和组成,常见方法是利用体系中两个组分同时处于三相平衡点时,(2)式对于两个物质(如癸酸与十二醇)均成立,且二者的摩尔分数之和等于1(x癸酸+x十二醇=1),将相关数据代入求解方程中求得,求解过程较为复杂. 本研究先利用施罗德公式得到不同混合比例的二组分体系对应的相变温度,即分别计算出癸酸与十二醇混合体系的理论相变温度,再采用origin软件进行非线性拟合,得到两条曲线拟合方程从而得到交点坐标即为低共熔点的理论温度和组成. 具体过程如下:
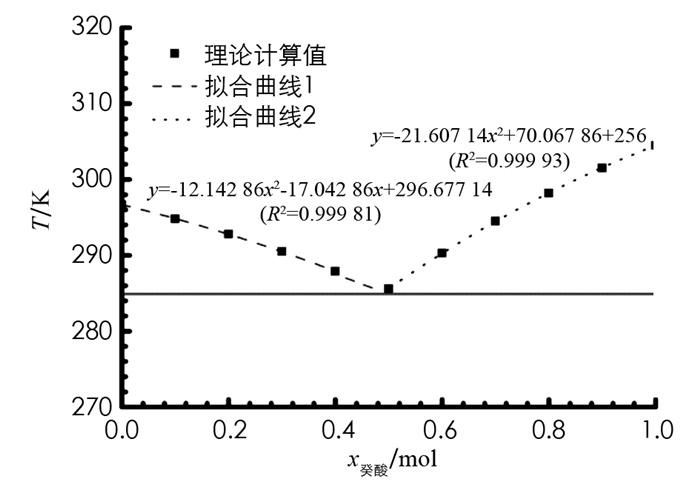
1) 假设癸酸-十二醇体系中癸酸的摩尔分数分别为0.1,0.2,0.3,0.4,0.5,0.6,0.7,0.8,0.9,按照(2)式计算出理论相变温度见表 1,其中0.1~0.4以十二醇为溶质进行计算,0.5~0.9以癸酸为溶质进行.
2) 利用施罗德公式计算癸酸-十二醇二元体系的理论相变温度,绘制理论T-x相图,分别根据x癸酸=0~0.4和x癸酸=0.5~1.0的数据点拟合两条非线性曲线,再根据拟合公式计算两条曲线交点的坐标值(图 3),拟合曲线的相关系数R2均大于0.999,得到最低共熔点温度的理论值t=12.3 ℃和组成为x癸酸=0.493,根据癸酸和十二醇的相对分子量,可确定最低共熔混合物中癸酸与十二醇的质量组成为47.3∶52.7,与文献理论计算值t=11.85 ℃,质量组成为46.2∶53.8较为接近[20]. 主要误差来源除了与人为和仪器误差有关之外,也可能与当时测定的大气压与理论的标准大气压不同相关.
-
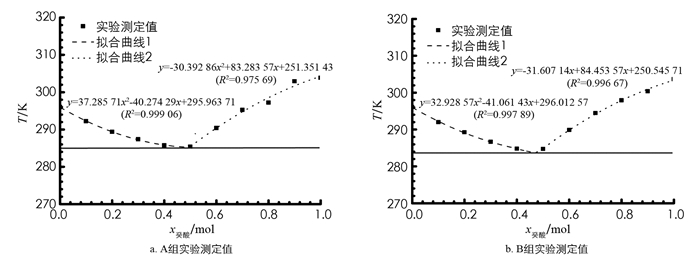
根据测得的不同摩尔分数癸酸-十二醇体系冷却过程中记录的相变温度,绘制的癸酸-十二醇二元体系的T-x相图如图 4所示(A组和B组学生绘制). 从图 3可以看出,随着癸酸摩尔分数的增加,二元混合物中的第一相变点的温度先降低后升高. 通过和3.1中相同的处理方法,根据x癸酸=0~0.4和x癸酸=0.5~1.0的数据点拟合两条非线性曲线,确定癸酸-十二醇二元体系的最低共熔点的温度和组成:A组最低共熔点的温度为12.2 ℃和组成为x癸酸=0.496,癸酸与十二醇的质量组成为47.6∶52.4;B组最低共熔点的温度为10.9 ℃和组成为x癸酸=0.481,癸酸与十二醇的质量组成为46.1∶53.9. 如表 2所示,二组学生的实验数据绘制相图确定的数值均与理论计算得到的数值较为吻合.
-
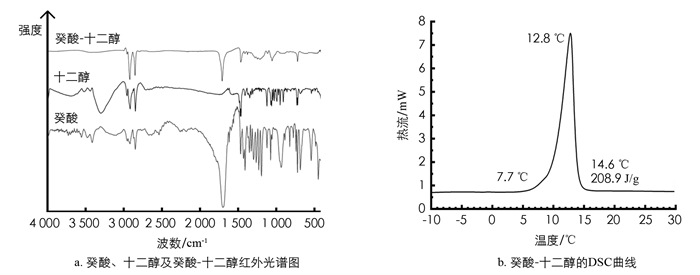
若作为综合实验设计考虑,还可对低共熔混合物进行表征测试,加深学生对该体系化学结构与性质的认识. 图 5a为癸酸、十二醇及癸酸-十二醇混合物(x癸酸=0.49)的红外光谱图,从图 5a中可以看出,癸酸-十二醇低共熔混合物的红外光谱线中出现了癸酸和十二醇的特征吸收峰:波数为2 921,2 854和1 464 cm-1;分别为CH2-反对称伸缩振动、CH2-对称伸缩振动和CH2-弯曲振动;波数为1 709 cm-1的吸收峰表明羧基的存在,另外,在癸酸-十二醇混合物的红外曲线上未发现新的吸收峰,说明在混合体系中癸酸与十二醇之间没有明显的化学键合作用,二者之间主要是分子间作用,没有发生化学变化.
癸酸-十二醇低共熔混合物的DSC曲线见图 5b,其初始相变温度为7.7 ℃,终止相变温度为14.6 ℃,相变温度为12.8 ℃,图中曲线面积即为溶液的相变潜热即相变焓,经计算为208.9 J/g. 与利用式(3)计算的低共熔点理论相变焓180.1 J/g较为接近. 在2~8℃温度段的有机相变材料里,这个潜热值是较高的,在实际应用中可以提供更多的冷量[16].
3.1. 通过理论计算确定低共熔点温度与组成
3.2. 二元体系相图的绘制及低共熔点温度和组分的确定
3.3. 癸酸-十二醇低共熔混合物的表征测试
-
1) 实验设计中利用施罗德公式计算癸酸与十二醇混合体系的理论相变温度,应用Origin软件对数据进行非线性拟合可得到低共熔点温度和组成的理论值,完成理论T-x相图的绘制,有助于加深学生对物理化学中多相平衡相律等相关理论知识的理解与应用.
2) 采用凝固点降低法测物质摩尔质量的实验装置,利用热分析方法测定并记录不同摩尔组成的癸酸-十二醇体系在冷却过程中的第一转折温度,绘制T-x相图并确定低共熔点温度和组成. 该实验仪器简单、操作温度低且单个数据点实验耗时短,二组学生即可合作完成一张相图,人为误差较小,实验值与理论值以及文献值都较接近.
3) 该实验内容设计中选题与学科前沿研究紧密联系,实验原料与方法对实验室环境污染小,有利于培养学生绿色化学理念;利用红外和差热分析方法表征癸酸-十二醇低共熔混合物,有利于拓展学生对于低共熔混合物中无新物质生成、相变潜热值较高和热稳定性好等特点的了解,以及提高对相关分析仪器的操作能力与水平,有助于加强学生科研意识、科研思维与科研方法的培养.



 下载:
下载: