-
弓首蛔虫病主要是弓首科(Toxocaridae)弓首属(Toxocara)犬弓首蛔虫(T. canis)寄生于人体及多种动物引起的一种重要的人兽共患病[1].动物通过摄入其感染性虫卵或幼虫而感染.在终末宿主体内,T. canis感染性幼虫经内脏移行最终在肠道发育为成虫.在人及其他非特异宿主体内,感染性幼虫不能发育为成虫,而是移行到宿主诸多器官,如肝、肺、心、肾、眼睛、脑、肌肉等部位,成为滞育的第3期幼虫.当人体感染后,幼虫在移行期能够逃避宿主的免疫监视,因而不会产生明显的病理变化;而濒死和死亡的虫体则会诱发机体产生明显的病理免疫反应,引起内脏幼虫移行症(visceral larva migrans,VLM)、眼睛幼虫移行症(ocular larvemigrans,OLM)、神经弓首蛔虫病(neurological toxocariasis,NT)和隐性弓首蛔虫病(covert toxocariasis,CT)等,造成严重的病理综合征[2-3].
黏蛋白(mucins,MUC)是一类由黏多糖组成的高分子量糖蛋白,主要存在于上皮组织中,具有PTS结构域,即含有丰富的丝氨酸(serine,P)、苏氨酸(threonine,T)和脯氨酸(proline,S)残基,这些残基都是高度氧糖基化,N端和C端富含天冬酰胺和半胱氨酸.黏蛋白在细胞黏附、分化、免疫应答、肿瘤形成以及细胞信号传导过程中具有多样化的生物学功能[4].黏蛋白可分为分泌型黏蛋白和膜结合黏蛋白,分泌型黏蛋白(如MUC-2,MUC-5AC,MUC-5B)被包装成分泌物进入囊泡参与胞内信号转导;膜结合黏蛋白的羧基末端具有一个跨膜结构域,能将自身连接到质膜(Plasma membrane)(如MUC-1,MUC-3,MUC-4,MUC-16,MUC-17),促进细胞—细胞/蛋白质—蛋白质结合,以及信号转导和蛋白质稳定[5].
在哺乳动物组织中,黏蛋白为上皮表面提供黏性和物理保护,并携带大量对细胞运输和黏附起作用的聚糖[6].黏蛋白1(MUC-1)是黏蛋白家族的重要成员,起着识别细胞、保护细胞以及维持黏性等作用[7]. Tc-MUC-1是犬弓首蛔虫感染性幼虫分泌的一系列糖蛋白中的一种,参与机体免疫,对宿主免疫逃避发挥重要作用[8].目前,国内外对Tc-MUC-1研究较少,本研究拟对犬弓首蛔虫黏蛋白1全长基因(Tc-muc-1)进行克隆及序列分析,以期为Tc-MUC-1的功能研究奠定基础.
全文HTML
-
T.canis采自西南大学荣昌校区动物医院患病犬,经形态学鉴定后,保存于液氮罐中.
Taq DNA聚合酶、pMD19-T(simple)Vector、PrimeScriptTM反转录试剂盒购自TaKaRa公司;EasyPure©胶回收试剂盒、DH5α购自TransGen Biotech公司;Trizol试剂购自Ambion公司.
-
根据T.canis基因组数据(GenBank:U39815),用PrimerPremier(Version5.0)软件设计引物,引物序列信息为上游引物:5'-ATGCACGTCCTTACCGT-3';下游引物:5'-TTAACAGAAGCCGCACGT-3'.引物序列由重庆擎科兴业生物技术有限公司合成.
-
将成熟的T.canis雌虫卵巢解剖,收集虫卵,在37 ℃培养箱中培养3~4周,采用Trizol试剂提取培养好的2期幼虫的总RNA[9-10].采用核酸蛋白检测仪检测总RNA的浓度和纯度.以提取的T. canis幼虫总RNA为模板,按反转录试剂盒说明合成cDNA.
-
以合成的T. canis幼虫cDNA为模板进行PCR扩增.扩增体系为25 μL:10×PCR buffer(不含Mg2+)2.0 μL、Mg2+(25 mmol/L)2.5 μL、dNTPs(2.5 mmol/L)2.0 μL、上游引物(10 μmol/L)0.5 μL、下游引物(10 μmol/L)0.5 μL、cDNA 1.0 μL、rTaq酶0.5 μL、dd H2O 16.0 μL,以鸡异刺线虫cDNA为模板设置阴性对照. PCR反应条件为94 ℃预变性3 min,94 ℃变性30 s,55 ℃复性30 s,72 ℃延伸1 min,35个循环;最后72 ℃延伸5 min.扩增产物经1%琼脂糖凝胶电泳检测,并按DNA胶回收试剂盒说明,回收目的PCR产物.
-
将回收的目的PCR产物与pMD19-T(simple)Vector载体连接,将上述连接产物转化至DH5α感受态细胞,涂布于含Amp+(100 mg/mL),X-Gal(20 mg/mL)和IPTG(24 mg/mL)的LB琼脂平板中,置恒温箱37 ℃培养12~14 h.
-
将经菌液PCR鉴定为阳性的重组菌液送重庆擎科兴业生物技术有限公司测序.将测得的序列利用DNAStar 5.0等软件,分别从核酸和氨基酸水平对该基因进行生物学分析.利用SMART和InterProScan(http://smart.embl-heidelberg.de/)预测功能结构域.应用MUSCLE,Clustal Omega和MAFFT软件进行多重序列比对,用MEGA 5.0软件中的邻接法(Neighbour-joining,NJ法)构建系统进化树,进化树的可靠性用Bootstrap进行分析,共1 000个重复.
1.1. 材料
1.2. 方法
1.2.1. 引物的设计与合成
1.2.2. 总RNA的提取与反转录
1.2.3. Tc-MUC-1基因的PCR扩增
1.2.4. Tc-MUC-1基因的克隆
1.2.5. 测序及序列分析
-
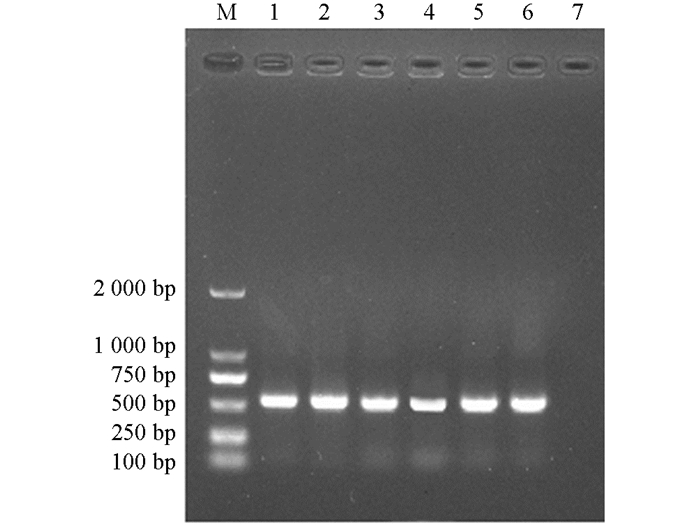
扩增产物经1%琼脂糖凝胶电泳检测,Tc-MUC-1在约530 bp处可见相应条带,与理论大小相符;阴性对照没有条带出现(图 1).
-
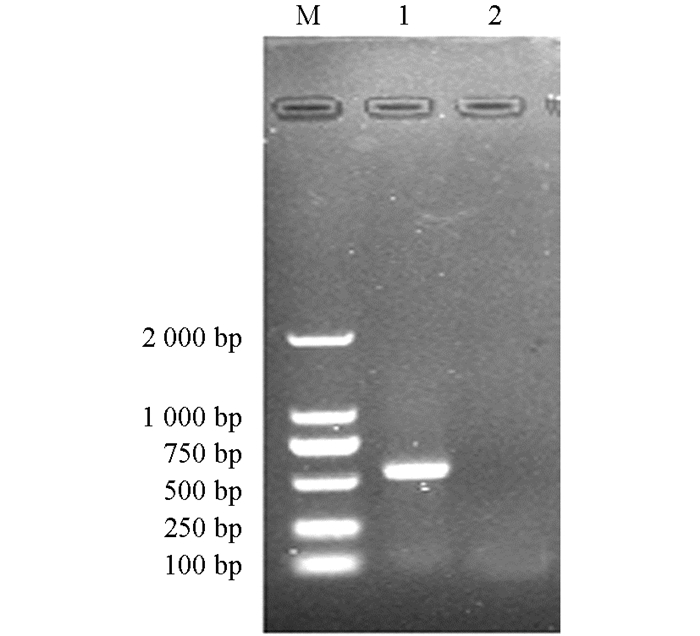
阳性克隆的重组菌液经PCR扩增后进行1%琼脂糖凝胶电泳检测.结果显示Tc-MUC-1在约530 bp处有特异目的条带,阴性对照没有条带出现(图 2).
-
将经过菌液PCR鉴定为阳性的重组菌液送至重庆擎科兴业生物技术有限公司进行序列测定,结果显示Tc-MUC-1基因的完整编码区序列为531 bp,编码176个氨基酸,命名为Tc-MUC-1蛋白.利用SMART对Tc-MUC-1蛋白的功能结构域进行分析发现,1-16位为信号肽,22-105位有低复杂度的黏蛋白结构域,106-141位,142-176位为2个重复的ShKT结构域(图 3). GO注释显示Tc-MUC-1具有Binding(结合)(GO:0005488),Protein binding(蛋白质结合)(GO:0005515)和Metal ion binding(金属离子结合)(GO:0046872)功能.
-
从GenBank中检索到Tc-MUC-1氨基酸序列(GenBank No. AAB05820),Tc-MUC-2(GenBank No. AAD49339),Tc-MUC-3(No. AAD49340),Tc-MUC-4(GenBank No. AAD49341),Tc-MUC-5(GenBank No. AAD49342),并进行多重序列比对.结果发现5个黏蛋白都是由2个不同模块构成,其中一个是黏蛋白样富含Ser/Thr的黏蛋白结构域,可以充当O-糖基化的位点,另一个是36个氨基酸组成的ShKT结构域.所有蛋白质都含有C末端配对的ShKT基序,而Tc-MUC-3和Tc-MUC-5在N末端同样含有ShKT基序(图 4).
将Tc-MUC-1氨基酸序列与WormBaseParaSite[11]和GeneBank收录的双胃线虫(Pristionchuspacificus,GenBank No. PDM76930)、美丽筒线虫(Gongylonemapulchrum,GenBank No. VDN19323)、雷曼尼线虫(Caenorhabditis remanei,GenBank No. XP003113635)、布里格塞氏线虫(Caenorhabditis briggsae,GenBank No.CAP37768)、类圆线虫(Strongyloidesratti,GenBank No. XP024499385)、犬钩虫(Ancylostoma caninum,GenBank No. RCN39081)、秀丽隐杆线虫(Caenorhabditis elegans,GenBank No. NP491509)、绵羊(Ovisaries,GenBank No.NP001009224)、褐家鼠(Rattus norvegicus,GenBank No. NP036734)、南方根结线虫(Meloidogyne incognita,GenBank No. AVP26554)、智人(Homo sapiens,GenBank No. AAD10856)、家鼠(Mus musculus,GenBank No.NP038633)、新丝球菌(Neofusicoccum parvum,GenBank No. EOD43899)、丝状褐藻(Ectocarpussiliculosus,GenBank No. CBJ31544)、金丝熊(Mesocricetus auratus,GenBank No. NP001268584)进行多重序列比对并构建进化树.结果显示Tc-MUC-1与双胃线虫(Pristionchuspacificus,GenBank No. PDM76930)、秀丽隐杆线虫(Caenorhabditis elegans,GenBank No. NP491509)形成一个单独的分支,其进化关系较近(图 5).
2.1. PCR扩增结果
2.2. 重组质粒的菌液PCR鉴定
2.3. 测序结果及分析
2.4. 多重序列比对及种系发育进化树分析
-
黏蛋白(MUC)是高分子量的O-糖蛋白,主要表达于上皮细胞的顶端表面[12].该蛋白在人乳中首次鉴定出来,几乎分布于所有呼吸腺体的上皮细胞表面、女性生殖道、胃肠道、中耳、唾液腺、乳腺、正常的胰脏内小叶导管等[4]. MUC具有保护和润滑上皮细胞、维持上皮细胞特征、细胞黏附、分化和免疫的基本功能[12-14].在肿瘤发生和其他病理状态下,MUC的表达发生显著变化[15-16],并可作为肿瘤诊断及(或)预后标志物.
本研究发现Tc-MUC-1结构包含黏蛋白结构域(Mucin domain)和ShKT结构域(ShKT domain)两部分.该蛋白序列富含丝氨酸残基,编码176个氨基酸且具有信号肽,但无跨膜结构域.多重序列比对显示Tc-MUC-1,Tc-MUC-2,Tc-MUC-3,Tc-MUC-4,Tc-MUC-5黏蛋白结构域的重复区域中Ser/Thr存在一定差异,即Tc-MUC-1富含Ser,而其余的黏蛋白具有不同的重复单位Thr,Gly,Pro和Ala,均具有Thr的优势.富含半胱氨酸的ShKT结构域具有高度的保守性,Tc-MUC-1,Tc-MUC-2,Tc-MUC-4的ShKT结构域由86%~97%相同的氨基酸残基构成. Loukas等[6]发现富含半胱氨酸残基的ShKT结构域能促进黏蛋白三级结构的聚合和形成,表明该结构域在决定黏蛋白的功能中起重要作用.
MUC-1是一种膜结合蛋白,主要存在于上皮组织,是上皮组织黏液屏障的重要成分[17],已证明在人类多种器官(乳腺、肺、结肠、胃、前列腺)的恶性肿瘤中异常表达[18-22],参与多种恶性肿瘤类型的转移和侵袭. Gillh等[23]发现秀丽隐杆线虫黏蛋白LET-653在排泄管和孔细胞的发育中起作用,并维持单细胞管型的完整性;Noya等[24]发现肝片吸虫有一种黏蛋白样多肽,它与脂多糖协同促进树突状细胞成熟,并增强树突状细胞Th1极化能力,参与免疫调节作用. Leon-Coria等[25]发现宿主胃肠道分泌的MUC-2在单层上皮细胞和腔内容物之间形成屏障,在先天防御溶组织内阿米巴(Entamoeba histolytica,Eh)和促炎反应中起重要作用.而Tc-MUC-1是否参与宿主细胞黏附、免疫识别及逃避、机体屏障等生物学过程,有待后续试验进一步研究.



 下载:
下载: