-
开放科学(资源服务)标识码(OSID):

-
鲟隶属于硬骨鱼纲(Osteichthyes)、鲟形目(Acipenseriformes)、鲟科(Acipenseridae)、鲟属(Acipenser),距今已有2亿年的历史,有“水中活化石”的称号[1-2]. 鲟鱼味道鲜美,肉质可口,骨可成胶,具有多种人体必需的氨基酸,同时具有极高的食用价值,而雌鱼卵所生产的鱼子酱更是富含多种微量元素、氨基酸和蛋白质,是被誉为“黑色黄金”的高档食品,也是“世界三大珍馐”之一[2-3]. 除食用价值外,鲟还具有药用和观赏价值,加之其对环境因素的高要求,使其成为了特色名优经济鱼类,深受广大消费者的青睐. 2021年我国鲟养殖产量为121 875 t,较上一年增长16.87%[4],养殖产量占世界产量的85%以上,在世界鲟养殖国家中,我国已位列第一[2],且产量呈现逐年上升的趋势. 我国鲟养殖种类目前已有10余种. 大力发展鲟绿色养殖,可助力水产养殖模式创新以及推动生产技术的提升,引领和助推乡村振兴,促进一、二、三产业的深度融合,实现鲟产业的可持续发展. 近年来,由于鲟养殖产业设施化、规模化和集约化程度的不断提高,致使鲟养殖过程中病害频发,尤其以细菌性疾病的暴发最为突出,不仅造成巨大的经济损失,还严重阻碍了鲟产业的绿色健康可持续发展[5]. 目前已报道的鲟主要致病菌有气单胞菌属的致病菌[6-8],以及其他种属的致病菌[9-12]. 在致病菌的鉴定中,以具有高度保守性的16S rRNA,gyrB基因序列为模板的分子生物学鉴定方法因具有灵敏性高、准确性强等特点而被广泛运用,结合rpoB,cpn60这两种具有更强分辨力的管家基因进行鉴定,可有效避免扩增出现异质性,弥补同属近缘种间分辨不足的缺陷[13].
2022年7月,重庆市彭水县某大型养殖场出现养殖杂交鲟发病现象,其主要行为及体表特征表现为游动缓慢,摄食量下降,嘴部、下颌、胸鳍、腹鳍及泄殖孔附近有明显的出血点或血斑,剖检可见淡红色血水充满腹腔、鱼体壁肌肉充血、肠道可见明显红肿,发病时水温20.5 ℃,发病率高达45%,死亡率约为15%. 为探究造成养殖鲟发病死亡的病因,本研究从患病杂交鲟的肝脏中分离得到优势菌株并命名为PSHS,其致病性通过人工回归感染实验进行验证,同时根据形态学特征、生理生化特性及16S rRNA,gyrB,rpoB,cpn60基因序列同源性分析结果进行综合鉴定,之后进行药敏实验、毒力基因分析及组织病理学研究,旨在为该致病菌引起的杂交鲟疾病的准确诊断提供参考依据,也为有效防治该疾病提供科学指导和数据支撑.
全文HTML
-
具有典型患病症状的杂交鲟取自重庆彭水某鲟养殖场,养殖水温20.0~21.0 ℃,pH值为7.6~8.2,溶氧为6.1~8.2 mg/L,病鱼体质量为187.22±5.78 g. 人工回归感染实验所需健康杂交鲟从四川成都某养殖场购买所得,体质量为116.56±2.16 g,于西南大学实训基地的室内可控温养殖池进行暂养,1周后进行实验,暂养期间水温为21.0±1.0 ℃,pH值为6.8~8.7,溶氧为7.3~9.1 mg/L,每天换水1/3,暂养期间正常投饵.
-
试剂:细菌DNA提取试剂盒,北京天根;细菌微量生化反应管、药敏纸片,杭州微生物试剂;2×FineTaqTM PCR SuperMix,EasyPureⓇ Quick Gel Extraction Kit试剂盒,北京全氏金;细菌革兰氏染色试剂盒,北京索莱宝;HE染色试剂盒,上海碧云天;pMD19-T,DH5α,北京宝日医生物等.
仪器:电泳仪,北京六一仪器厂;PCR仪、凝胶成像系统,美国Bio-Rad;离心机(5810R)、移液枪,德国Eppendorf;核酸定量仪NanoDrop One,美国Thermo scientific;自动包埋机、组织切片机、光学显微镜,德国Leica等.
-
取具有典型症状的濒死病鱼,对病鱼体表用酒精喷洒后观察. 对鳃、皮肤黏液、肝脏、肾脏和脾脏的样本进行标准化的病毒学和寄生虫学分析. 取鳃、皮肤黏液制作水封片用普通光学显微镜检测寄生虫. 取肝、脾、肾加入组织质量5倍的PBS缓冲液匀浆,用0.22 μm滤膜过滤,进行病毒检测. 在超净工作台中用手术剪剖开鱼腹部,观察患病鱼的实质器官,用灼烧冷却后的接种环从肝脏、脾脏、肾脏通过划线法接种于BHI培养基上,病原菌培养条件为28 ℃,24 h,根据菌落特征的不同,挑取优势菌株重复3次划线培养,从患病杂交鲟肝脏中分离纯化获得1株优势菌株,编号为PSHS. 观察纯化后单菌落形态特征,按照甘油冷冻法的步骤于-80 ℃超低温冰箱中保存备用.
-
分离菌株革兰氏染色:参照试剂盒规定的方法,在无菌条件下染色,光学显微镜下进行形态学观察.
分离菌株生理生化鉴定:参照细菌生化微量鉴定管说明书和《水产养殖动物病原细菌学》[14]《伯杰氏细菌鉴定手册》[15]对病原菌进行生理生化特性鉴定.
-
16S rRNA,gyrB,rpoB和cpn60基因扩增和测序PCR反应的DNA模板来源于通过试剂盒提取方法获得的总DNA,采用50 μL反应体系[13, 16],即模板1 μL,2×FineTaqTM PCR SuperMix 25 μL,引物1 μL(表 1),ddH2O补足余量. PCR反应程序:94 ℃ 5 min,94 ℃ 30 s,退火温度(表 1)30 s,72 ℃ 1 min,32个循环,72 ℃ 10 min,4 ℃保存. 扩增产物经电泳检测后,根据胶回收试剂盒说明书回收、纯化目的片段,4 ℃条件下与pMD19-T载体过夜连接后转化进DH5α中,在平板上涂布培养后,无菌条件下挑选阳性克隆用液体培养基扩大培养后,送至华大基因进行测序. 测序结果在NCBI上进行Blast比对分析,从比对结果中选取排序靠前的菌株序列,通过ClustalW 2.1和MEGA10.0使用邻接法,Boostrapping检测设置为1 000次,构建系统发育树.
-
按照文献选取并合成鲁氏耶尔森菌yhlA[17],yrp1 [18],yrpA[19],OmpF[20-21],ampC[22]5种毒力基因引物(表 1),反应体系和反应条件同1.5.
-
为验证1.3中分离到的细菌为此次杂交鲟发病的病原菌,在无菌BHI液体培养基中接种PSHS,28 ℃恒温震荡培养24 h,参照麦氏比浊法调整菌悬液浓度分别为1.0×109,1.0×108,1.0×107,1.0×106,1.0×105,1.0×104 CFU/mL. 取暂养结束的健康杂交鲟112尾,体质量为116.56±2.16 g,分为6个实验组和1个对照组,每组16尾,继续饲养于流水养殖池中(养殖池规格为1.2 m×1.0 m×0.8 m,水深0.6 m),实验期间水温保持在21.0±1.0 ℃,各水箱每天换水1/3,利用增氧机保证溶氧充足. 采用腹腔注射进行人工感染,实验组每尾注射0.2 mL的菌液,对照组注射等量的生理盐水. 注射后以8 h/次的频率观察记录鲟病变情况和病死数量,根据改良寇氏法计算本次人工回归感染实验的半数致死量(LD50)[8]. 及时挑取濒死鲟进行剖检,观察病理变化,同时按上述步骤对病原菌再次进行分离、纯化及鉴定. 另取一组健康杂交鲟,将1.3中组织匀浆的滤液通过腹腔注射感染进行病毒学检测.
-
参照文献[23-24]的方法运用K-B纸片扩散法检测细菌的耐药性. 挑取纯化单菌落进行扩大培养,恒温摇床培养条件28 ℃,180 r/min,用分光光度法调整菌液浓度约为1.5×108 CFU/mL,取100 μL菌悬液均匀涂布于平板上(d=9.0 cm),用无菌镊子夹取药敏纸片等距放置于平板上,每个平板贴2片,1片不含药物纸片为空白对照. 培养条件同1.3中所述,培养结束后用数显游标卡尺逐一测量,记录抑菌圈直径,再根据美国临床实验室标准化研究所(CLSI)抗菌药物敏感性实验执行标准(CLSI-M100-S19)判断菌株对各药物的敏感程度.
-
参照文献[25-26]的方法,采用常规组织石蜡切片和常规HE染色技术,取濒死杂交鲟包括肝脏、脾脏、肾脏、中肠、鳃在内的病变组织,用现配的波恩氏液固定样本组织24 h后,按照步骤进行脱水、透明,置于自动包埋机中进行浸蜡、包埋. 待冷却24 h后用旋转式切片机切片,厚度为5 μm,经展片、脱蜡、复水、苏木精染色、水洗、脱水、伊红复染、脱水、透明后,用中性树脂封片,在37 ℃条件下烘片48 h后在Leica显微镜下拍照、观察.
1.1. 材料
1.2. 主要试剂及仪器
1.3. 病原菌的分离与纯化
1.4. 病原菌的鉴定
1.5. 病原菌
1.6. 病原菌的毒力基因检测
1.7. 人工感染实验及半数致死量(LD50)确定
1.8. 药物敏感实验
1.9. 组织病理观察
-
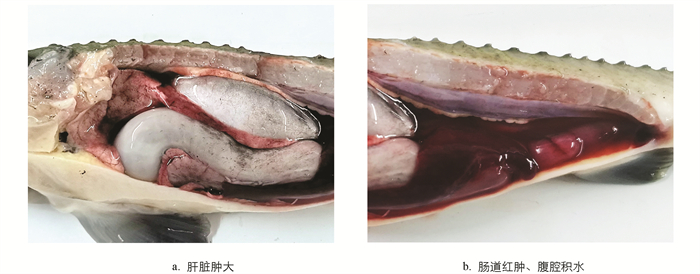
患病杂交鲟表现为游动迟缓、摄食量下降,长时间停留在水面,或腹部向上,泄殖孔红肿外突,患病严重的在腹部或头部可见出血点或血斑. 剖检可见腹腔血水充盈,体壁及肌肉有出血点;肝脏颜色变浅、略有肿大,有出血点或出血斑(图 1a);脾脏轻微肿大,呈紫黑色;肠道明显充血、红肿(图 1b).
-
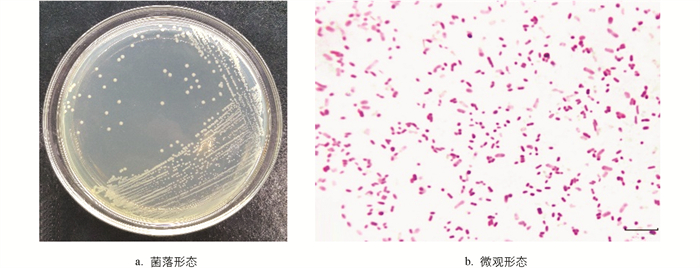
菌株PSHS在BHI平板上培养后,形成肉眼可见的直径为0.8~1.6 mm、颜色为乳白色、表面光滑湿润、微隆起、边缘整齐的单菌落(图 2a). 经革兰氏染色后镜检发现该菌株为革兰氏阴性短杆菌,直径约为0.75 μm,长度约为1.7~2.5 μm,两端钝圆、单个或成对存在(图 2b).
-
生理生化鉴定结果显示(表 2),菌株PSHS能发酵果糖、蔗糖、麦芽糖、海藻糖、蜜二糖,不能发酵乳糖等7种糖;具有鸟氨酸脱羧酶和赖氨酸脱羧酶活性,不具有氧化酶、苯丙氨酸脱羧酶、精氨酸双水解酶活性;能够利用枸橼酸盐、D-甘露醇,不能利用水杨苷、D-山梨醇、肌醇;明胶实验为阳性,吲哚实验等5项为阴性. 对结果进行分析,结合文献[17-18]的标准判断细菌种类,此结果与参考菌株的生理生化实验结果基本一致,初步判定菌株PSHS为鲁氏耶尔森菌(Yersinia ruckeri).
-
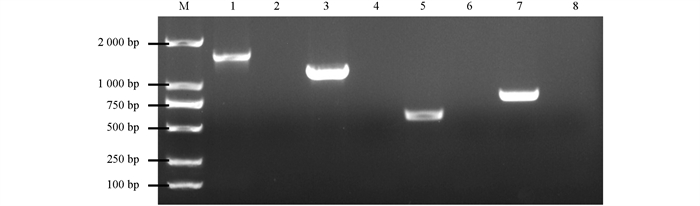
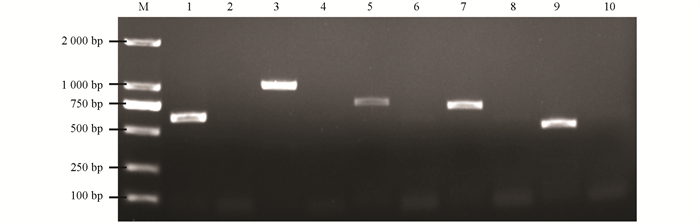
16S rRNA,gyrB,rpoB,cpn60基因序列进行PCR反应,经凝胶电泳可见大小约为1 500 bp,1 000 bp,500 bp,750 bp的片段,以蒸馏水为模板的空白对照未扩增出相应大小的条带(图 3),与预期结果相符. 阳性克隆产物测序结果表明,菌株PSHS的16S rRNA,gyrB,rpoB,cpn60的片段大小依次为1 413 bp,1 084 bp,540 bp,743 bp,与GenBank登录号为MK290740,CP009539,NC011078,CP071802的鲁氏耶尔森菌的对应序列相似性分别高达99.59%,99.78%,99.69%,99.89%.
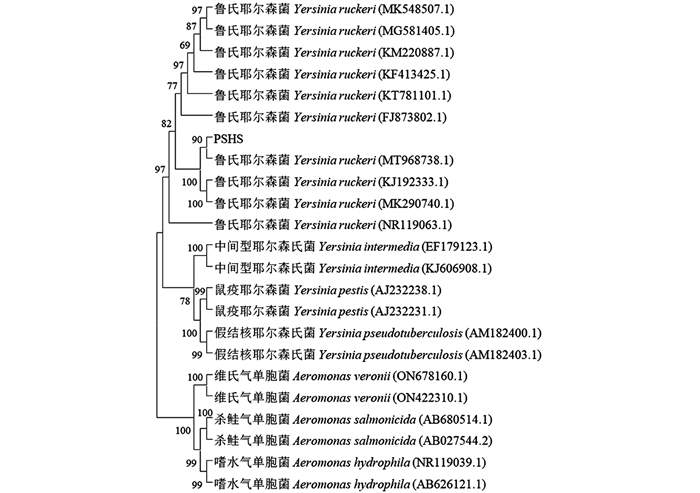
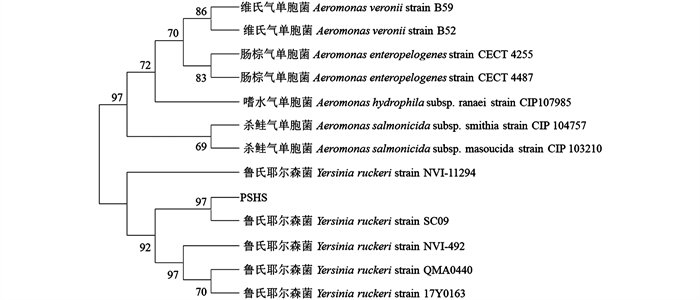
由菌株PSHS基于16S rRNA序列构建的系统发育树(图 4),以及基于gyrB,rpoB,cpn60这3种基因序列构建的联合系统发育树(图 5)可知,本实验分离菌株PSHS与鲁氏耶尔森菌聚为一类,即归属在同一分支里,实验结果综合判定分离菌株为鲁氏耶尔森菌(Y.ruckeri).
-
回归感染实验结果表明,注射组织匀浆滤液的杂交鲟无明显异常,再次解剖未分离到病原菌. 健康杂交鲟注射分离菌株后,表现出反应迟钝、摄食量减少、游动缓慢等症状,临床表现和主要病理变化与自然发病所产生的情况基本相同. 将濒死病鱼及时捞出检查,可见下颌、胸鳍及腹部有明显的出血,泄殖孔红肿外突. 剖检发现腹腔充满淡红色血水,肝脏颜色变淡,有出血点或血斑,脾脏略微变得肿大,肠道充血、红肿,但肌肉未见出血或充血. 从人工回归感染发病的濒死鱼体内再次重复上述分离鉴定步骤后,获得与分离株PSHS形态、生理生化特性及16S rRNA,gyrB,rpoB,cpn60基因序列一致的病原菌,表明鲁氏耶尔森菌PSHS菌株是造成此次养殖鲟患病的致病菌. 根据改良寇氏法计算得到菌株PSHS对杂交鲟的LD50为1.8×106 CFU/mL(表 3).
-
通过PCR扩增和1%琼脂糖凝胶电泳检测可见大小约为600 bp,1 000 bp,800 bp,700 bp,500 bp的片段,目的片段经胶回收纯化、4 ℃过夜连接和转化进入DH5α细胞中,进行挑单克隆操作,选取阳性扩大培养后送至公司测序. 测序结果在NCBI中经Blast比对可知,该菌株携带有yhlA(623 bp),yrp1 (1 034 bp),yrpA(805 bp),OmpF(717 bp),ampC(553 bp)5种毒力基因(图 6).
-
根据K-B纸片扩散法检测菌株PSHS对32种抗生素药物纸片的耐药性实验,结果表明:菌株PSHS对氟苯尼考、左氧氟沙星、新霉素等6种药物表现出高度敏感;对恩诺沙星、米诺环素、磺胺甲基异恶唑等5种药物表现出中度敏感;对阿莫西林、四环素、杆菌肽等21种抗生素表现出耐药(表 4).
-
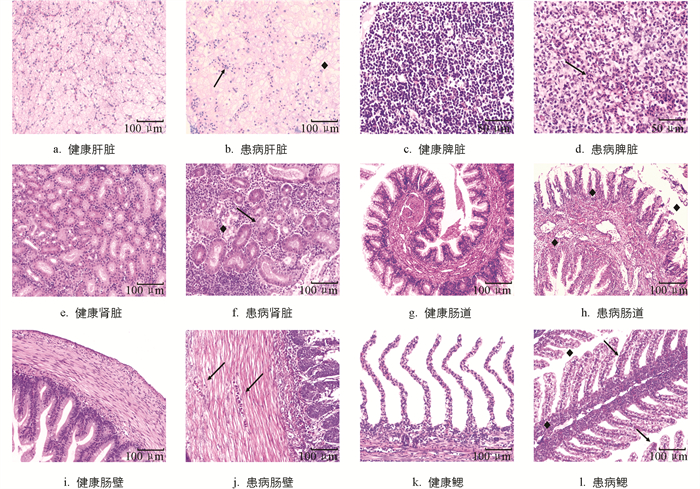
病理组织观察结果表明:感染后杂交鲟的肝脏、脾脏、肾脏、中肠、鳃与健康组织对比可观察到不同程度的病理变化. 健康杂交鲟肝细胞核明显、轮廓清晰、肝索排列整齐、肝血窦正常(图 7a);患病杂交鲟大量肝细胞排列紊乱、呈空泡化变性、细胞核溶解或碎裂,内含大小不一的空泡,肝血窦、主静脉肿胀充血、伴有炎性细胞浸润,肝细胞之间界限不清、轮廓结构模糊(图 7b). 与健康杂交鲟脾脏相比(图 7c),患病杂交鲟脾脏网状内皮细胞增生、淋巴细胞坏死、免疫细胞浸润,脾髓窦浸润大量红细胞、出现淤血或出血(图 7d). 健康杂交鲟肾脏组织结构完整(图 7e),而患病杂交鲟肾小球毛细血管肿胀、充血,包括中性粒细胞、巨噬细胞等在内的炎性细胞浸润组织,肾小管发生颗粒变性或者坏死,部分肾小球萎缩变小、细胞核裂解,造血组织坏死(图 7f). 与健康杂交鲟肠道相比(图 7g,7i),患病杂交鲟肠绒毛上皮坏死脱落、纹状缘结构破坏,肠壁和肠绒毛有红细胞浸润(图 7h,7j). 健康杂交鲟鳃丝细胞形态结构正常(图 7k),而患病杂交鲟鳃丝上皮细胞大量增生或充血、末端肿大,鳃小片发生充血、坏死或脱落,增生处有淋巴细胞浸润(图 7l).
2.1. 患病杂交鲟症状
2.2. 病原菌形态特征及革兰氏染色
2.3. 生理生化鉴定
2.4. PCR反应扩增及系统发育树对菌株PSHS的4个保守序列,即
2.5. 回归感染实验及LD50值的确定
2.6. 细菌的毒力基因
2.7. 药敏结果
2.8. 病理组织切片
-
本研究从发病濒死杂交鲟肝脏中分离得到1株PSHS优势菌株,经革兰氏染色镜检为阴性,生理生化反应鉴定结果与鲁氏耶尔森菌极为相似,但蜜二糖和蔗糖2个指标与标准菌株略有不同,这与杨昆明等[27]获得的分离株理化特性不同,其原因可能是地区不同所引起的环境因素不同而导致菌株在为了生存的过程中产生了微小的理化特性差异,因此仅将其初步鉴定为鲁氏耶尔森菌. 目前,表型和分子遗传学是最主要的两大类细菌鉴定方法[28],而表型鉴定中的生理生化特性鉴定通常会由于生化反应过度、反应不完全、结果判断差异等因素对结果的准确性产生影响. 在此基础上,分子遗传学鉴定法具有灵敏性高、准确性强等特点,通过对16S rRNA等高度保守基因序列的扩增测序,结果进行Blast比对后可快速进行鉴定. 有“分子化石”之称的16S rRNA基因因其在漫长的进化过程中具有高度保守性可用于区别不同种属,而gyrB,rpoB和cpn60管家基因可弥补同属近缘种间分辨不足的缺陷[29]. 为进一步确定PSHS的分类地位,本研究选用上述4种基因同时进行鉴定. 经人工回归感染后,泄殖孔红肿外突,剖解发现内脏有不同程度的损伤,同时从肝脏、肾脏分离得到与PSHS形态特征、理化特性、分子生物学鉴定一致的菌株,结合本实验所有结果,综合判定PSHS为鲁氏耶尔森菌.
鲁氏耶尔森菌(Yersinia ruckeri)是肠杆菌科的一种兼性厌氧革兰氏阴性菌,鲑鳟鱼类常见疾病肠炎红嘴病的病原菌即是该菌[14]. 自20世纪50年代在美国人工养殖的虹鳟中首次发现该菌以来[30],已在世界范围内大量传播,对斑点叉尾鮰(Ictaluruspunctatus)[31]、虹鳟(Oncorhynchusmykiss)[32]、鲢(Hypophthalmichthysmolitrix)、鳙(Aristhichthysnobilis)[33]等易感品种具有广泛的致病性. 不同鱼类感染鲁氏耶尔森菌后会表现出下颌出血、泄殖腔充血外突、内脏出血或充血等与虹鳟相似的症状[34]. 研究表明,在感染患病杂交鲟中也存在类似表征,这可能与鲑鳟鱼类在生活习性上相似有关. 不同水域、不同物种及环境条件会导致该菌的致病性有一定差异,影响致病力强弱的因素还包括温度、盐度等环境因素,所表现出的症状也略有不同.
目前鲁氏耶尔森菌的现有研究多集中在生物被膜、不同血清型及环境因素对菌体毒力的影响方面[34],对毒力相关基因、调控途径、致病机制的认识还比较缺乏,仍需进行大量的研究. 前人研究表明,胞外产物如蛋白酶、脂肪酶和外毒素等参与了致病过程,如yhlA基因主要编码溶血素,而yhlB则参与溶血素的分泌与激活[35]. 鲁氏耶尔森菌的毒力更是与蛋白酶yrp1的活性密切相关[18],yrpA可能在肠道组织中表达,其缺失突变体毒力明显减弱[19],OmpF在营养获取、生存、相互作用中发挥重要作用[21],ampC编码的头孢菌素酶,对许多种抗生素均耐受[22]. 此外,在对胭脂鱼的人工感染研究中发现,维氏气单胞菌携带的毒力因子是其感染该鱼后所表现的诸多病理现象出现的原因[26]. 本研究通过PCR技术对yhlA,yrp1,yrpA,OmpF,ampC进行扩增,证明了PSHS携带上述5种毒力基因. 结合人工感染实验,依据病理组织切片结果发现,该菌株具有较强的致病性,造成杂交鲟肝、脾、肾、肠、鳃产生不同程度的病变,其中以肝细胞变性空泡化和肝血窦充血扩张、肾小球萎缩且炎性细胞浸润、肠绒毛坏死脱落及肌肉层充血表现最为明显,以上研究为从分子方面探究鲁氏耶尔森菌的致病机制提供了科学依据. 此外,已有研究表明鲁氏耶尔森菌的主要毒力基因还包括invF,traC,traL,traN等[17],本研究虽未进行检测,但结合已有研究[36-37],含有不同组合的毒力基因的致病株亦能引起发病,在养殖过程中需要引起高度重视,从改善养殖环境、投喂优质饲料、增加巡检频率方面加强对该病的防控.
药敏实验结果表明,本实验分离得到的鲁氏耶尔森菌PSHS菌株对氟苯尼考、左氧氟沙星、新霉素、哌拉西林等6种药物表现出高度敏感,可为该病的早期预防和及时治疗提供数据参考和科学依据. 在防治方面应在执业兽医的专业指导下,结合具体养殖场的药物敏感实验结果优先使用国家规定允许的敏感药物,防止因不科学用药造成病原菌耐药或药物残留. 此次实验结果与杨昆明等[27]、方苹等[33]、陶莎等[38]在杂交鲟、鲢鳙、斑点叉尾鮰体内分离到的鲁氏耶尔森菌的药敏实验结果有所差异,其原因可能是为了防治疾病而不规范、不科学的用药导致菌株产生了多重耐药性[39]. 值得注意的是,王荻[32]对减毒活疫苗的研究、阳磊等[40]对口服微球疫苗的研究以及冯淇元等[41]对中草药添加剂的研究为鲁氏耶尔森菌的防治提供了新思路. 下一步可以依靠基因组学、蛋白质组学、转录组学,通过对毒力基因、耐药基因、生物型、血清型以及耐药性的研究,为有效防治养殖过程中鲟鲁氏耶尔森菌病提供基础和依据.
-
本实验从患病杂交鲟肝脏中分离获得致病性鲁氏耶尔森菌1株,其对杂交鲟半数致死量为1.8×106 CFU/mL. 感染该菌能导致杂交鲟肝、脾、肾、肠、鳃产生不同程度的病变,其中以肝细胞变性空泡化和肝血窦充血扩张、肾小球萎缩且炎性细胞浸润、肠绒毛坏死脱落及肌肉层充血表现最为明显. 该菌株携带有yhlA,yrp1,yrpA,OmpF以及ampC5种毒力基因,对氟苯尼考、左氧氟沙星、新霉素等6种药物表现出高度敏感. 本研究报道了杂交鲟鲁氏耶尔森菌的致病性,可为养殖生产中有效治疗由此菌引起的疾病及安全用药提供新的参考依据.



 下载:
下载: