-
随着重金属污染物在水域生态系统中的富集现象越来越严重,水生生物及生化指标作为检测重金属对水体污染程度的研究成为近年来水域生态学和国际环境科学研究领域的热点问题之一[1].锌(Zinc,Zn)为生理所必需的微量元素,是机体酶的辅基和维生素等重要的组成成分,适度的摄入有助于提高水生生物的生长、繁殖,增强免疫力及抗病能力[2].但当水体受到污染或机体过度摄入Zn元素,水生生物将产生氧化应激反应,从而破坏生物体的抗氧化酶防御系统,进而导致生物体产生不良的生理反应,甚至死亡[3].因此,对于水生生物抗氧化系统在重金属锌胁迫下的研究,既丰富了水生动物的生理资料,又为健康水生动物养殖提供了可靠的科学依据,同时也可间接地反映水环境中氧化污染物的存在,对灵敏地监测生态污染指标有着重要的意义[4].
大型溞Daphnia magna在水域态系统中广泛分布,具有生活周期短、繁殖快、易于在实验室培养、对毒物敏感、经济简便等优点,加之其在水域生态系统中的重要性,已经被广泛用于各种水质毒性评估和水生生物毒性试验[5],是国际标准组织(ISO)公认的检测水质标准实验的生物之一.
目前关于重金属锌对水生动物急性毒性实验的报道较多[6-7],对大型溞毒性试验也有相关报道[8-9],但从毒性试验角度出发进而观察机体内过氧化氢酶(Catlase from micrococcus lysodeikticus,CAT)、超氧化物歧化酶(Superoxidedismutase,SOD)和谷胱甘肽(Glutathione,GSH)的变化,在建鲤幼鱼Cyprinuscarpio var.Jian,凡纳滨对虾Litopenae usvannamei,中华绒螯蟹Eriocheir sinensis Milne-Edwards等动物中有过报道[10-12],尚未见到重金属锌(Zinc,Zn)对大型溞有关酶活性影响的报道.为此,本文旨在以大型溞为受试生物,通过急性实验得出其半致死浓度LC50,并以LC50作为参考,设置不同质量浓度对其超氧化物歧化酶的研究,为大型溞毒性检测中的抗氧化指标提供参考和积累基础资料.
全文HTML
-
试验所需重金属锌由ZnSO4·7H2O分析纯获得,由广东西陇化工有限公司生产,用去离子水配制成5 mg/L母液,试验时稀释成所需质量浓度.
大型溞由北京市水产科学研究所实验室提供,在人工气候箱(RTOP-500D)中进行克隆培养[温度(23±1) ℃、光暗比12 h:12 h、湿度50%].挑选健康个体使其处于孤雌生殖状态,连续培养3代以上达到试验所需幼溞数量.试验前挑选出生6~24 h的健康活泼幼溞进行毒性试验[13].试验用水为曝气除氯24 h以上的自来水,pH=8.7,DO(溶氧)为6~8 mg/L.大型溞饵料为四尾栅藻Scenedesmus quadricanda,投饵密度为2.0×105~3.0×105 cells/mL.
组织中可溶性蛋白质含量,抗氧化指标SOD,CAT活性及GSH含量的测定均采用南京建成生物工程研究所试剂盒的方法测定.
-
急性毒性试验采用静态更新试验方法,在人工气候箱中进行.根据预实验找出被测物使全部大型溞运动受抑制的质量浓度和最大耐受质量浓度范围,然后在此范围内按等对数间距[13]分别设置7个试验组(0.2 mg/L,0.31 mg/L,0.5 mg/L,0.79 mg/L,1.26 mg/L,2 mg/L,3.2 mg/L)和1个空白对照组,每个试验组设置8个平行.试验容器为150 mL烧杯,盛放120 mL试验溶液,每个烧杯放入60只个体均匀,出生6~24 h的大型溞幼溞.受试溞的死亡标志参考资料参考文献[13].试验期间不换试验溶液,不喂食,24 h后观察大型溞存活状况,并取存活大型溞作为酶源.应用SPSS19.0软件对死亡率进行统计分析,得到ZnSO4溶液对大型溞24 h-LC50值及相应的95%置信区间.
-
取出24 h后各质量浓度下存活的大型溞作为酶源,用滤纸吸出水分,准确称取组织质量之后,加入9倍体积的生理盐水(0.86%),组织匀浆器充分研磨,冰水浴条件下匀浆后制得10%的组织匀浆.将制好的匀浆液用高速冷冻离心机(4 ℃,2 500 r/min)离心10 min,取上清液待稀释成各种抗氧化指标所需要的最佳取样质量浓度.
-
分别根据SOD试剂盒、CAT试剂盒和GSH试剂盒的使用说明(南京建成生物工程研究所生产)测定SOD,CAT活性和GSH含量.
-
急性试验数据依照Logarithmic concentration-Probit assays方法进行处理,将死亡溞数转换成概率单位,计算出实验质量浓度对数,求出概率单位与实验质量浓度对数的回归方程.试验数据以“平均值±标准差”表示,试验数据采用SPSS19.0 Duncan法(Duncan's multiple range test)多重比较分析差异显著性,显著性水平若p<0.05,则表示差异具有统计学意义.
1.1. 试验材料
1.2. 试验方法
1.2.1. 急性毒性试验
1.2.2. 酶源的制备
1.2.3. 超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽(GSH)的测定
1.2.4. 数据处理
-
Zn2+对大型溞的急性毒性实验结果见表 1.从表 1可以看出,随着Zn2+质量浓度升高,大型溞死亡率呈明显的上升趋势,当Zn2+质量浓度达到3.2 mg/L时,大型溞在24 h内全部死亡,且各试验组比对照组死亡的溞数量均显著增多(p<0.05). Zn2+对大型溞的24 h-LC50为0.75 mg/L,LC95为15.63 mg/L,95%置信限为0.55~1.04 mg/L,概率单位与实验质量浓度对数的直线回归方程为Y=5.153 0+1.249 5x(R2=0.969 0).
-
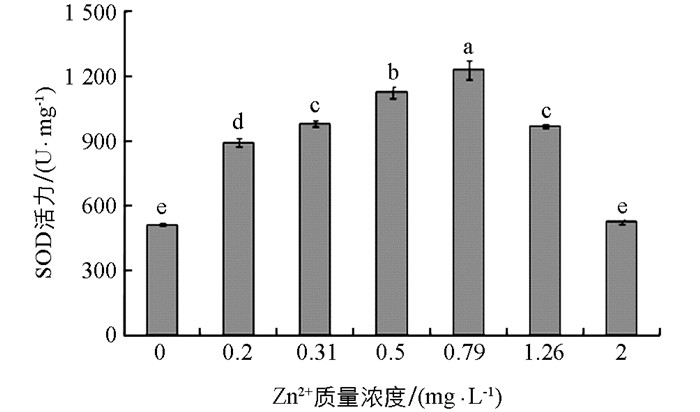
Zn2+作用下大型溞组织中SOD活性的变化见图 1.由图 1可见,随着试验液中添加的Zn2+质量浓度增大,大型溞组织中SOD活性逐渐升高,当Zn2+质量浓度增大到0.79 mg/L时,大型溞组织中SOD活性达到最大值(1232.4±43) U/mg,且与添加的其他Zn2+质量浓度下的SOD活性值差异显著(p<0.05);当Zn2+质量浓度大于0.79 mg/L时,溞组织中SOD活性值随着Zn2+质量浓度增大逐渐降低;当Zn2+质量浓度增大到2 mg/L时,溞组织中SOD活性值下降到(526.9±12.6) U/mg,与对照组溞组织中SOD活性值(515.2±5.78) U/mg无显著性差异(p>0.05).
-
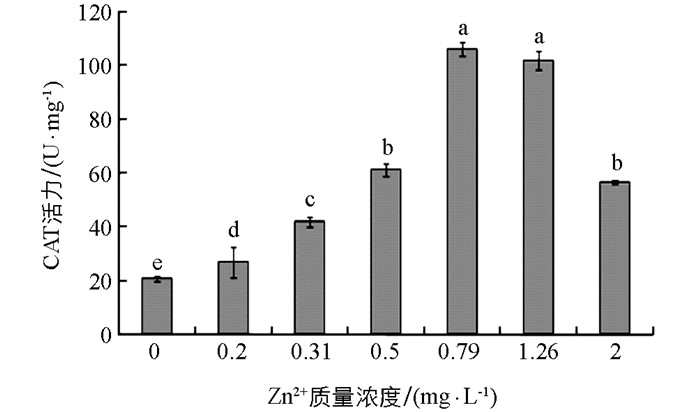
Zn2+作用下大型溞组织中CAT活性的变化见图 2.由图 2可见,无Zn2+添加的对照组溞组织中CAT活性值为(20.7±1.03) U/mg,随着试验液中添加的Zn2+质量浓度增大,大型溞组织中CAT活性逐渐升高,当Zn2+质量浓度增大到0.79 mg/L时,大型溞组织中CAT活性达到最大值(106.5±2.65) U/mg;当Zn2+质量浓度大于0.79 mg/L时,溞组织中CAT活性值随着Zn2+质量浓度增大逐渐降低;当Zn2+质量浓度增大到2 mg/L时,溞组织中CAT活性值下降到(56.9±0.65) U/mg.试验液中添加的Zn2+质量浓度≤ 2 mg/L时,其溞组织中CAT活性值都显著地高于对照组(p<0.05).
-
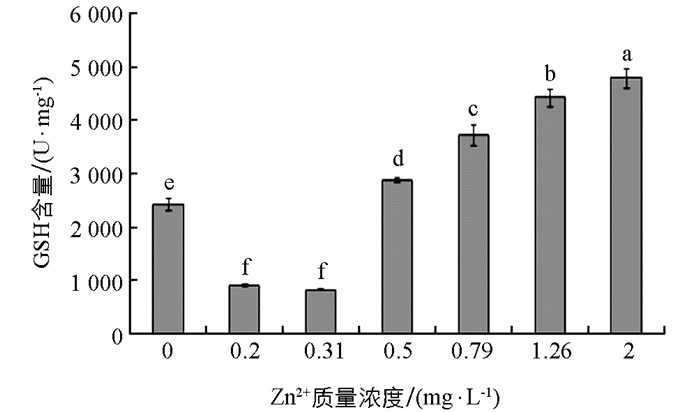
Zn2+作用下大型溞组织中GSH含量的变化见图 3.从图 3中可见,对照组大型溞组织中GSH含量为(2434.6±115.94) U/mg,随着试验液中添加的Zn2+质量浓度增大,大型溞组织中GSH含量先逐渐降低,当Zn2+质量浓度增大到0.31 mg/L时,大型溞组织中GSH含量达到最小值(835.6±9.31) U/mg;随着Zn2+质量浓度逐渐增大,溞组织中GSH含量逐渐升高,而且各Zn2+质量浓度组溞组织中GSH含量不仅显著比对照组高(p<0.05),而且各组间的值也存在显著差异(p<0.05).
2.1. Zn2+对大型溞的急性毒性
2.2. Zn2+对大型溞SOD酶活性的影响
2.3. Zn2+对大型溞CAT酶活性的影响
2.4. Zn2+对大型溞GSH含量的影响
-
水生溞类在生态系统能量金字塔中起着重要作用,通常大型溞作为初级消费者将能量从植物向动物转移[14],而水体中的一定质量浓度的Zn等重金属会对大型溞产生毒性,从而导致其世代更替不仅会影响到种群数量、能量之间的分配和循环,最终还会影响水生溞类的群落结构.重金属Zn2+对水生生物的毒性主要是Zn2+与水生生物体内大分子作用的结果. Zn2+虽然是必需金属,但质量浓度过高时可以置换酶活性中心的其他必需金属离子或者直接与酶的功能基团结合使其结构改变导致酶失活[15].此外,DNA和RNA都含有许多可结合金属离子的活性位点和非活性位点,同样可以与Zn2+结合,使遗传信息在传递过程中出现错误,对水生生物产生毒性作用[15].
王建国等[16]报道了ZnSO4对中华绒螯蟹Eriocheir sinensis仔蟹、克氏原螯虾Procambarus clarkii幼虾及田螺Cipangopaludina chinensis Gray的24 h-LC50分别为18.39,84.48,89.34 mg/L.在本实验中,ZnSO4对大型溞的24 h-LC50仅为0.75 mg/L,这可能是由于重金属对于水生生物的毒性强度除了与其总量及形态有关,还与环境(如温度、pH值等)有关,同时与生物自身的耐受性、大小、质量等都密切相关[17-18].大型溞明显身体小,体质量轻,因而耐受性相对较低.陈娜等[19]在Zn2+对水螅Hydra sp.急性毒性效应的研究中发现,水螅的24 h-LC50为4.8 mg/L;赵含英[20]报道了Zn2+对萼花臂尾轮虫Brachionus calyciflorus的24 h-LC50为1.65 mg/L.尽管大型溞个体比水螅和萼花臂尾轮虫大,分类地位更高,但本研究发现其对于Zn2+的敏感性比水螅和萼花臂尾轮虫的敏感性更高,说明不同物种、个体对于Zn2+的敏感性存在差异.
-
超氧化物歧化酶(SOD),过氧化氢酶(CAT)等是生物体抗氧化防御系统中重要的酶类,在预防机体受到外界损伤中有关键作用. Zn2+等重金属离子进入水生生物体内后,体内可产生大量的自由基,若不及时清除,则破坏生物体活性氧的平衡.此时机体内抗氧化酶系统启动,对抗活性氧的清除和胁迫,抵御不良环境的伤害. SOD可以有效地清除机体内的活性氧,同时又产生H2O2,而H2O2的清除由CAT抗氧化机制完成[21-22].因此,SOD和CAT的活性检测在水域生态系统重金属的污染中受到了广泛重视[4].
在本研究中,大型溞体内的SOD和CAT均在低质量浓度Zn2+下被诱导,随溶液中Zn2+质量浓度逐渐升高,SOD和CAT活性值也随之上升,当Zn2+质量浓度达到0.79 mg/L时,其酶活力均最好,之后开始下降.这是因为达到一定质量浓度的Zn2+可能与带羧基或氨基的蛋白分子结合,导致许多酶系统活性受到抑制,最后组织不能正常运作,致使大型溞死亡[23]. Zn2+对酶效应曲线呈现出先升高再下降的趋势,很好地表达了抛物线型剂量—效应关系[24],对于重金属的污染检测及抵抗不良环境有着重要的意义.于庆云等[25]报道了镉和铅对菲律宾蛤仔脂质过氧化及抗氧化酶活性的影响,结果表明在金属胁迫初期,随质量浓度加大,抗氧化酶应激系统被激活,导致其消化组织中SOD和CAT酶活性显著升高,超出对照水平,诱导效应明显,但随着质量浓度加大,损伤程度进一步扩大,SOD和CAT酶活性缓慢回落,使得其活性呈现出明显的先升高再下降的趋势,充分体现了低质量浓度促进,高质量浓度抑制的现象[26]. Rodriguer-Ariza等[27]报道了污染淡水水域中的鲻鱼Mugil cephalus比未受污染水域的鲍鱼肝脏CAT活性显著升高,一定质量浓度后抑制. Mather-Mihaich等[28]同样发现生活在有造纸厂排放废水水体中的鮰鱼Ictalarus Punctatus有此现象.本研究与吴众望等[11]对重金属离子对凡纳滨对虾肝胰脏、鳃丝和血液SOD活性的影响研究及潘鲁青等[12]分析重金属离子对中华绒鳌蟹肝胰脏和鳃丝SOD,CAT活性的影响所得的结果都基本一致. Stebbing[29]认为毒物在低质量浓度下出现的这种增益现象,是其在无毒情况下的刺激反应,他把这一现象称为“毒物兴奋效应”.
-
还原型谷胱甘肽(GSH)是机体内最重要的非酶性抗氧化物,是一种低分子清除剂,具有清除自由基、解毒、促进铁质吸收、维持组织生长发育及细胞免疫等多种生理生化功能;同时也是组织中主要的非蛋白质巯基化合物,还是GSH-PX和GSH-ST两种酶的底物,在维持生物体内适宜的氧化酶系统中有着重要的作用[30-31]. Stein等[32]认为生物体内总GSH可以用作检测环境质量污染程度的标志物.因此,GSH含量变化多用作表示重金属污染的生态毒理学指标.
在本研究中,大型溞体内GSH含量随溶液中Zn2+质量浓度的增加呈先下降后上升的趋势.巩秀玉等[33]研究了壬基酚对波纹巴非蛤Paphia undulata胁迫后其外套膜中GSH含量的变化情况;冯涛等[34]报道了苯并(a)芘胁迫对大弹涂鱼Boleophthalmus pectinirosris胁迫后肝脏中GSH含量的变化,其GSH含量变化趋势与本研究结果都基本一致.在Zn2+低质量浓度下以GSH为底物的酶被诱导,且GSH本身也参与亲电自由基的去除,当Zn2+质量浓度升高到0.31 mg/L左右时,大量的GSH被消耗,GSH含量达到最低值;随着Zn2+质量浓度继续升高,越来越多的抗氧化酶失去活性,消耗GSH的酶活性被抑制,使得GSH逐渐积累,抗氧化系统被破坏,使得机体清除H2O2能力逐渐降低.许阳光[35]在研究苯醚甲环唑和丙环唑对大型溞溞体内谷胱甘肽-S-转移酶活性的影响中则发现,在苯醚甲环唑作用下,大型溞体内GST活性与其质量浓度呈正相关,而在丙环唑作用下,GST活性则先升后降.由于GST的活性增强会促进GSH与毒物的结合强度,一次GST活性的变化代表了GSH含量的变化趋势.可见,大型溞对不同毒物的解毒过程和程度还是有差异的.目前关于重金属离子对水生生物GSH含量影响的报道不多,还有待于进一步研究.
3.1. Zn2+对大型溞的急性毒性影响
3.2. Zn2+对大型溞SOD,CAT酶活性的影响
3.3. Zn2+对大型溞GSH含量的影响
-
本试验是对重金属锌胁迫下大型溞抗氧化酶系统的研究,随着试验组溶液Zn2+毒性增大,SOD和CAT活性值也随之上升,当Zn2+质量浓度达到0.79 mg/L时,其酶活力均最好.而大型溞GSH含量随溶液中Zn2+质量浓度的增加呈先下降后上升的趋势.当Zn2+质量浓度达到0.31 mg/L左右时,以GSH为底物的酶诱导达到最佳.机体抗氧化酶指标的变化在很大程度上反映环境毒物对水生生物的毒性,抗氧化酶指标中各种酶之间既互相关联又彼此独立,因此在分析和评价污染物对水生生物的毒性效应时有着重要意义.目前关于重金属对大型溞抗氧化酶系统研究的报道并不多,本研究可为水生生物毒理试验丰富资料,也进一步为大型溞毒性检测中的抗氧化指标提供参考.



 下载:
下载: