-
蓝粒小麦是通过染色体工程创造的一类胚乳为蓝色、整个籽粒表现为蓝色的小麦,紫粒小麦则是由于其果皮中含有紫色色素而呈紫色[1-4].蓝、紫粒小麦籽粒中蛋白质、氨基酸、维生素、微量元素质量分数高[5-6],其中含有的色素、黄酮等物质具有很强的抗氧化作用,因而具有特殊的营养保健价值[7].此外,“蓝粒”是一种非常有意义的形态标记,其单体作为一种重要的工具已应用于小麦染色体工程中[8-9].目前,对蓝、紫粒小麦遗传特质和营养品质的研究较多,但对其籽粒色素的形成机理研究尚不清楚.本研究以白粒小麦为对照,分析蓝、紫粒小麦籽粒色素质量分数动态变化与色素形成相关酶活力之间的关系,探寻色素形成机理,旨在为蓝、紫粒小麦的遗传改良、高产栽培及应用推广提供理论基础.
全文HTML
-
蓝粒小麦2份,为河东乌麦、031-1;紫粒小麦4份,为032-1、漯珍1号、黑粒小麦76、XNZ-1;白粒小麦2份,为川麦107和绵阳26,是西南地区的对照品种.
以上材料均由西南大学生理生化研究室提供.
-
采用陈玉萍等[10]的方法,取0.2 g鲜材料,加入5 mL的5%盐酸-甲醇溶液,置80 ℃恒温水浴加热1 h(提取过程中适当补充挥发性溶剂),离心,在540 nm下测定OD值,花色素质量分数按下式计算:
式中:V=提取液的体积(mL),Ecr=1%矢车菊素溶液在540 nm处的比吸收系数(1.191),W=样品的质量(g).
-
用60%的乙醇于60 ℃水浴锅黑暗提取24 h,以芦丁作标准曲线,相关系数为0.999 3,工作曲线为y=1.655 6x-0.022.
-
参照周旭章等[11]的方法,将提取过花色素的残渣加入2% NaOH在70 ℃水浴加热提取,直至材料完全变白.定容20 mL,离心后在290 nm处测定OD值,以OD290为1个单位(单位/g).
-
参照王汉中等[12]的方法:称取新鲜小麦籽粒约0.1 g,迅速加入液氮研磨,用10 mL 0.2 mol/L pH=8.8的硼酸缓冲液(内含5 mmol/L巯基乙醇和0.5 g PVP)冰浴研磨,在5 000 r/min离心20 min.取2 mL上清液,加入2 mL硼酸缓冲液混匀,即得稀释的酶提取液.反应体系包括1 mL酶液,2 mL水,1 mL 0.02 mol/L的L-苯丙氨酸溶液,30 ℃水浴保温15 min,在290 nm处测定OD值.酶活力以ΔOD290/h=0.01为一个酶活力单位(U).
-
称取新鲜小麦籽粒约0.2 g,迅速加入液氮研磨,加入2 mL 0.2 mol/L的pH=5.0的磷酸缓冲液,冰浴研磨至匀浆,在4 ℃下提取30 min,9 000 r/min离心10 min.取0.6 mL上清液,加入2 mL pH=5.0的磷酸缓冲液和1 mL 3 mmol/L酪氨酸(对照为3 mL pH=5.0的磷酸缓冲液,无酪氨酸),总体积为3.6 mL,混匀后在305 nm处测定OD值,然后置35 ℃水浴中保温10 min,于305 nm处测定溶液的吸光度(OD1).以OD1-OD0的差值计算酶活力,以OD值每min变化0.1作为一个活性单位(U).
-
称取新鲜小麦籽粒约0.2 g,迅速加入液氮研磨,加3 mL 0.03 mol/L的pH=5.5的磷酸缓冲液,冰浴研磨,12 000 r/min离心10 min,上清液即为酶提取液.反应体系包括0.5 mL酶液,2 mL 0.03 mol/L的pH=5.5的磷酸缓冲液,1 mL新配的0.1 mol/L儿茶酚溶液,35 ℃保温15 min,在525 nm下测定OD值,以OD值改变0.01为一个酶活力单位(U).
-
称取新鲜小麦籽粒约0.5 g,迅速加入液氮研磨,用5%硝酸钙溶液冰浴研磨匀浆,定容25 mL,震荡5 min,于4 ℃静置20 min,5 000 r/min离心5 min,上清液即为酶液.反应体系包括1 mL酶液,7 mL水,1 mL 0.3%愈创木酚,1 mL 0.05 mol/L过氧化氢. 20 ℃准确反应15 min,立即加入2 mL丙酮,终止反应.以另一支试管取9 mL水,加1 mL酶液和2 mL丙酮作参比.在475 mn处测定OD值,以硝酸银作标准曲线进行计算.
-
实验数据用Office工具Excel和统计软件DPS在计算机上进行分析.
1.1. 供试材料
1.2. 实验方法
1.2.1. 花色素质量分数的测定
1.2.2. 总黄酮的测定
1.2.3. 黑色素质量分数的测定
1.2.4. 苯丙氨酸解氨酶(PAL)活力测定
1.2.5. 酪氨酸酶(TRO)活力测定
1.2.6. 多酚氧化酶(PPO)活力测定
1.2.7. 过氧化物酶(POD)活力测定
1.3. 数据分析方法
-
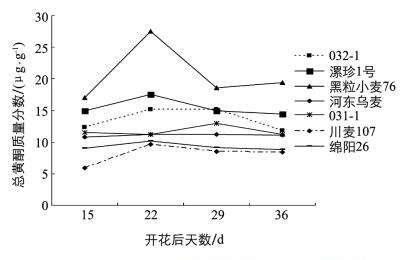
由图 1可知,在籽粒发育进程中蓝粒和紫粒花色素质量分数在籽粒发育的4个进程中呈现出先上升,然后升到最高点,最后又下降的趋势;而2个白粒对照的籽粒花色素质量分数各期差别不大.开花后15 d,黑粒小麦76的花色素质量分数最高,显著高于其他3个紫粒和2个蓝粒品种,2个白粒对照的花色素质量分数很低,其中绵阳26最低.紫粒和蓝粒花色素质量分数在开花后22 d都呈上升趋势,到开花后29 d都升至最高点,黑粒小麦76最高(2.484 6 μg/g),往下依次为漯珍1号、XNZ-1,川麦107和绵阳26最低.到开花后36 d,各品种花色素质量分数均降低.各个时期花色素质量分数紫粒小麦均高于蓝粒小麦,蓝粒小麦又高于对照白粒小麦,其差异达到显著水平.其中紫粒最高峰值为1.837 μg/g,是蓝粒最高峰值(0.768 μg/g)的2.39倍,白粒最高峰值(0.214 μg/g)的8.58倍,蓝粒最高峰值是白粒的3.59倍.说明籽粒花色素质量分数对小麦籽粒呈色有很大影响.
-
由图 2可知,在籽粒发育进程中除漯珍1号外,其余蓝、紫粒小麦籽粒黑色素质量分数在种子发育进程中总体上都呈现出上升的趋势,在开花后36 d出现峰值,漯珍1号在开花后29 d出现峰值.在开花后15 d和22 d,黑粒小麦76的黑色素质量分数高于其他3个紫粒和2个蓝粒品种,2个白粒对照的黑色素质量分数为最低,其中绵阳26最低.在开花后29 d,XNZ-1超过黑粒76黑色素质量分数达到最高(147.882 μg/g),此后也是XNZ-1最高.各时期黑色素质量分数紫粒小麦均高于蓝粒小麦,蓝粒小麦又高于白粒小麦,三者籽粒黑色素质量分数随发育时间的变化呈现出相似的变化规律.说明籽粒黑色素质量分数对小麦籽粒呈色有较大影响.
-
由图 3可知,在籽粒发育进程中总黄酮质量分数随时间变化的规律不及花色素和黑色素质量分数变化规律强.总体来说,紫粒样品和白粒对照的峰值都出现在开花后22 d,但单个样品质量分数变化规律趋于复杂. XNZ-1峰值出现在29 d;黑粒小麦76则经历了上升、下降再上升的复杂过程,并在36 d达到总黄酮质量分数峰值;032-1、漯珍1号、2个白粒对照的峰值基本都在22 d. 2个蓝粒小麦品种的峰值不明显,且出现时期有所不同.虽然各个样品总黄酮质量分数都有峰值出现,但其峰值与初始值的差异(约2~3 μg/g)都不是很大.
总黄酮质量分数变化规律较差,很可能是由于总黄酮为植物一大类物质的总和,其中各个物质的变化规律可能有所不同,故而导致其质量分数变化规律性不强.总的来说总黄酮质量分数从大到小依次为紫粒、蓝粒、白粒.说明总黄酮质量分数对籽粒呈色有一定影响.
-
由图 4可知,在籽粒发育进程初期所有受试材料的PAL酶活性都较低. 4个紫粒小麦品种籽粒PAL酶活性在种子发育进程中前3个阶段呈上升的趋势,在开花后29 d又都下降;2个蓝粒小麦该酶活性在开花22 d达到峰值,在开花后22 d以后逐渐下降;白粒对照与蓝粒有相同的趋势. 8个样品在开花后36 d的酶活性均降低到接近开花后15 d的酶活性水平.黑粒小麦76的PAL酶活性始终最高,漯珍1号、XNZ-1、032-1依次下降,川麦107酶活性最低.各个样品不同时期PAL活性差异明显,从大到小依次为紫粒酶活性、蓝粒酶活性、对照白粒酶活性,说明PAL活性与小麦籽粒呈色关系密切.
-
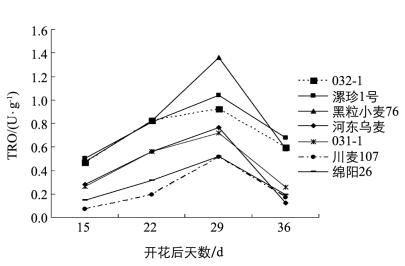
由图 5可知,在籽粒发育进程初期所有受试材料的TRO酶活性都较低. 6个样品和2个对照品种小麦籽粒TRO酶活性在种子发育进程中4个阶段都呈现出先上升,在开花后29 d达到峰值后又下降的趋势.在TRO酶活性达到峰值时,黑粒小麦76的酶活性最高(1.3608 U/g),漯珍1号、032-1和XNZ-1依次降低. 2个蓝粒小麦TRO酶活性低于紫粒,但几乎各个时期都高于白粒对照.由此可见,TRO活性差异明显,从大到小依次为紫粒、蓝粒、对照白粒,三者TRO酶活性随时间增加呈现出相似的变化规律,表明TRO活性与小麦籽粒呈色有关.
-
由图 6可知,在籽粒发育进程中所有样品PPO酶活性都呈现出由低到高,之后又有所降低的趋势,末期酶活性虽有所降低,但仍高于初期水平.除032-1在22 d达到峰值外,其他品种均在29 d出现峰值,黑粒小麦76、XNZ-1在29 d有明显的峰值,而2个白粒小麦开花后29 d和36 d酶活性差距不大.在8个样品中,黑粒小麦76的酶活性始终最高,XNZ-1、漯珍1号其次,2个白粒对照酶活性最低.总的来说,4个紫粒样品PPO酶活性均明显高于蓝粒样品PPO酶活性,而蓝粒酶活性又明显高于白粒对照.以上结果表明PPO活性可能与小麦籽粒呈色有关.
-
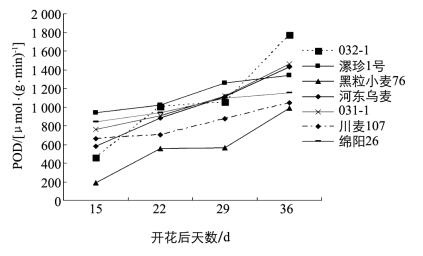
由图 7可知,在籽粒发育进程中籽粒POD酶活性在紫粒、蓝粒、白粒对照之间存在差异,且不同发育时期也存在差异.在籽粒发育初期,籽粒酶POD活性较低,不同品种之间差异不大.到开花后22 d,各个材料的POD酶活性均高于初期,且紫粒高于蓝粒,蓝粒又高于白粒.开花后29 d时,各材料的POD酶活性较开花后22 d均有上升,达到酶活性峰值.开花后36 d时POD酶活性下降,但仍高于开花后15 d酶活性水平.蓝粒和紫粒POD酶活性在各个时期均高于白粒对照,且籽粒POD酶活性在发育进程中,甚至接近成熟时仍保持相对上升的趋势,说明该酶活性对籽粒色泽形成及最后呈色有较大影响.
2.1. 蓝、紫粒小麦籽粒发育过程中花色素质量分数的动态变化
2.2. 蓝、紫粒小麦籽粒发育过程中黑色素质量分数的动态变化
2.3. 蓝、紫粒小麦籽粒发育过程中籽粒总黄酮质量分数的动态变化
2.4. 蓝、紫粒小麦籽粒发育过程中苯丙氨酸解氨酶(PAL)活性的动态变化
2.5. 蓝、紫粒小麦籽粒发育过程中籽粒酪氨酸酶(TRO)活性的动态变化
2.6. 蓝、紫粒小麦籽粒发育过程中籽粒多酚氧化酶(PPO)活性的动态变化
2.7. 蓝、紫粒小麦籽粒发育过程中籽粒过氧化物酶(POD)活性的动态变化
-
花色素和原花色素是小麦籽粒颜色的重要组成物质[13],从小麦籽粒发育进程中色素质量分数的变化趋势来看,花色素质量分数呈先升后降的趋势,且在紫粒、蓝粒及白粒之间差异显著.在8个受试样品中,紫粒小麦样品黑粒小麦76花色素质量分数最高,为白粒小麦对照绵阳26的10.938倍,即使是特殊粒色小麦中花色素质量分数最低的蓝粒小麦样品031-1的质量分数也是绵阳26的3.571倍.紫粒、蓝粒、白粒小麦的颜色深浅与色素质量分数均呈正相关.
小麦的苯丙氨酸解氨酶PAL催化L-苯丙氨酸生成反式肉桂酸,进而生成花色素和原花色素,影响着小麦籽粒的颜色,其酶活性越高,籽粒颜色越深[8].
PAL酶活性随着籽粒成熟时期的推移有较大变化,一般在开花后22 d或开花后29 d达到峰值,这与籽粒色素变化具有一致性. PAL酶活性在紫粒、蓝粒、对照白粒之间均存在显著差别,从大到小依次都是紫粒、蓝粒、白粒.各个样品PAL酶活性数据表明,紫粒、蓝粒、白粒小麦的颜色深浅与PAL酶活性基本呈正相关.在小麦发育过程中色素质量分数是由酶活性决定的.由本实验所得数据可知,色素质量分数变化趋势与酶活性变化趋势基本符合.因此,PAL与小麦粒色紧密相关.
此外,PAL作为苯丙烷类代谢的关键酶,在一定程度上也会影响黑色素的生成.酪氨酸经PAL催化脱氨形成反式香豆酸,进而转化为P-经苯甲酸后进入多酚类物质代谢,而酚类可氧化成黑色素合成的中间产物醌类[14-15],其酶活性大小可影响籽粒颜色深浅,酶活性变化大体与粒色呈正相关.
总黄酮是一大类天然产物,广泛存在于植物界.总黄酮包括黄酮和黄酮醇、二氢黄酮醇、异黄酮、二氢黄酮、黄烷醇、查尔酮、橙酮、花色苷及新黄酮类等,其中具有多种花色素合成前体,故而总黄酮质量分数也是影响花色素合成的重要因素[16-17].在所有受试样品中,总黄酮质量分数随时间的动态变化虽不如花色素和黑色素有规律,但其质量分数变化的总规律从大到小依次也是紫粒、蓝粒、白粒.由此可见,总黄酮也对籽粒呈色有影响,而且与种子呈色物质形成有关.
黑色素质量分数在籽粒发育进程中几乎一直呈上升趋势,其质量分数紫粒最高,蓝粒其次,白粒最低,三者黑色素质量分数随时间变化的趋势基本一致,表明黑色素可能对小麦籽粒呈色有影响,而且与种子呈色物质形成有关,且黑色素质量分数比花色素质量分数对籽粒呈色影响更大.
小麦的酪氨酸酶、多酚氧化酶、过氧化物酶都是小麦体内的重要氧化酶类,可将酚类氧化成醌类,进而生成黑色素,使小麦呈不同颜色,而且酶活性越高,籽粒颜色越深[7].本研究结果表明,紫粒、蓝粒、白粒小麦的颜色深浅与黑色素质量分数呈正相关,而黑色素质量分数高低又与酪氨酸酶、多酚氧化酶、过氧化物酶活性高低变化趋势基本符合.因此,酪氨酸酶、多酚氧化酶、过氧化物酶与小麦粒色形成紧密相关.
小麦籽粒的颜色与花色素、黑色素、总黄酮质量分数密切相关,色素质量分数越高,其籽粒颜色越深.这3种色素的质量分数又受苯丙氨酸解氨酶、酪氨酸酶、多酚氧化酶、过氧化物酶等酶影响,酶活性的高低决定了产物量的大小.特殊粒色小麦这些酶的高酶活性与其高色素质量分数呈正相关,说明这些酶确实可以影响粒色.但是,这些酶影响粒色的具体过程及在粒色形成过程中是否还有其他关键酶类的参与,还有待于进一步研究.




 下载:
下载: