-
苹果属Malus Mill.是蔷薇科经济价值较高的植物,包括苹果Malus domestica Borkh、垂丝海棠Malus halliana Koehne、山定子Malus baccata (Linn.) Borkh.等重要水果品种和园林树种,在北温带,亚洲、欧洲及北美洲均有分布[1].近年来,我国进口苹果属水果及其种苗持续增加,2013年仅苹果进口量就约有3.9万t,金额达6,861万美元.随着苹果属水果及其种苗的进口持续增长,有害生物随之传入我国的风险增大.
疫霉属Phytophthora spp.真菌是侵染苹果属植株的重要病菌,通常多种病菌同时侵染同株果树,可造成植株果腐(brown rot of fruit)、根腐(root rot)、树干基部脚腐(foot rot)等病害[2-4].据报道,全世界为害苹果属植物的疫霉约9种[3-5],其中冬生疫霉P. Hibernalis[6]、丁香疫霉P. syringae[7]和栗黑水疫霉P. cambivora[8]为我国禁止进境的植物检疫性病原菌.疫霉菌通过土壤传播,其卵孢子和原膜孢子在土壤中可存活多年,由疫霉菌引发植物病害后很难有效控制,所以苹果植株、土壤和灌溉水中病原菌的早期诊断监测能有效控制病害的发生与恶化.目前疫霉菌检测方法为传统的形态检测,其周期长,步骤繁琐[6, 9-10],不能满足高通量、快速的检测要求.随着DNA检测技术的发展,PCR、多重PCR等方法已成为水果疫霉快速检测的主要方法.但目前尚未有苹果属上述3种检疫性疫霉PCR检测的报道.
18S rDNA区域在真菌种间变异度低,拷贝数多,是病原菌分子检测中质量控制的理想靶基因;rDNA的ITS区具有在真菌种间变异度高、在种内稳定等特点,是病原菌分子检测理想的靶序列,以ITS序列分析为基础,已成功开发了多种疫霉的分子检测引物[11-13].但并非所有的疫霉菌都必须通过ITS基因来鉴定区分,如烟草疫霉[14]和樟疫霉[15]可分别以elicitin 1基因和贮存蛋白家族基因来实现其特异检测,这两类基因没有内含子,不能像ITS基因一样被广泛应用. Ras-like protein Ypt1 (Yeast protein two 1) 基因序列存在较多差异位点[16],几乎可以适用于所有疫霉菌,但由于该基因序列较短使其应用受到限制. Heat Shock Protein 90 (HSP 90) 基因序列较长,在疫霉种间基因序列的相似性达95%左右,可通过序列比对设计部分疫霉种的特异引物.
本文以冬生疫霉、丁香疫霉和栗黑水疫霉3种检疫性真菌病害及其他侵染苹果属植物的疫霉为研究对象,分析其18S rDNA序列,设计通用引物,根据其ITS、HSP 90和Ypt1基因序列的分析分别设计冬生疫霉、丁香疫霉和栗黑水疫霉的特异性引物,经反应体系优化,建立苹果属冬生疫霉、丁香疫霉和栗黑水疫霉菌丝基因组DNA的四重PCR检测方法,并进行了灵敏度和模拟带菌测试.
全文HTML
-
供试菌株:本研究所用的11个供试菌株:冬生疫霉ATCC56353 1株;丁香疫霉ATCC34002和Lif2012-4共2株;栗黑水疫霉ATCC36228和ATCC38811共2株;另外6株为其近似种(表 1).
供试苹果:苹果品种为红灯Malus pumila. cv. Red Fuji,产地为山东烟台.
引物设计:比对GenBank公布的苹果属上9种疫霉菌的18S rRNA基因序列,在其保守区设计疫霉属的通用引物18SUF/18SUR;以真菌rDNA内转录间隔区的通用引物ITS4/ITS5对11株疫霉菌扩增测序,据其序列差异位点设计冬生疫霉的特异引物PHSF/PHSR;以樟疫霉的热激蛋白HSP 90基因(EU079760) 设计引物HSPF/HSPR,用于扩增供试真菌材料HSP 90基因,据其HSP 90基因序列差异设计丁香疫霉的特异引物PSSF/PSSR;以棕榈疫霉的Ypt1基因(HQ850011) 设计引物YptF/YptR,用于扩增供试真菌材料Ypt1序列,据其Ypt1基因序列差异设计栗黑水疫霉的特异引物PCSF/PCSR,引物设计采用Primer Premier V5.0软件,由上海英骏生物技术有限公司合成(表 2).
试剂及仪器:PCR缓冲液、Taq DNA聚合酶、dNTP等购自大连宝生物公司;DNA提取试剂盒DNeasy Plant Mini Kit购自美国QIAGEN公司. Tprofessional梯度PCR仪,德国Whatman Biometra公司;Infinity-3026凝胶成像系统,法国VILBER LOURMAT公司;岛津Uvmini-1240紫外分光光度计,日本岛津公司.
-
将供试菌培养、收集菌丝,采用DNA提取试剂盒提取菌丝DNA,并将菌丝DNA溶于100 μL 1× TE缓冲液中,其余菌丝DNA置于-70 ℃保存.对11个菌株菌丝基因组DNA进行通用引物18SUF/18SUR扩增,反应体系为30 μL,包含10×Buffer 3.0 μL(其中含终浓度为1.5 mmol/L的MgCl2);2.5 mmol/L dNTPs 2.0 μL;10 μmol/L引物18SUF/18SUR各为0.2 μL;0.4 μL Taq DNA聚合酶(5 U/μL);DNA模板1 μL(约20 ng),加双蒸水至30 μL,以双蒸水为模板作为阴性对照.反应程序:94 ℃预变性4 min;94 ℃变性30 s,63 ℃复性20 s,72 ℃延伸45 s,35个循环;72 ℃延伸7 min. 2%琼脂糖凝胶电泳,EB染色并成像观察,对各产物测序并进行序列比对分析.
对11个菌株菌丝基因组DNA进行ITS4/ITS5,HSPF/HSPR及YptF/YptR引物扩增,反应体系中除引物体积各为1.0 μL外,其余参数同上;反应程序除退火温度不同外,其余条件均相同,72 ℃延伸7 min. 2%琼脂糖凝胶电泳,溴乙锭染色及成像观察,对各产物测序并进行序列比对分析.对11个菌株菌丝基因组DNA分别进行特异性引物PHSF/PHSR,PSSF/PSSR及PCSF/PCSR扩增,反应体系与反应程序均同HSPF/HSPR引物扩增. 2%琼脂糖凝胶电泳,溴乙锭染色及成像观察.
-
在其他因素保持不变的条件下,对通用引物浓度、特异引物浓度、退火温度、退火时间4方面优化.通用引物18SUF/18SUR扩增效率较强,设置其优化范围为0.1~0.6 μL,梯度为0.1 μL;10 μmol/L特异引物PHSF/PHSR,PCSF/PCSR和PSSF/PSSR优化范围均为0.2~1.2 μL,梯度为0.2 μL;退火温度优化范围为60~65 ℃,梯度为1 ℃;退火时间优化范围为5~30 s,梯度为5 s.
-
利用通用引物18SUF/18SUR及3对特异引物PHSF/PHSR,PSSF/PSSR和PCSF/PCSR扩增11个菌株菌丝基因组DNA,采用上述优化结果建立的扩增体系为20 μL:10×Buffer 2.0 μL(含终浓度为1.5 mmol/L的MgCl2)、2.5 mmol/L dNTPs 2.0 μL、5 U/μL Taq DNA聚合酶0.4 μL、10 μmol/L引物18SUF/18SUR,PHSF/PHSR,PCSF/PCSR和PSSF/PSSR分别为0.2,0.6,0.8,1.0 μL,DNA模板1.0 μL、加双蒸水至20 μL,以冬生疫霉(ATCC56353)、丁香疫霉(ATCC34002) 和栗黑水疫霉(ATCC36228) 混合DNA的四重PCR扩增为阳性对照,以双蒸水代替模板作为阴性对照.反应程序:94 ℃预变性4 min;94 ℃变性30 s,63 ℃复性20 s,72 ℃延伸35 s,35个循环;72 ℃延伸7 min,2%琼脂糖凝胶电泳,EB染色及成像观察.
-
将冬生疫霉、丁香疫霉和栗黑水疫霉菌丝体基因组DNA用紫外分光光度计进行核酸质量浓度测定,定量为20 ng/μL作为初始质量浓度,再进行10倍梯度稀释,共设置6个质量浓度梯度,作为PCR扩增模板.分别以不同质量浓度的DNA模板进行单重PCR和四重PCR反应,阴性对照用ddH2O代替模板DNA.单重PCR反应体系和程序同1.2.1,四重PCR反应体系和程序同1.2.3,扩增结束后2%琼脂糖凝胶电泳,溴乙锭染色、观察.
-
将11株疫霉菌菌丝(每株约2 mg)与新鲜的苹果组织(约20 mg)混合后提取DNA,将提取的DNA进行四重PCR扩增,扩增体系及循环参数设置见前,设置阴性对照. 2%琼脂糖凝胶电泳,EB染色、观察.
1.1. 材料
1.2. 方法
1.2.1. 菌丝DNA提取、扩增测序及引物验证
1.2.2. 四重PCR扩增体系的优化
1.2.3. 菌丝基因组DNA四重PCR检测方法的建立
1.2.4. 四重PCR检测灵敏度测试
1.2.5. 模拟带菌检测
-
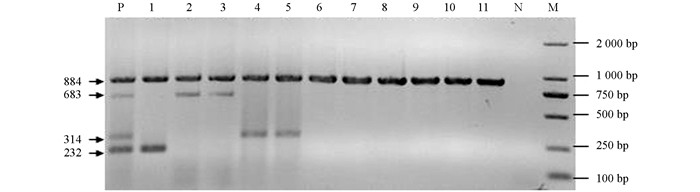
引物18SUF/18SUR,ITS4/ITS5,HSPF/HSPR和YptF/YptR对11个菌株菌丝基因组DNA进行扩增结果表明,通用引物18SUF/18SUR扩增所有菌株出现相同大小目的条带,经测序得到18S rDNA区域扩增片段884 bp;ITS4/ITS5扩增产物经测序得到大约830 bp的片段,不同种菌株之间此片段大小略有差异,扩增序列经BLAST分析均为ITS基因,且比对结果表明ITS基因能够提供足够丰富的差异位点,据此设计冬生疫霉的特异性引物PHSR/PHSR;YptF/YptR扩增产物经测序得到大小约为470 bp的片段,经BLAST分析扩增结果表明Ypt1基因能够提供足够丰富的差异位点,据此设计栗黑水疫霉的特异引物PCSF/PCSR;HSPF/HSPR扩增产物经测序得到大小约为890 bp的片段,根据差异位点设计丁香疫霉的特异引物PSSR/PSSR.经验证4对引物的特异性均很好(图 1).
-
经过多次条件优化,确定最佳引物组合8SUF/18SUR,PCSF/PCSR,PHSF/PHSR和PSSF/PSSR依次为0.2,0.6,0.8,1.0 μL,最佳退火温度为63 ℃;最佳退火时间为20 s.建立了苹果属冬生疫霉、丁香疫霉和栗黑水疫霉的四重PCR检测方法.
冬生疫霉(ATCC56353)、丁香疫霉(ATCC34002) 和栗黑水疫霉(ATCC36228) 混合DNA的四重PCR扩增产生18S rRNA区域的884 bp、HSP90区域的683 bp、Ypt1区域的314 bp和ITS区域的232 bp特异片段;冬生疫霉ATCC56353四重PCR产生18S rRNA区域884 bp片段和ITS区域232 bp特异片段;丁香疫霉的2个菌株ATCC34002和Ljf2012-4四重PCR产生18S rRNA区域884 bp片段和HSP90区域683 bp特异片段;栗黑水疫霉的2个菌株ATCC36228和ATCC38811四重PCR扩增产生18S rRNA区域884 bp片段和Ypt1区域314 bp的特异片段;苹果属上其他6株疫霉菌四重PCR扩增,只产生18S rRNA区域884 bp条带,无冬生疫霉、丁香疫霉和栗黑水疫霉特异引物扩增片段;阴性对照无以上条带.结果表明,通过2%琼脂糖凝胶电泳能够明确区分冬生疫霉、丁香疫霉和栗黑水疫霉及苹果属的其他疫霉菌(图 2).
-
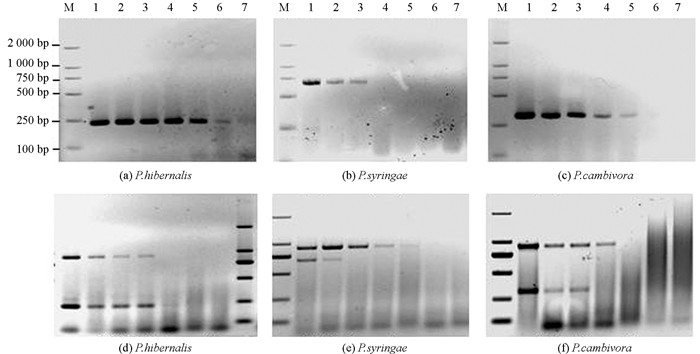
单重PCR反应灵敏度检测中冬生疫霉灵敏度可达0.2 pg/μL,丁香疫霉灵敏度可达0.2 ng/μL,栗黑水疫霉灵敏度可达2 pg/μL(图 3).
在四重PCR反应灵敏度检测中,18SUF/18SUR扩增冬生疫霉和栗黑水疫霉模板低限质量浓度均为2 pg/μL,丁香疫霉低限质量浓度均为0.2 pg/μL,PSSF/PSSR扩增丁香疫霉模板低限质量浓度为2 ng/μL,PCSF/PCSR扩増栗黑水疫霉模板低限质量浓度为0.2 ng/μL,与单重PCR反应体系相比,冬生疫霉、丁香疫霉和栗黑水疫霉特异性扩增灵敏度均有所降低.
-
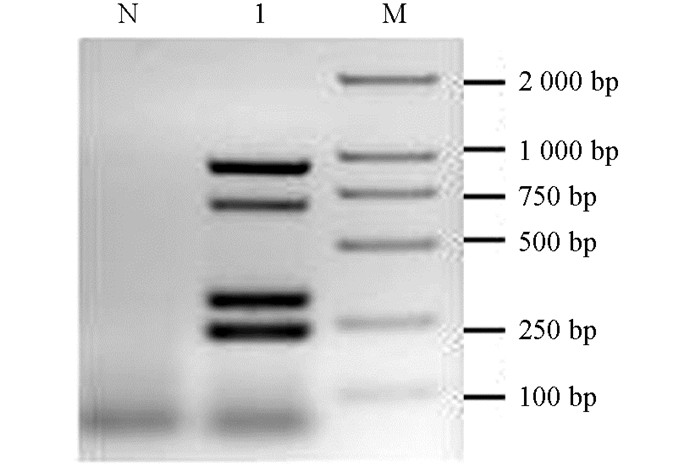
11株疫霉菌与苹果混合DNA四重PCR产生18S rRNA区域884 bp扩增片段、ITS区域232 bp特异片段、Ypt 1区域314 bp特异片段和HSP 90区域683 bp特异片段(图 4),添加无菌水为阴性对照则无相应目的片段.
2.1. 18S rDNA,ITS,HSP 90及Ypt1基因引物设计与特异性验证
2.2. 菌丝基因组DNA四重PCR检测体系的建立
2.3. 四重PCR灵敏度测试
2.4. 模拟带菌检测
-
近年来,国内外用于疫霉快速检测的主要方法是PCR、多重PCR、real-time PCR等,其中多重PCR以其灵敏度高、特异性强、成本低、快捷等优点,已经在多种真菌检测中得到应用.多重PCR应用于疫霉菌检测以来,在特异性和灵敏度等方面该技术较常规方法有很大的优势,检测时间短,且快速准确,结果分析简单,对待检样品要求不高.多重PCR技术实现了对多种菌的同步检测,更加节约时间和成本,成为口岸快速检测技术的重要研究方向. Li等[17]根据烟草疫霉P. Nicotianae的ITS基因和恶疫霉P. Cactorum的Ypt1基因分别设计其特异引物,建立了草莓上烟草疫霉和恶疫霉的三重PCR检测方法.本研究根据18S rRNA,ITS,HSP90和Ypt1基因序列,设计了疫霉属通用引物、冬生疫霉、丁香疫霉和栗黑水疫霉的特异性引物,建立了苹果属3种检疫性疫霉的四重PCR检测方法.
影响多重PCR反应体系的因素很多[18],本研究选择从通用引物浓度、特异引物浓度、退火温度、退火时间4个方面进行优化.引物是多重PCR反应的关键,18S rDNA基因为多拷贝基因,而Ypt1基因为单拷贝基因[16],引物对18SUF/18SUR的扩增效率高于PHSF/PHSR,同理18SUF/18SUR的扩增效率也高于PCSF/PCSR和PSSF/PSSR,所以引物对18SUF/18SUR用量少;三对特异引物特异性均良好;引物量的比例对扩增结果影响很大,可调节引物比例达最佳化.退火温度影响PCR体系扩增的特异性,在多重PCR体系中综合各个解链温度Tm,在Tm值允许范围内选择较高的复性温度以减少引物和模板间的非特异性结合,确保PCR反应的特异性[19].退火时间决定了解链是否完全,多重PCR反应中有多对引物,退火时间要根据引物的扩增效率而定,退火时间不宜过短,否则解链不完全;也不宜过长,否则引物对间的竞争导致扩增效率较低的引物反应不充分.另外,本研究所建立的多重PCR体系的灵敏性与单重PCR相比灵敏度降低,分析原因可能为多重PCR在反应体系中加入了多对引物,而引物彼此间会形成引物二聚体或错配,并且可能发生引物和非模板间的非特异性结合,导致引物的利用率很低,灵敏度下降[20].
本研究建立了苹果属植物上检疫性冬生疫霉、丁香疫霉和栗黑水疫霉的四重PCR同步检测方法.试验材料包含了侵染苹果属植株的11株疫霉菌,菌株收集齐全,4对引物扩增片段大小差异明显,便于琼脂糖凝胶电泳检测.模拟带菌试验表明可实现对带菌水果的直接检测,全部检测可在1 d内完成,可有效促进水果的快速通关.此方法特异性强、简便,节约时间和检测成本,为口岸检测及病原菌的田间监测提供了可靠的途径.




 下载:
下载: