-
量子点(quantum dots,QDs)作为一类性能优良的纳米材料被广泛运用于免疫分析、活体分析、蛋白质标记和DNA检测等纳米生物医学领域[1-5].当QDs进入生物体后,可能会与生物体内蛋白质结合,从而导致蛋白质的构象和功能发生重大变化[6-7].当QDs表面聚集大量蛋白质时,会引起蛋白质局部浓度过高,从而导致蛋白质活性发生变化,增加其聚集和纤维化出现的可能性,甚至加速纤维化[8-9].
朊蛋白(Prion Protein,PrP)是导致可传播的致死性神经退行性海绵状脑病(TSEs)的罪魁祸首,其致病机理是基于正常型的PrP发生错误折叠,α螺旋结构减少,β折叠结构增加,形成富含β-片层的抗蛋白酶水解的致病型PrP[10-11].由于致病型PrP有强烈的聚集倾向,会逐渐形成淀粉样纤维和淀粉样斑块,最终发展为可被临床诊断的大脑海绵状退化变性疾病[12-13].
本研究以巯基乙酸为修饰剂,合成了荧光性能良好的水溶性CdTe QDs,并从表达PrP的大肠杆菌体内提取纯化了重组型PrP(rPrP).其次,以CdTe QDs和rPrP的相互作用体系为研究模型,通过紫外-可见吸收光谱、荧光光谱、荧光倒置显微镜成像以及硫磺素T(ThT)和刚果红(Congo Red)检测蛋白质纤维化等技术,对二者相互作用过程中rPrP诱导的CdTe QDs聚集和CdTe QDs对rPrP纤维化的影响进行了研究.
全文HTML
-
仪器:NU-201-430E超净工作台(美国NUAIRE公司);手提式不锈钢蒸汽消毒器(上海三申医疗器械有限公司);pHS-4C型酸度计(成都方舟科技开发公司);LRH-250-Z振荡培养箱(常州澳华仪器有限公司);Z383K高速台式冷冻离心机(德国HERMLE公司);Y92-IIN超声波细胞粉碎机(宁波新芝生物科技股份有限公司);JB-3定时恒温磁力搅拌器(金坛市富华仪器有限公司);砂芯过滤装置(上海申迪玻璃仪器有限公司);HL-2恒流泵(上海青浦沪西仪器厂);镍柱(上海华美实验仪器厂);PY-120水平脱色摇床(北京鼎国生物科技有限公司);UV-2450紫外-可见分光光度计(日本岛津公司);F-4500型荧光分光光度计(日本日立公司);OLYMPUSix70倒置式系统显微镜(奥林巴斯公司);电子倍增型冷CCD系统(ANDOR公司);JEOL 2010透射电子显微镜(日本电子株式会社).
试剂:表达rPrP的大肠杆菌菌种(武汉大学病毒学国家重点实验室肖庚富教授赠送);CdCl2·2.5H2O(成都化学试剂厂);碲粉(国药集团化学试剂有限公司);巯基乙酸(上海强顺化学试剂有限公司);硫磺素T(比利时ACROS ORGANICS公司);刚果红(北京鼎国生物技术有限责任公司).纯化rPrP所需试剂(Genview公司).其他试剂均为国产市售分析纯,整个实验过程用水均为18.2 MΩ的超纯水(Milli-Q-Plus系统所制).
-
以巯基乙酸修饰的CdTe QDs的制备方法见文献[14].
-
从表达rPrP的大肠杆菌菌种中提取和纯化rPrP的方法见文献[14],得到的rPrP的浓度通过Bradlrord蛋白定量试剂盒测定,于4 ℃保存.
-
在pH=7.0的PBS缓冲溶液中加入1.0×10-6 mol/L的CdTe QDs溶液,然后加入320 nmol/L rPrP.分别取加入rPrP前后的CdTe QDs溶液10 μL滴在盖玻片中央,置于荧光显微镜载物台上,使用OLYMPUS 100×油浸物镜(数值孔径为1.3),U-MWB2滤光片(460-490/500/520 nm)进行观察,并且选择适当视野使用Canon PowerShot A630照相机拍下CdTe QDs溶液加入rPrP前后的荧光显微镜成像.
-
在pH=7.0的PBS缓冲溶液中加入1.0×10-6 mol/L的CdTe QDs溶液,然后加入320 nmol/L rPrP,10 000 r/min(离心半径为8.5 cm)离心10 min后,采用UV-2450紫外-可见分光光度计分别测定离心后的CdTe QDs溶液和加入rPrP的CdTe QDs溶液的紫外-可见吸收光谱.
-
在pH=7.0的PBS缓冲溶液中加入1.0×10-6 mol/L的CdTe QDs溶液,然后加入320 nmol/L rPrP,采用F-4500型荧光分光光度计分别测定CdTe QDs溶液和加入rPrP后的CdTe QDs溶液的荧光光谱.荧光激发波长为360 nm,激发和发射狭缝宽度均为5 nm.
-
配制1 mmol/L的ThT储备液4 ℃避光保存,使用时稀释至30 μmol/L.采用F-4500型荧光分光光度计测定rPrP和rPrP-QDs溶液40 ℃孵育4 h后引起的ThT荧光的变化.荧光激发波长为440 nm,激发和发射狭缝宽度均为10 nm.
-
配制50 μmol/L的Congo Red储备液4 ℃避光保存,使用时稀释至10 μmol/L.采用UV-2450紫外-可见分光光度计测定rPrP和rPrP-QDs溶液40 ℃孵育4 h后引起的Congo Red紫外-可见吸收光谱的变化.
1.1. 仪器与试剂
1.2. 实验方法
1.2.1. CdTe QDs的制备
1.2.2. rPrP的提取及纯化
1.2.3. CdTe QDs溶液加入rPrP前后的荧光显微镜成像
1.2.4. CdTe QDs溶液加入rPrP前后的紫外-可见吸收光谱的测定
1.2.5. CdTe QDs溶液加入rPrP前后的荧光光谱的测定
1.2.6. ThT测定CdTe QDs和rPrP混合物的纤维化程度
1.2.7. Congo Red测定CdTe QDs和rPrP混合物的纤维化程度
-
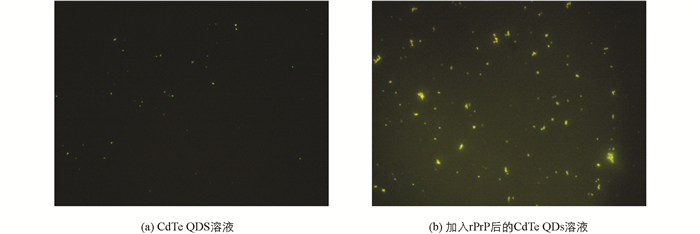
在荧光显微镜下可以观察到,CdTe QDs溶液呈现较明亮的绿色荧光,且大部分粒子独立存在,均匀分散于溶液中;而加入rPrP后的CdTe QDs溶液中出现很多由多个CdTe QDs组成的聚集体,呈现很强的荧光,且由于聚集后颗粒之间距离的缩短和偶极相互作用,部分较大的团聚体呈现橙色荧光(图 1).这表明,加入rPrP后,CdTe QDs可能发生了聚集.
-
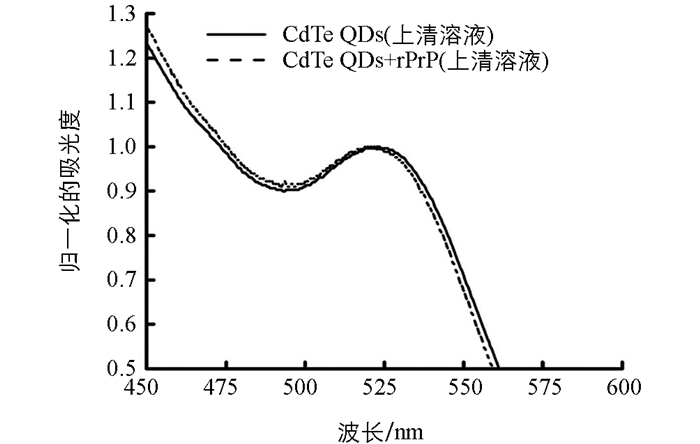
为了进一步证实加入rPrP后的CdTe QDs发生聚集的现象,按照1.2.4的实验条件,分别检测了离心后的CdTe QDs上清溶液和离心后的加入rPrP的CdTe QDs上清溶液的紫外-可见吸收光谱.结果发现,CdTe QDs上清溶液的紫外-可见吸收光谱的最大吸收波长在523 nm,而加入rPrP后的CdTe QDs上清溶液的紫外-可见吸收光谱的最大吸收波长在519.5 nm,即蓝移3.5 nm(图 2).
这表明,尽管本研究所合成的CdTe QDs粒径较均匀,但其中仍然含有一系列粒径不同的CdTe QDs,且粒径较大的CdTe QDs的最大吸收波长比粒径较小的CdTe QDs的最大吸收波长长.当加入rPrP后,部分粒径较大的CdTe QDs会优先发生聚集,形成粒径更大的聚集体,经10 000 r/min(离心半径为8.5 cm)离心10 min后沉淀.因此,在加入rPrP后的CdTe QD上清溶液中,由于除去了部分粒径较大的CdTe QDs,因而最大吸收波长会较CdTe QDs上清溶液发生蓝移.
-
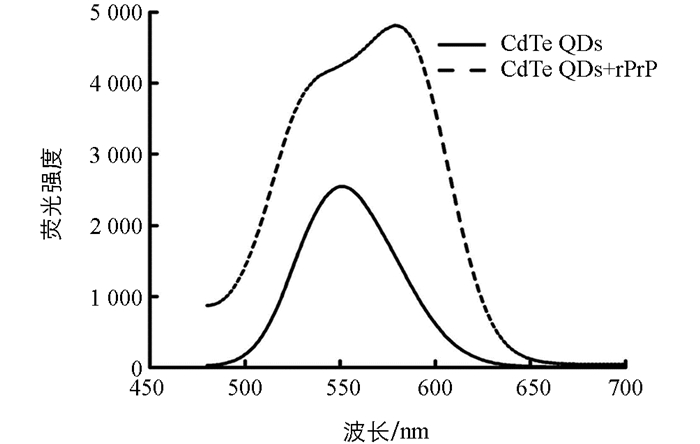
按1.2.5的实验条件,分别检测了CdTe QDs溶液和加入rPrP后的CdTe QDs溶液的荧光光谱.结果发现,CdTe QDs溶液的荧光光谱窄而对称,荧光最大发射波长在551 nm处;而加入rPrP后,溶液的荧光强度显著增强,荧光光谱转变为宽而连续的两个峰,且荧光最大发射波长红移至580 nm(图 3).
溶液荧光光谱的变化可能是由于rPrP的加入使得部分CdTe QDs颗粒之间的距离缩短,偶极-偶极相互作用增强,荧光最大发射波长比单独的CdTe QDs荧光最大发射波长长[15].因此,当聚集体的荧光峰与单独的CdTe QDs的荧光峰叠加在一起时,就形成了宽而连续的两个峰.而溶液荧光强度的增强可能是由于rPrP将CdTe QDs表面包覆,一方面钝化了CdTe QDs表面,有效去除了CdTe QDs表面缺陷,从而使得CdTe QDs荧光增强;另一方面通过rPrP的包覆使CdTe QDs不易受外界条件干扰,自身荧光得到保护,因而荧光强度增强[16-17].
-
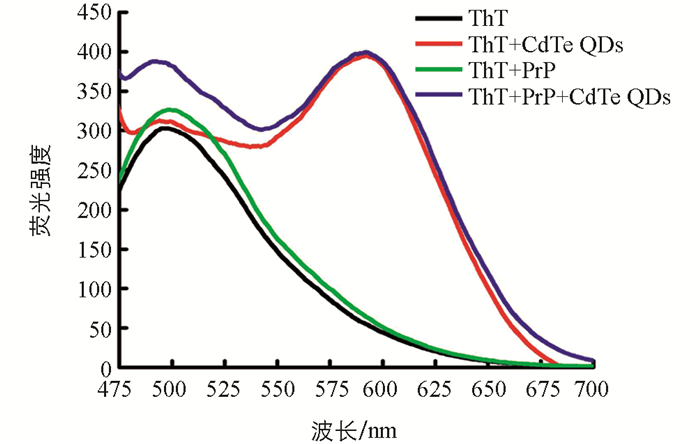
ThT被广泛运用于检测纤维中β折叠结构的存在,通过检测ThT荧光强度的变化可以判断纤维结构的变化.由于黄绿色发射的CdTe QDs(λem=551 nm)的荧光光谱与ThT的荧光光谱有部分重合,会干扰ThT荧光强度的测定,故使用同浓度的红色发射的CdTe QDs(λem=591 nm)与rPrP相互作用.
研究发现,与CdTe QDs溶液混合后,ThT的荧光强度几乎没有发生变化;与rPrP混合后,ThT的荧光强度略有增强;而当与rPrP-QDs混合溶液混合后,ThT的荧光强度有明显增强.这表明,在没有CdTe QDs存在下,rPrP在pH=7.0的PBS缓冲溶液中40 ℃孵育4 h后已经开始纤维化,但因纤维化程度较低,引起ThT荧光强度的变化不明显;而将CdTe QDs加入到rPrP溶液中混合孵育后,由于CdTe QDs大的表面区域为rPrP纤维化过程中最关键的成核作用提供了平台,使得rPrP很快在CdTe QDs表面聚集,加速了rPrP纤维化进程,使得ThT荧光有较明显增强[18](图 4).
-
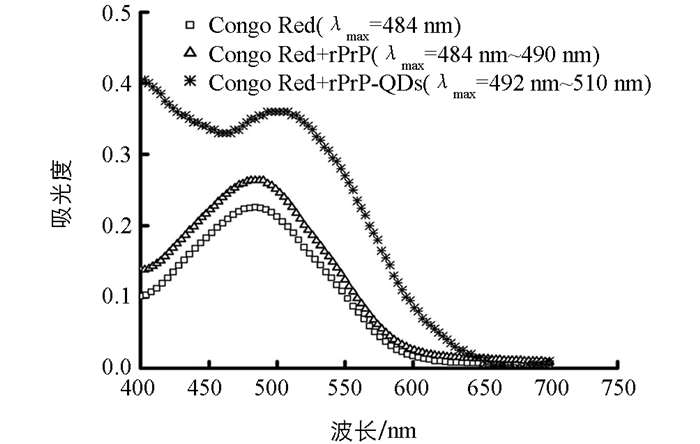
Congo Red溶液紫外-可见吸收光谱的最大吸收波长为484 nm,当加入rPrP孵育4 h后,溶液吸光度最大的波长范围变为484~490 nm;而当加入rPrP-QDs混合溶液孵育4 h后,溶液的紫外-可见吸收光谱发生红移,且溶液吸光度最大的波长范围为492~510 nm.这表明,在没有CdTe QDs存在时,单纯的rPrP纤维化程度较低,由于Congo Red检测纤维化的灵敏度没有ThT高,少量的纤维化只能引起Congo Red最大吸收波长范围变宽,而不能引起Congo Red紫外-可见吸收光谱红移;而当加入一定量的CdTe QDs后,由于CdTe QDs加速了rPrP的纤维化,体系中产生了较多的rPrP纤维,导致rPrP纤维与Congo Red之间发生明显相互作用,引起Congo Red的π电子体系扩展以及发生构象变化,从而导致紫外-可见吸收光谱的红移[19](图 5).
-
rPrP的等电点是10,在pH=7.0溶液中,带正电荷的rPrP和带负电荷的巯基乙酸修饰的CdTe QDs之间存在静电作用[20-21]. Vanik等人研究发现,rPrP自身不稳定,即使在生理缓冲条件下也会形成一些纤维状结构的低聚物和一些无规则的聚集体[22]. Wu等还发现纳米粒子可以显著增强蛋白质纤维化或纤维形成的速率[23].因此,CdTe QDs和rPrP之间相互作用机理可能是二者通过静电作用先形成低聚物结构.这种低聚物作为“种子”,能够吸引溶液中游离的CdTe QDs继续吸附在其外层,形成更大的聚集体.在聚集过程中,CdTe QDs间距离缩短,发生聚集;而rPrP则聚集形成纤维和淀粉样斑块.
2.1. rPrP诱导的CdTe QDs聚集
2.1.1. 荧光显微镜成像
2.1.2. 紫外-可见吸收光谱的变化
2.1.3. 荧光光谱的变化
2.2. CdTe QDs对rPrP纤维化的影响
2.2.1. ThT检测CdTe QDs对rPrP纤维化的影响
2.2.2. Congo Red检测CdTe QDs对rPrP纤维化的影响
2.2.3. CdTe QDs和rPrP之间相互作用机理
-
以巯基乙酸修饰的CdTe QDs与rPrP相互作用,发现rPrP的存在会导致CdTe QDs发生聚集,引起CdTe QDs荧光颜色、紫外-可见吸收光谱和荧光光谱发生改变.与此同时,CdTe QDs还会加速rPrP的纤维化,引起ThT荧光明显增强和Congo Red紫外-可见吸收光谱红移.



 下载:
下载: