-
魔芋,别名蒟蒻、花杆莲、花杆南星等,属天南星科(Araceae)魔芋属(Amorphophallus blume)多年生宿根草本植物[1].自播种起,花魔芋需经4年,白魔芋经3年,顶芽才可能分化为花芽,完成生活周期.魔芋由营养生长向生殖生长的转化与植株的生理变化特别是与内源激素的关系既密切又较复杂,目前尚未见魔芋成花与激素关系的相关研究[1].魔芋花为佛焰花,佛焰花由佛焰苞、肉穗花序和花葶等组成.佛焰苞为宽卵形或长圆形,不同种的魔芋花色和花形有很大的差异.肉穗花序直立,长于或短于佛焰苞,下部为雌花序,上接能育雄花序,最上为附属器,个别种在能育雄花序之下有一段中性花序.魔芋的花为雌花先熟型,雌花比雄花早熟2~3日,且雌花受精的时间短,同株的雄花开花时,雌花已不能授粉受精.因此,若只有一株开花,便不能获得“种子”,但若有多株同时同地开花,由于各株开花时间有先有后,便可能异株授粉受精而获得“种子”.因此,研究雌、雄蕊成熟过程中内源激素的动态变化可以为今后的生产实践提供理论指导.
植物内源激素是由植物自身代谢产生的一类有机物质,并从产生部位移动到作用部位,在极低浓度下就有明显生理效应的微量物质.激素含量一般仅占组织鲜质量的10-9~10-7左右[2].通过对植物激素的研究,有助于了解植物生长发育的基本规律,不同类型激素间的平衡状况比单独一两种激素的作用更为重要[3-6].测定激素的方法有很多种:有早期的小麦胚芽鞘切段伸长法[7]、高效液相色谱法(HPLC)[8]、高效液相色谱—质谱法(HPLC-MS)[9-10]、气相色谱法(GC)[11-12]、色谱-质谱联用法(GC-MS)[13]和酶联免疫测定法(ELISA)[14].其中酶联免疫吸附法(ELISA)具有前处理简便、测定快捷、灵敏度好和特异性高等特点,适用于大批量样品的测定,因此广泛应用于植物激素的研究测定(除Eth外)[15-16].酶联免疫吸附法(ELISA)测定植物内源激素已有许多报道[17-19],但魔芋开花过程中内源激素的测定尚属首次.本实验对魔芋雄、雌蕊中内源激素进行了测定,以了解开花过程中各激素含量的变化以及激素平衡对雄蕊和雌蕊成熟时间的影响.
全文HTML
-
供试材料为生长3~4年带花芽的生长健康白魔芋.于2017年4月20日栽种于歇马魔芋资源圃,株间距为25~30㎝,栽种后浇透水,搭棚覆盖,以保证其正常生长.
-
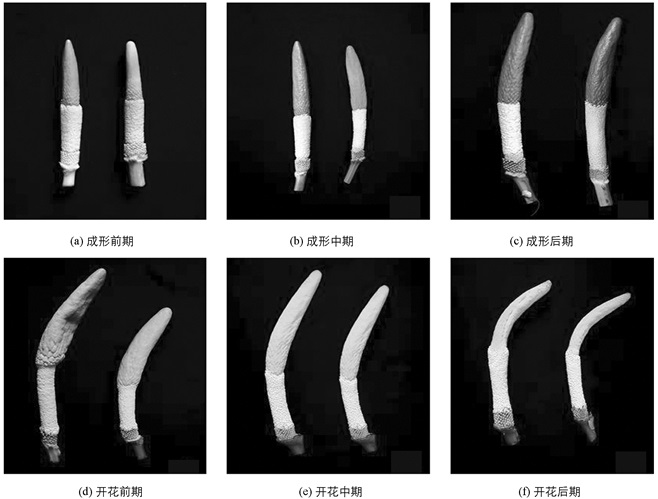
本实验于2017年4月20日~6月20日在歇马魔芋资源圃和蔬菜实验室完成.在魔芋花芽成形前、中、后期分别进行第1次、第2次、第3次取材,开花前、中、后各取材一次(图 1),实验共取材6次,所取试材迅速用液氮固定,保存于-80 ℃冰箱中,待所有材料取材结束后,进行激素的提取和测定.
-
内源激素参照何钟佩等[20-21]的提取方法,准确称取魔芋雄蕊、雌蕊各1 g,在所称样品中加入4 mL 80%(内含少量pvpp)的甲醇提取液,在液氮中研成粉末,转入10 mL试管中,再用2 mL提取液分次将研钵冲洗干净,一并转入试管中,混匀后密封置4 ℃条件下浸提4 h,浸提完全后在4 ℃,3 500 r/min转速下离心15 min,取上清液,剩余沉淀加2 mL提取液混匀,于4 ℃条件下再提取1 h后离心并合并上清液.上清液过C18柱进行萃取,收集过柱液后进行真空干燥,去除提取液中的甲醇,用样品稀释液定容至1 mL,充分混匀后4 ℃离心,所得上清液即为内源激素提取液.试剂盒由上海优选生物科技有限公司提供.具体操作步骤按说明书进行.每个样品均重复3次,激素量以质量比(单位为ng/g)表示.
1.1. 实验材料
1.2. 实验方法
1.2.1. 实验取材
1.2.2. 样品中内源激素的提取与测定
-
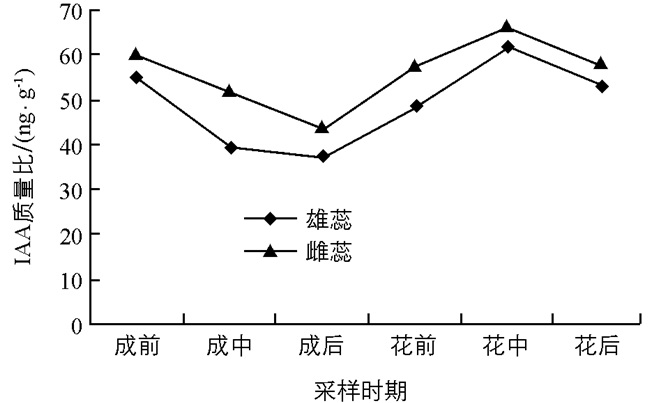
由图 2可以看出,魔芋在整个开花过程中,雌蕊和雄蕊中内源IAA的变化动态是相同的,均为下降—上升—下降.花芽成形后期(花芽完成生理分化之后),即佛焰苞完全成形但未展开之前,内源IAA质量比降到最低值,雌蕊和雄蕊中的质量比分别为44 ng/g和39 ng/g,较花芽成形前期(花芽成形萌发出土时期)降低了26.7%和30.4%;形态分化结束后,IAA的质量比开始增加,在花中期(魔芋花散粉时期,也是魔芋花形态分化完成期)达到最大值,分别达到66 ng/g和62 ng/g.但分化过程中雌蕊IAA水平总是高于雄蕊.佛焰苞展开后雌蕊、雄蕊开始成熟,散粉时雄蕊已经完全成熟,但因雌蕊先于雄蕊成熟,所以授粉效率不高[1].
-
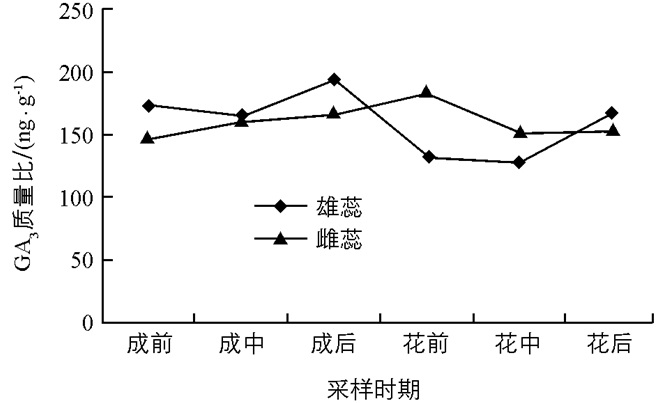
由图 3可以看出,魔芋在整个开花过程中雌蕊和雄蕊中GA3质量比的大体变化趋势均呈现上升—下降,雄蕊中的内源GA3含量在佛焰苞成形后期,即花芽生理分化完成时达到最大值,约为195 ng/g,而雌蕊中GA3的质量比在佛焰苞展开前期达到最大值,约为188 ng/g,较花芽成形前期增加了12.8%和20.7%.佛焰苞展开的前期和中期是雌、雄蕊成熟的关键时期,但雌蕊中GA3的质量比比雄蕊中高17.1%~44.6%,因此GA3可能是影响雄蕊晚熟于雌蕊的主要原因之一.
-
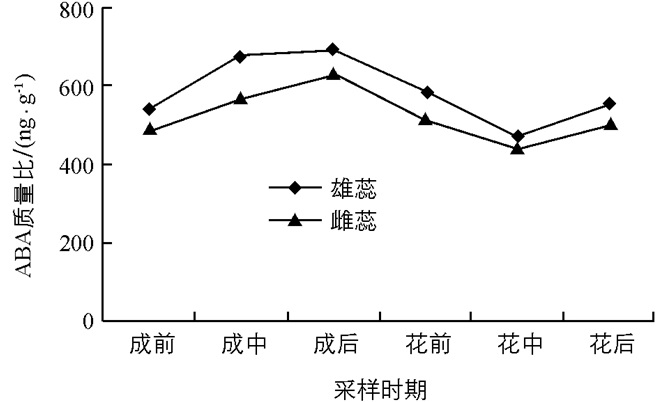
由图 4可以看出,在魔芋开花整个过程中内源ABA的质量比显著高于其他3种内源激素.在整个过程中,雌蕊和雄蕊中ABA的水平变化趋势是相同的,均为上升—下降—上升的趋势,这一变化规律正好与IAA的变化规律相反.在佛焰苞成形后期,即花芽生理分化完成时ABA的质量比达到最大值,雄蕊和雌蕊的ABA质量比均为690 ng/g和640 ng/g,较花芽成形前期增加了27.8%和30.6%,雄蕊散粉之后ABA的质量比达到最低值,分别降低了11.1%和10.2%. ABA是魔芋整个开花过程中雄蕊质量比高于雌蕊质量比的唯一内源激素,在雌、雄蕊形态分化过程中,ABA可能起到了抑制分化的作用,因为雌蕊的ABA质量比相对低,所以受到的抑制效果小于雄蕊,因而比雄蕊早熟.
-
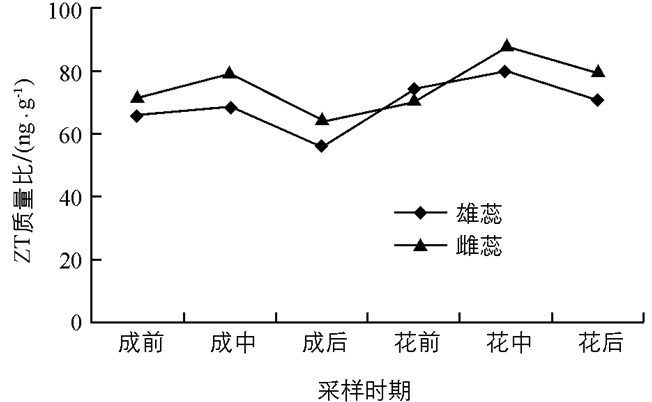
由图 5可以看出,开花过程中雌蕊和雄蕊中ZT的动态变化相似,均为先升后降再升再降,呈现出“M”型的变化趋势,在整个变化过程出现过两次变化峰值,分别是佛焰苞成形中期和佛焰苞展开中期(雄蕊散粉期),两个时期雌、雄蕊中ZT的质量比约为80 ng/g,69 ng/g和89 ng/g,80 ng/g,较花芽成形前期增加了12.7%,4.5%和25.3%,21.2%,花芽成形后期降到最低值,雄蕊的约为55 ng/g,雌蕊的约为64 ng/g,降低了16.7%和9.9%.该变化趋势表明ZT在花芽的生理分化期和形态分化期都起到了一定的促进作用,但对形态分化期的持续时间长,影响较大.
-
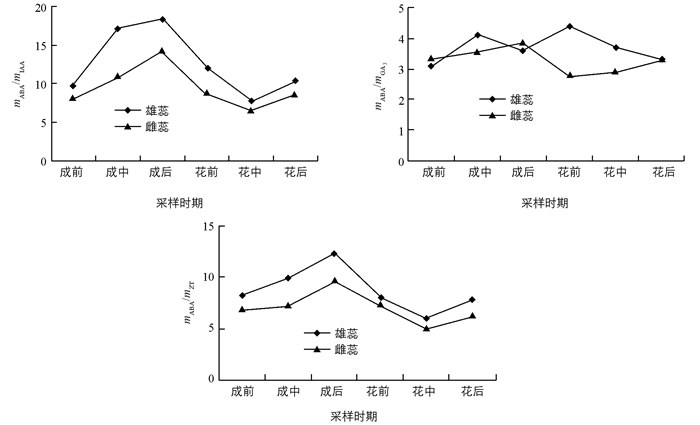
基于ABA与IAA,GA3,ZT在白魔芋开花过程中雌、雄蕊起着相反的调节作用,研究了mABA/mIAA,mABA/mGA3,mABA/mZT 3组比值的动态变化.由图 6可以看出,激素的平衡关系也对花芽分化过程起着重要的调节作用.其中ABA/IAA比值的变化趋势和ABA/ZT的比值变化趋势一致,并且这两组的比值整体趋势和ABA质量比的变化趋势也是相同的,由此可以看出,ABA不论在花芽的生理分化期还是形态分化期,都起着关键的调节作用,在3组比值关系中,雄蕊的比值关系始终大于雌蕊的比值关系,而在实际情况中雄蕊的成熟晚于雌蕊,这就更加证明了高浓度的ABA对花芽的成熟起到抑制作用,即高浓度的ABA抑制白魔芋的形态分化. ABA/GA3的比值关系可以看出,ABA/GA3的比值高时促进白魔芋花芽的生理分化,比值低时促进白魔芋花芽的形态分化,进一步证明了高浓度的GA3对雌蕊的成熟起到促进作用.由此可见,白魔芋开花过程不仅与各内源激素的含量有关,还与各激素间的平衡关系有密切的关系.
2.1. 白魔芋开花过程中雌、雄蕊内源IAA质量比的变化
2.2. 白魔芋开花过程中雌、雄蕊内源GA3质量比的变化
2.3. 白魔芋开花过程中雌、雄蕊内源ABA质量比的变化
2.4. 白魔芋开花过程中雌、雄蕊内源ZT质量比的变化
2.5. 白魔芋开花过程中雌、雄蕊内源激素质量比比值的变化规律
-
IAA的调节作用在前人的研究中一直有争议.一种观点认为:IAA是花芽分化过程中的抑制因子,如蔡坤秀等[22]发现,叶底红从营养生长进入花芽分化阶段后IAA的质量比急剧下降,且在整个花芽分化过程中都出现小幅度下降趋势;吕一帆等[23]发现,水仙花芽分化中IAA的质量比越低,花芽分化速度越快,说明IAA在花芽分化中起抑制作用.另一种观点认为IAA在花芽分化中起促进作用,这与对苹果[24]、银杏[25]的研究结果一致.还有一种说法认为,IAA可能在促花和抑花两个方面起作用,根本上取决于具体的时期和相应的质量比[26].本研究结果显示,低水平的IAA有利于花芽的生理分化,高水平的IAA有利于花芽的形态分化.这与王磊等[27]的研究结果一致. GA3在花芽分化中所起的作用因不同植物而异.有一些研究表明,GA3会抑制多种果树的花芽分化[28-29],也有一些研究者在毛竹[30]、大白菜[31]和小麦[32]的研究中得到了与此相反的结果.本研究结果显示,在雌、雄蕊成熟的关键期,GA3都呈现出下降的趋势,但雌蕊的GA3质量比明显高于雄蕊,而雌蕊在生长过程中成熟较早,这表明GA3可能是影响雄蕊晚熟于雌蕊的关键因素之一,在这一过程中GA3起到促进花芽分化的作用.这与后者得到的结论相同,即高浓度的GA3对花芽分化起促进作用. ZR是细胞分裂素CTK的一种,实验结果表明ZT在生理分化和形态分化中都起到重要的调节作用,开花过程中总共出现两次峰值,分别在花芽成形中期和佛焰苞展开中期(雄蕊散粉期),两个时期雌、雄蕊中内源ZT的质量比约为80 ng/g,69 ng/g和89 ng/g,80 ng/g.相比较而言,ZT在魔芋开花过程中对形态分化的影响期较长(从成形后期持续到开花散粉),影响较大,且高质量比的ZT可能对雌蕊的早熟现象有一定程度的影响.这与大多数研究者所得的ZT促进花芽分化的结果相符[33-34].在前人研究花芽分化时期脱落酸(ABA)的动态变化时,对ABA和花芽分化的关系认识也不同.曾骧[35]认为ABA在花芽分化中具有双重作用:一方面是促进作用,因为ABA与GA3产生拮抗作用,使得淀粉和糖积累,有利于花芽分化的进行;另一方面是因为ABA是诱导休眠的关键因子,因而对花芽分化有抑制作用.本实验的研究结果表明,ABA是魔芋开花全过程中在雄蕊中的质量比高于在雌蕊中的质量比的唯一内源激素,在雌、雄蕊形态分化过程中,ABA可能起到了抑制分化的作用,因为雌蕊的ABA质量比相对低,所以受到的抑制效果小于雄蕊,因而比雄蕊早熟.
通过上述分析可得,在雌蕊和雄蕊的成熟过程中,IAA,GA3和ZT起到了相同的生理作用,较高质量比的IAA,GA3和ZT有利于雌蕊的成熟.而ABA的生理作用异于其他3种激素,在形态分化过程中,雄蕊的ABA质量比始终高于雌蕊,但雄蕊却晚熟于雌蕊,因而推测高浓度的ABA对雄蕊的成熟有一定的抑制作用.
-
花芽分化是一个复杂的过程,这一过程受到多种因素的影响,其中激素含量对花芽分化起着至关重要的作用,这一过程不仅取决于单一的激素含量,更是与激素之间的动态平衡有着密切的关系[36-37].这种平衡关系相互制约又相互促进,正是这种平衡关系控制着各种营养物质的代谢,从而对花芽分化进行调控[38].综合分析白魔芋在开花过程中各激素的质量比及激素平衡关系的动态变化可以得出,ABA和GA3在雌蕊和雄蕊成熟的过程中起到尤为关键的作用,二者在这一过程中起着相反的作用,而IAA,ZT与ABA,GA3的平衡关系也一起调控着魔芋雌、雄蕊的成熟分化.



 下载:
下载: