-
烟草赤星病严重影响烟草品质和产量,给世界烟草产业带来巨大经济损失[1].长期使用化学药剂防治会引起环境污染、农药残留、抗药性等问题;生物防治虽无毒无害无污染,但其作用缓慢、稳定性差、易受外界环境影响等缺点成为开发的难点,因此研究烟草的抗病性和选育抗赤星病烟草品种是防治该病最经济有效的途径[2-3].有研究发现烟草中一些酶类如超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)、β-1,3葡聚糖酶(GLU)、几丁质酶(CHT)与烟草的抗病反应密切相关[4].为进一步明确烟草感染赤星病后体内防御酶活性变化与烟草抗病性的关系,本研究选取抗赤星病品种Beinhart1000-1、感赤星病品种K326和云烟87分别接种赤星病菌,在不同时间段测定7种酶活性并进行系统的比较和分析,以期为烟草赤星病的生理生化机制和烟草抗病性鉴定指标提供新的参考.
全文HTML
-
供试烟草品种为云烟87,K326,Beinhart1000-1,来自中国农业科学院烟草研究所.播种于温室花盆内,后移栽于温室,常规管理,当8~10片真叶完全展开时接种.实验地点为西南大学柑桔研究所综防实验室.
供试菌株为Alternaria tenuissima,来自重庆市巫溪烟草种植区典型赤星病烟草植株上分离纯化,经致病力鉴定和分子鉴定确认.病原菌在PDA培养基上25 ℃培养7d后待用.
BCA蛋白质定量试剂盒购自天根生化科技(北京)有限公司.几丁质酶(CHT)试剂盒、β-1,3葡聚糖酶(GLU)试剂盒、苯丙氨酸解氨酶(PAL)试剂盒、多酚氧化酶(PPO)试剂盒、过氧化物酶(POD)试剂盒、超氧化物歧化酶(SOD)试剂盒、过氧化氢酶(CAT)试剂盒购自苏州科铭生物技术有限公司.
-
在待测烟草品种植株下部叶片上针刺接种菌饼,每张叶片上接种1个菌饼,接种后25 ℃保湿培养,每天观察叶片受病菌侵染后情况.分别于接种后12 h,24 h,36 h,48 h,96 h,140 h,192 h,240 h取样,每次选取植株上部第一片完全展开的叶片,以同生育期同部位成熟叶片针刺接PDA培养基作空白对照.样品液氮速冻后-80 ℃保存备用.
-
按照各个酶活测定试剂盒说明书的要求,分别提取3个烟草品种不同时间段样品的粗酶液,-20 ℃保存备用.
按照BCA蛋白质定量试剂盒说明书步骤测量绘制标准曲线并测定3个烟草品种各时段样品的粗酶液在520nm处的吸光值,并根据标准曲线计算出各样品相应的蛋白浓度.
按照各个酶活测定试剂盒说明书步骤测定几丁质酶(CHT)、β-1,3葡聚糖酶(GLU)、苯丙氨酸解氨酶(PAL)、多酚氧化酶(PPO)、过氧化物酶(POD)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)7种酶在各相应波长处的吸光值.根据各酶试剂盒对应的酶活计算公式计算7种酶的酶活性,以未接菌的烟草叶片中的酶活为对照,计算接菌后的酶相对活性(酶相对活性=接菌后酶活性÷未接菌的酶活性),以起始点为对照作图.
-
采用SPSS 20.0软件对酶活数据进行分析,用Excel 2007进行数据计算和制图.
1.1. 供试材料
1.2. 实验方法
1.2.1. 症状观察及取样
1.2.2. 酶活测定
1.2.3. 统计分析
-
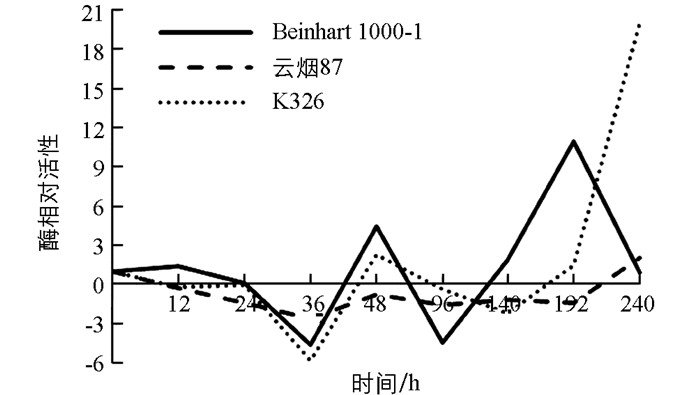
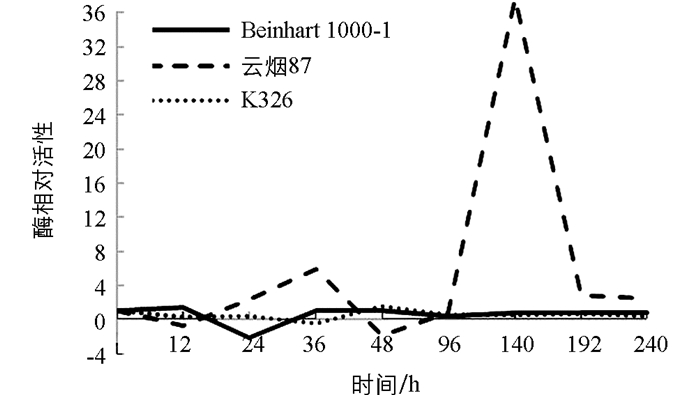
测定不同抗性烟草品种接种赤星病菌后其叶片内苯丙氨酸解氨酶(PAL)活性时发现,PAL活性在不同抗性烟草品种叶片中有明显差异(图 1). Beinhart1000-1品种PAL活性显著增高,接种36 h时PAL相对活性迅速升为10.49,以后快速下降,48 h时低于对照(起始点位),仅是对照的31.81%,96 h又回升与对照接近,其后PAL活性基本都低于对照;云烟87和K326品种接种后PAL活性都低于对照,K326在24 h时PAL相对活性升为1.79,96 h又回降与对照接近,以后又上升,在140 h时PAL活性为2.6,其后回降到与对照接近;云烟87在24 h时缓慢升至与对照接近,36 h时PAL相对活性升为1.76,以后下降,96 h时仅为对照的30.52%,其后回升到与对照接近.
-
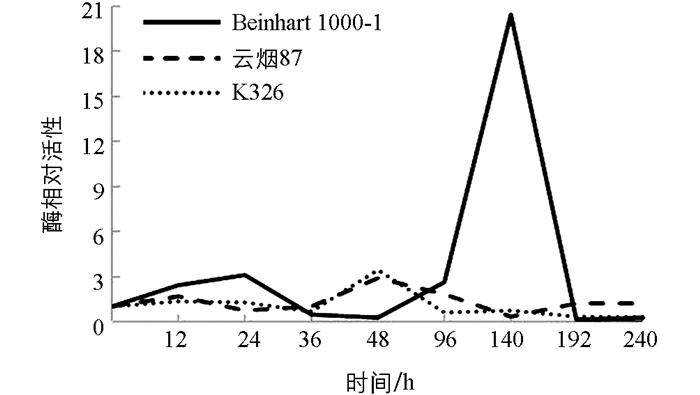
从图 2看出,Beinhart1000-1品种感染赤星病菌后PPO活性略有增高,接种12 h时PAL相对活性升为1.40,以后下降并低于对照,48 h时相对酶活性回升至4.44,以后又下降并低于对照,140 h时又开始上升,192 h时迅速升至10.96,其后又下降;云烟87和K326品种感染赤星病后36 h内PPO活性均降低,但各有差异,K326品种在36 h内PPO活性低于对照,48 h时升至2.31,以后下降并低于对照,192 h回升至与对照接近,240 h时相对活性迅速升至20.02;云烟87接种后在192 h内PPO活性都低于对照,其后缓慢上升,240 h时相对活性升至2.01.
-
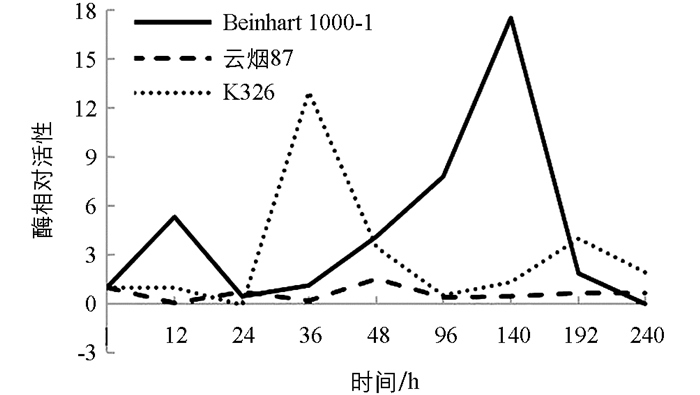
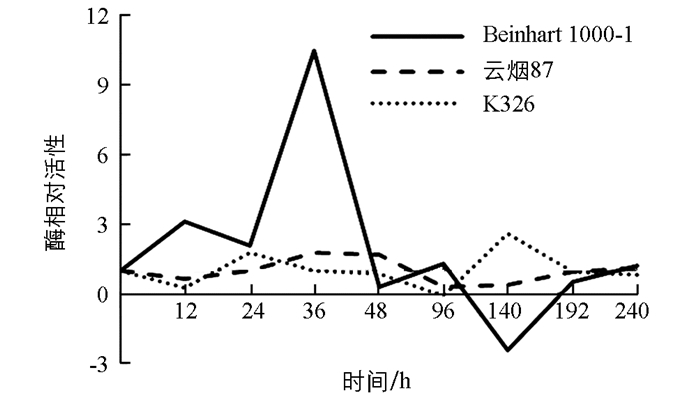
测定不同抗性烟草品种接种赤星病菌后其叶片内苯丙氨酸解氨酶(POD)活性时发现,PAL活性在不同抗性烟草品种叶片中有明显差异(图 3). Beinhart1000-1和K326品种感染赤星病后12 h内POD活性均上升,但幅度不同,Beinhart1000-1较K326上升明显,12 h时两者POD相对活性分别为5.31和1.02,其后均下降,Beinhart1000-1在36 h时又迅速上升,140 h时POD相对活性达17.51,以后又下降;K326在24 h后迅速上升,36 h时活性为13.02,随后下降,在192 h时又上升至4.03;云烟87叶片内POD活性变化不大,在各时期基本均低于对照.
-
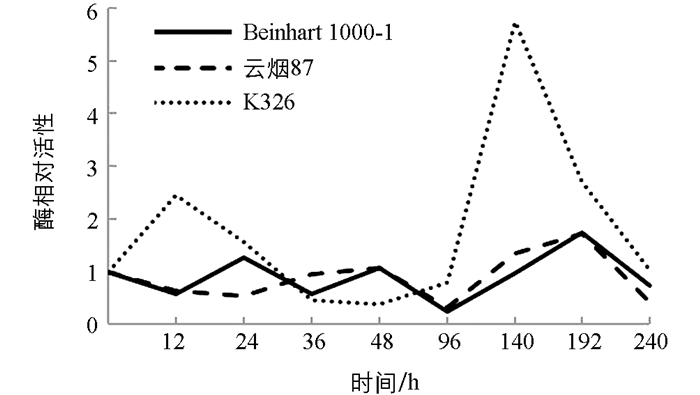
测定结果表明(图 4),接种赤星病菌后3种不同品种烟草叶片内CAT活性发生明显变化. K326品种在接种24 h内CAT活性升高,随后下降并低于对照,96 h时酶活性又开始迅速回升,在140 h上升至5.73,其后又下降;Beinhart1000-1和云烟87则相反,在140 h内其CAT活性基本都低于对照,140 h时开始缓慢上升,在192 h时酶相对活性分别上升至1.74,1.72,随后均下降.
-
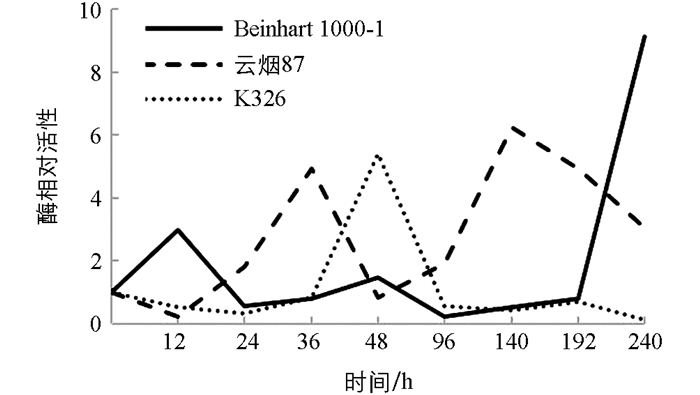
测定结果表明(图 5),接种赤星病菌后Beinhart1000-1在24 h内SOD活性升高,随后下降并低于对照,192 h时酶活性又开始迅速回升,在240 h时酶相对活性上升至9.14;云烟87和K326则相反,在12 h内活性均降低并低于对照,随后云烟87在24 h时SOD活性开始显著上升,在140 h时酶相对活性达到6.25;K326在36 h时SOD活性开始显著升高,48 h时酶相对活性达到5.40,随后快速下降,在96 h后活性均低于对照.
-
从图 6可以看出,Beinhart1000-1品种感染赤星病菌后CHT活性略有增高,12~36 h之间活性较对照低,随后回升至与对照接近;其他品种与Beinhart1000-1相反,在接种12 h内CHT活性降低,随后K326叶片内CHT活性保持相对稳定,与对照接近;云烟87在12 h后开始上升,在36 h时和140 h时CHT相对活性分别升至5.93和37.73,随后活性迅速降低.
-
从图 7可以看出,接种赤星病菌后3种不同品种烟草叶片内GLU在24 h内活性各有不同幅度的上升,其中Beinhart1000-1较其他品种上升快,在24 h和140 h时酶相对活性分别达3.15和20.47,但在36 h~48 h之间其活性下降并低于对照;云烟87和K326的GLU活性变化趋势相似,在36 h内波动不大并基本趋近对照值,随后上升,在48 h时酶相对活性分别升至2.92和3.45,随后缓慢下降至接近对照.
2.1. 苯丙氨酸解氨酶(PAL)活性变化
2.2. 多酚氧化酶(PPO)活性变化
2.3. 过氧化物酶(POD)活性变化
2.4. 过氧化氢酶(CAT)活性动态变化
2.5. 超氧化物歧化酶(SOD)活性变化
2.6. 几丁质酶(CHT)活性变化
2.7. β-1,3葡聚糖酶(GLU)活性变化
-
超氧化物歧化酶(SOD)、抗坏血酸过氧化物酶(APX)、过氧化物酶(POD)和过氧化氢酶(CAT)共同组成植物体内的有效活性氧清除系统,在植物机体防御体系中起重要作用[5-6].本实验中抗病品种Beinhart1000-1在接种赤星病菌后SOD,POD活性迅速升高并高于对照,感病品种云烟87接种后其SOD降低,24 h后快速上升,POD活性基本无变化;K326其SOD,POD活性均降低并基本低于对照,随后SOD和POD活性迅速上升,说明抗病品种在接菌后SOD,POD酶系统启动均比感病品种早,且活性也高于感病品种. Montalbini等[7]和匡传富等[8]也发现抗病烟草品种在接种病原物后SOD活性比感病品种高,且活性增长也明显大于感病品种;Joseph等[9]的研究结果也表明,抗病品种的POD活性较感病品种高,且在病原物侵染早期,其POD活性会迅速升高,与本文结果一致.另外接菌后CAT活性在Beinhart1000-1中基本低于对照;云烟87在CAT活性后期小幅度升高;K326在接种后CAT活性迅速升高,与吴元华等[10]研究结果一致.另外由接种赤星病菌后3种不同抗性烟草中SOD,POD,CAT 3种酶相对活性的变化可以发现,抗病品种Beinhart1000-1中活性氧清除组合系统为SOD+POD;感病品种云烟87为SOD+CAT;K326为SOD+POD+CAT,由此笔者推测在烟草抗病性反应过程中,SOD酶体系是基础的ROS清除系统,POD酶体系比SOD酶防御系统清除能力强,而CAT酶体系则是SOD和POD的“加强版”酶防御系统. SOD和POD早期(0~12 h)的活性与烟草品种抗赤星病呈正相关,CAT活性与烟草的抗病性呈负相关,CAT与SOD和POD早期(0~12 h)的活性高低可以作为烟草对赤星病菌抗性鉴定的指标.
苯丙氨酸解氨酶(PAL)是催化苯丙烷类代谢途径第一步反应酶,也是该代谢途径的关键酶和限速酶,在它的催化下苯丙烷类生成反式肉桂酸并进一步转化为类黄酮、木质素等次生代谢产物,因此被看成是植保工程的关键防御酶[11-12].研究发现,许多植物在遭受外部伤害时,植物的防卫系统特别是苯丙烷类代谢被激活,PAL活性迅速上升,因此PAL活性可以作为植物抗逆境能力的一个生理指标[13].在本研究中,抗病品种Beinhart1000-1在接种后PAL酶活迅速升高,并维持在较高水平,随后下降,说明植株细胞在受到病原菌刺激后启动PAL酶系统产生木质素并沉积在细胞壁周围,阻止病原菌进一步扩散.感病品种云烟87和K326在接种后都比对照PAL酶活性低,随后小幅度的升高,可能是由于感病品种对病原菌的侵入反应迟钝,PAL活性变化较慢,生成的木质素少,对病原菌的阻止力度不大,从而表现为感病.陈学平等[14]研究发现,在感染TMV后,具有SAR抗性的烟草品种对TMV表现出较高的敏感性,且抗病品种PAL活性明显高于感病品种,与本文结果一致;刘学敏等[15]也发现接种赤星病菌后,抗病品种CV87的PAL活性升高,感病品种NC89的PAL活性降低,与本文结果一致.因此在寄主植物抗病性反应过程中,PAL活性与烟草抗赤星病正相关,PAL活性变化可以作为烟草对赤星病菌抗性鉴定的指标.
在本研究中,抗病品种Beinhart1000-1在接种后PPO酶相对活性变化曲线有3个峰值,且升高幅度逐渐增大;感病品种云烟87和K326在接种后叶片中PPO基本低于对照,且活性变化不大. Beinhart1000-1中PPO活性总的变化趋势大于感病品种,PPO活性与烟草病程反应呈正相关.邹芳斌等[16]研究苗期感染枯萎病菌发现,高抗品系PPO活性值迅速上升,中抗、低抗品系PPO活性值变化不大,而高感、中感品系PPO活性值迅速下降,与本文结果大致相同;魏相峰等[17]在不同抗性烟草品种感染Pseudomonas syringae pv.tabaci病菌后也发现抗病品种PPO活性高于感病品种,并认为PPO活性的变化与品种抗疫病性表现呈正相关.分析认为赤星病菌侵染能诱导烟草体内PPO活性升高,促进大量积累酚类化合物,而酚类化合物是细胞形成木质素的前提,能促进细胞壁和组织的木质化以抵抗病原菌侵染,另外酚类化合物还能形成醌,醌的次生反应所产生黑色素的痂还阻止感染扩散[18].感病品种K326中PPO活性与抗病品种Beinhart1000-1相差较大,这可能是K326易感赤星病的原因之一.
很多植物病原真菌细胞壁的主要成分为葡聚糖和几丁质,而植物体内β-1,3葡聚糖酶(GLU)、几丁质酶(CHT)能够降解病原菌细胞壁,抵抗病原菌的侵染和抑制病原菌生长,因此两种酶活性的提高是植物抗逆性增强的很好体现[19-20].左豫虎等[21]用不同抗性大豆接种疫霉菌后发现GLU和CHT活性均上升,且抗病品种的酶活性高峰比感病品种出现时间早,维持时间长,并认为大豆对大豆疫霉根腐病的抗性与GLU和CHT的活性呈正相关.本研究中,3种不同抗性烟草品种在接种赤星病菌后,其叶片内GLU活性基本都高于对照值,但Beinhart1000-1升高幅度明显大于云烟87和K326;对于CHT,云烟87在后期升高幅度较大,Beinhart1000-1和K326两个品种CHT活性基本都接近对照,变化很小.这可能是因为在抗病品种Beinhart1000-1中,病原菌侵入主要诱导GLU酶体系产生抗病反应,而云烟87中主要诱导CHT酶体系产生抗病反应,且两者在抗病反应中都有两个峰值,这可能是由于在接种初期,两种不同抗性烟草中的两种酶分别有效阻止了病原菌的入侵,水解赤星病菌细胞壁,抑制病菌生长,同时酶解后病原菌的细胞壁破碎物又可作为激发子再次刺激植物产生抗病防卫反应,导致酶活性又一次升高.感病品种K326两种酶相对活性基本无变化,与Beinhart1000-1和云烟87相比相差较大,对赤星病菌抵抗能力差,这可能是发病原因之一.



 下载:
下载: