-
氧化应激损伤指在内外因素的刺激下机体内部氧化和抗氧化系统的平衡被破坏,或是过量摄入外源性氧化剂导致活性氧自由基(Reactive Oxygen Species,ROS)大量产生和积累,使机体氧代谢平衡无法维持而导致的一系列机体损伤[1-2]. ROS攻击的主要靶分子包括线粒体、DNA、蛋白质和脂质,其破坏细胞结构,导致机体衰老,引起炎症、癌症、心血管疾病等[3-4].在养殖业上,氧化应激导致畜禽生产水平、成活率、劳动力和产品质量下降,养殖成本升高、收益减少等.因此,关于预防和治疗氧化应激损伤的研究,对于畜牧养殖业的发展是不可或缺的.
白藜芦醇(Resveratrol,简称RES)又称为芪三酚,属于天然多酚类化合物,是某些草药治疗炎症、脂类代谢和心脏疾病的有效成分.白藜芦醇是植物为了应对如细菌或真菌入侵、紫外线辐射、外伤及压力等产生的植物抗毒素[5].进一步的动物试验研究发现白藜芦醇具有抗氧化、抗自由基、抗炎症、抗癌、抗心血管疾病等多种生物学活性[6-7].目前,白藜芦醇已作为一种天然添加剂添加到日粮中,对乌骨鸡的热应激损伤起到修复作用[8],能够提高肉鸡和育肥猪的免疫功能等[9-10].近年来,白藜芦醇作用到成纤维细胞上的研究多集中在白藜芦醇对病理性瘢痕成纤维细胞及其信号通路的影响[11-13],白藜芦醇对长波紫外线辐射后皮肤成纤维细胞的增殖[14]、凋亡[15]、保护及其可能机制[16]等方面,以及白藜芦醇对成纤维细胞增殖和凋亡方面的影响[17-18]等,少有研究评估白藜芦醇在成纤维细胞中发挥的抗氧化作用.本试验利用过氧化氢诱导建立兔成纤维细胞氧化损伤模型,用白藜芦醇处理体外细胞氧化应激模型,探讨白藜芦醇对氧化应激损伤的保护作用.
HTML
-
本试验所用的兔成纤维细胞为本实验室冻存. DMEM高糖培养基,胎牛血清,青、链霉素购自Gibco公司.过氧化氢,胰蛋白酶,白藜芦醇购自Sigma公司. CCK-8试剂盒购自广州博徕斯生物科学有限公司.超净工作台(苏州佳德),恒温水浴锅(Labnet),离心机(Eppendorf,Centrifuge 5430),恒温培养箱(Thermo),显微镜(Nikon),酶标仪(Tecan,infinite M200 pro).
-
将成纤维细胞接种到含有10%胎牛血清(体积比)、100 kU/L青霉素和100 mg/L链霉素的DMEM高糖培养基中,于37 ℃,5% CO2培养箱中培养,常规胰蛋白酶消化传代,备用.
-
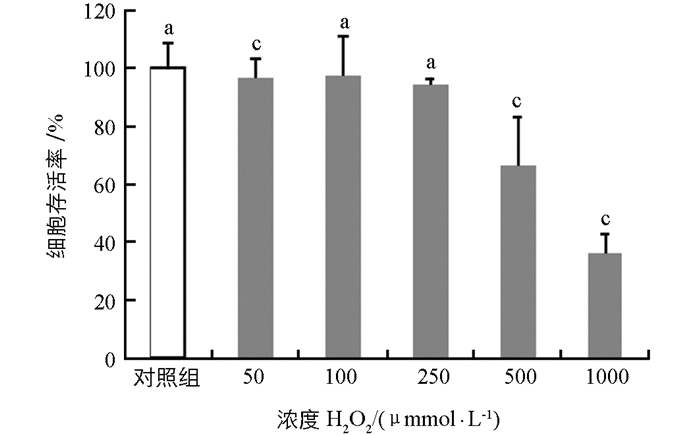
取对数生长期的兔成纤维细胞以1×105个/mL比例接种于96孔板,置于37 ℃,5% CO2培养箱中培养24~48 h;取出培养后的细胞,更换含不同浓度过氧化氢的DMEM处理液,过氧化氢的浓度梯度设置为0 μmol/L(空白对照组),50 μmol/L,100 μmol/L,250 μmol/L,500 μmol/L,1 000 μmol/L,每个浓度设置4个平行重复孔,置于37 ℃,5% CO2培养箱中培养4 h后,往每个孔内各加入10 μL CCK溶液,继续培养2~4 h.将培养好的96孔板于波长450 nm,背景波长620 nm处测量吸光度值(OD值),计算平均值并以此计算细胞存活率(X=A/B×100%,其中X表示细胞存活率,A表示试验组OD值,B表示对照组OD值),以筛选出适宜浓度的过氧化氢来构建氧化损伤模型.
-
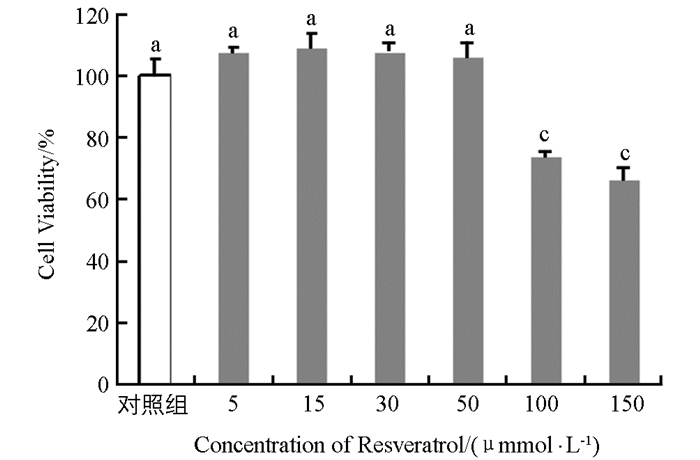
取对数生长期的成纤维细胞按1×105个/mL比例接种于96孔板,每孔总体积100 μL.置于37 ℃,5% CO2培养箱中培养24~48 h.更换含白藜芦醇的DMEM处理液.白藜芦醇的浓度梯度设置为0 μmol/L(空白对照组),5 μmol/L,15 μmol/L,30 μmol/L,50 μmol/L,100 μmol/L,150 μmol/L,200 μmol/L,每个浓度设置4个平行重复孔.培养24 h后,每孔加入10 μL CCK溶液,继续培养2 h后检测细胞活力.
-
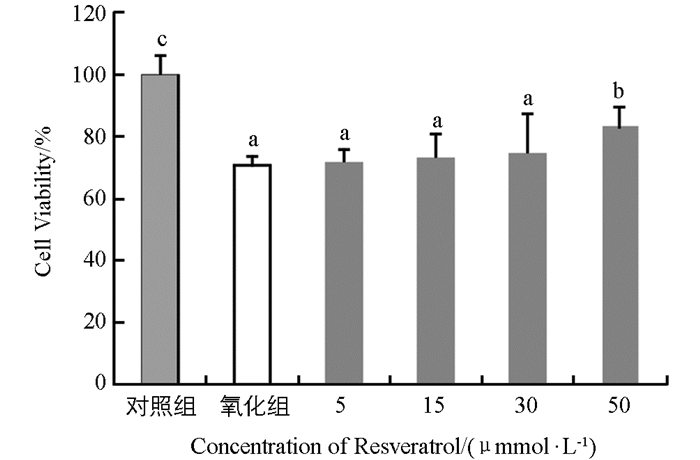
取对数生长期的兔成纤维细胞以1×105个/mL比例接种于96孔板,置于37 ℃,5% CO2培养箱中培养24~48 h.更换不同浓度含白藜芦醇的处理液,浓度梯度设置为0 μmol/L(空白对照组),5 μmol/L,15 μmol/L,30 μmol/L,50 μmol/L,每浓度设置4个平行重复孔.预处理2 h,更换浓度为500 μmol/L的过氧化氢刺激4 h后,通过CCK试剂盒检测细胞活力.
1.1. 材料
1.2. 方法
1.2.1. 成纤维细胞培养
1.2.2. 过氧化氢诱导的兔成纤维细胞氧化损伤模型的构建
1.2.3. 白藜芦醇对成纤维细胞的毒性测试
1.2.4. 白藜芦醇对过氧化氢诱导的兔成纤维细胞氧化损伤的保护作用
-
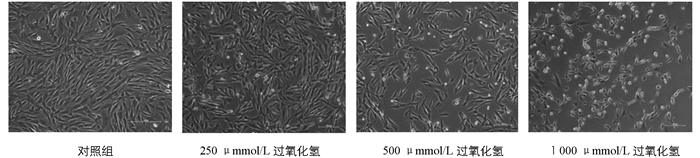
如图 1所示,利用不同浓度的过氧化氢处理兔成纤维细胞4 h后观察各浓度下的细胞形态,发现0~250 μmol/L处理浓度下细胞形态未发生显著变化,500 μmol/L处理浓度下部分细胞出现皱缩甚至死亡,1 000 μmol/L浓度下大量细胞发生皱缩甚至死亡.通过CCK试剂盒检测得到结果如图 2所示,在0~250 μmol/L浓度过氧化氢的作用下,细胞相对存活率降低,但差异不具有统计学意义(p > 0.05);500 μmol/L浓度的过氧化氢处理4 h即可对兔成纤维细胞产生显著损伤,细胞相对存活率降低,且差异极具有统计学意义(p < 0.01).
-
如图 3所示,利用不同浓度白藜芦醇处理实验组成纤维细胞后,显微镜观察可见低浓度(0~50 μmol/L)白藜芦醇处理兔成纤维细胞24 h后,细胞形态无显著变化.而高浓度(100 μmol/L以上)白藜芦醇处理24 h后细胞形态发生显著变化.通过CCK试剂盒对其细胞活力进行检测,结果如图 4所示.成纤维细胞经过0~50 μmol/L浓度的白藜芦醇处理24 h后,细胞相对存活率升高,但各组之间差异不具有统计学意义(p > 0.05);高浓度(100 μmol/L及以上)组的白藜芦醇会对细胞产生毒性作用,造成细胞相对存活率降低,且差异极具有统计学意义(p < 0.01).由此可以推定,在后续试验中将白藜芦醇浓度设置为0~50 μmol/L为宜.
-
如图 5所示,用白藜芦醇预处理兔成纤维细胞2 h,再用500 μmol/L过氧化氢刺激细胞4 h,并通过CCK试剂盒检测细胞相对存活率.结果显示,过氧化氢处理4 h后细胞的相对存活率与预处理阶段白藜芦醇浓度呈正相关,但0~30 μmol/L浓度的白藜芦醇处理组之间抗氧化损伤作用不具有统计学意义(p > 0.05);白藜芦醇预处理的浓度为50 μmol/L时,细胞相对存活率显著升高(p < 0.05).由此说明,50 μmol/L白藜芦醇预处理能有效抵御过氧化氢诱导的兔成纤维细胞氧化损伤,显著提高细胞存活率.
2.1. 过氧化氢诱导的兔成纤维细胞氧化损伤模型的构建
2.2. 白藜芦醇对兔成纤维细胞的毒性作用测试
2.3. 白藜芦醇对过氧化氢诱导的兔成纤维细胞氧化损伤的保护作用
-
成纤维细胞是结缔组织中最常见的细胞,由胚胎时期的间充质细胞分化而来,对不同程度的细胞变性、坏死和组织缺损以及骨创伤的修复有着十分重要的作用[19],是用于研究细胞老化、各种外来因子对细胞的损伤、细胞在体外条件下的恶性转化以及某些先天性代谢异常、酶缺陷等问题的重要细胞资源.由于其易于获取,又易于在体外生长,成纤维细胞已在基础医学和临床医学研究领域中得到较广泛的运用.过氧化氢是一种强氧化剂,它直接通过细胞的各种内源性氧化酶类(如黄嘌呤氧化酶)和间接通过自发或催化线粒体呼吸而歧化超氧阴离子(O2.-)来发挥氧化损伤作用[20].过氧化氢价格低廉、易于获得,在科研试验中常被用于构建氧化应激损伤模型.目前,已有学者针对成纤维细胞构建氧化应激模型时的过氧化氢最佳浓度进行了研究,但这一浓度的认定仍存在较大的差异.杜先华等[21]在试验中得出100 μmol/L的过氧化氢刺激人皮肤成纤维细胞4 h后可观察到部分细胞发生皱缩,细胞凋亡明显增加.王永新[22]则用730 μmol/L过氧化氢刺激人皮肤成纤维细胞12 h构建了氧化应激模型.汪凡等[23]以200 μmol/L的过氧化氢作为建立大鼠真皮成纤维细胞氧化应激模型的浓度.在本研究中,500 μmol/L的过氧化氢处理兔成纤维细胞4 h后,部分细胞形态发生皱缩甚至死亡,CCK-8试剂盒检测细胞活力可见细胞活性显著降低,成功地构建了氧化应激模型.
白藜芦醇具有抗氧化、抗自由基、抗炎等作用,但细胞对其的耐受值是多少并不明确,不同细胞的耐受情况也存在差异,金晓露[24]报道白藜芦醇处理浓度在50 μmol/L以下时不会引起乳腺上皮细胞活力显著地降低,而100 μmol/L的白黎芦醇则引起了细胞活力显著地丧失.杨东雪[25]研究表明浓度为75 μmol/L白藜芦醇对猪小肠上皮细胞产生细胞毒作用.田素良[26]用白藜芦醇处理心肌细胞,结果显示50 μmol/L组细胞活性开始下降,并低于对照组,100 μmol/L组降至最低.本研究表明0~50 μmol/L浓度的白藜芦醇能够提高兔成纤维细胞的相对存活率,但高浓度(100 μmol/L以上)的白藜芦醇会对细胞产生毒性作用.
以细胞氧化应激模型评价天然产物的抗氧化活性是一种低成本且直观反应抗氧化损伤效果的方法.刘红亮等[27]研究了槲皮素对过氧化氢损伤PC12细胞的保护效果与机制,汪凡等[23]研究了银杏叶提取物对过氧化氢诱导的成纤维细胞氧化应激损伤的保护作用,付远妨等[28]研究了鸡血藤黄酮乙酸乙酯部位对过氧化氢诱导RAW264.7细胞氧化应激的调节作用.通过对细胞水平的研究,可以从一定程度上反应天然产物的抗氧化效应,从而为后续分子机制的研究提供依据.另一方面,在细胞研究的基础上再通过动物试验,在日粮中添加一定剂量的天然抗氧化剂来缓解和修复氧化应激造成的伤害,从而为天然氧化剂在生产实践中的应用奠定基础.







 DownLoad:
DownLoad: