-
土壤盐渍化是农业发展面临的重要问题之一,不仅严重制约着农作物的生长发育,也极大地威胁着粮食的生产安全,还会导致土壤可利用率的大幅度降低.据估计,世界上6%以上的土地和30%以上的灌溉区已经面临盐渍化问题[1].在我国,盐渍土的总面积达3 200万hm2,其中具有农业利用前景的盐碱地总面积1 230万hm2[2],并且随着人口数量增加、城镇化及工业化的快速发展,有持续扩大和蔓延的趋势.因此,如何有效开发和利用盐碱化土地资源,已经成为我国目前及今后的农业生产与发展亟待解决的重大问题.
水稻属于不耐盐的甜土植物[3],是对盐敏感的谷类作物[4],而稻田盐碱化是制约水稻高产的主要环境因子之一.因此,筛选和培育具有强耐盐性质的水稻品种,已成为增强水稻抗逆性、提高盐碱化土地水稻产量的重要研究课题.目前,已有大量研究表明,用盐溶液浸种的方法可以提高植物抗盐胁迫的能力[5-9],但有关盐胁迫下NaCl浸种对植物根系生理机制影响的研究却少有报道.根系不仅是植物吸收矿质营养和水分的重要器官,也是植物感受土壤逆境信号的首要部位和敏感器官.根系在逆境下的形态特征及活力状态,是植物对土壤养分有效吸收和利用最直接的适应性特征之一[10-11],对植物的耐盐胁迫能力具有重要作用[12].但由于根系是在土壤中生长发育的,研究起来难度很大,目前少有关于根系对盐胁迫响应机制的报道.因此,本课题在前期研究[13]的基础上,继续探讨NaCl浸种处理下“两优培九”幼苗根系生长对高盐胁迫环境的响应机制,以便为我国盐碱地培育和栽培杂交稻的生产实践提供一定的理论参考.
HTML
-
实验于2018年4月15日在江苏第二师范学院综合实验室进行.两系杂交稻“两优培九”种子由江苏省农业科学研究院粮食与作物研究所吕川根研究员惠赠.选取饱满、大小基本一致的种子用1%的双氧水消毒1 h,再用蒸馏水漂洗3~5次,吸水纸吸干表面多余水分.再将种子分别浸泡在装有蒸馏水(对照组)、17 mmol/L NaCl(T1处理组)和34 mmol/L NaCl(T2处理组)溶液中浸种24 h,之后在铺有干净吸水毛巾的培养皿中(预先添加各相应浓度的NaCl溶液)黑暗催芽48 h(25 ℃).选取发芽程度一致的种子播种于盛有蛭石的培养盆中(盆内预先装有含68 mmol/L NaCl的木村B培养液),并转移至光照培养箱,每天光照12 h,光子通量为100 μmol/(m2·s),在28 ℃/22 ℃(昼/夜)条件下培养.为防止在植株培养过程中NaCl浓度因水分蒸发逐渐增高而影响实验结果,在培养盆底部凿洞,套在另一个培养盆内.更换培养液时,先放尽旧的培养液,并用蒸馏水淋洗3~5次,再加入新鲜培养液,以保持培养液中NaCl浓度的相对稳定.每组3次重复,随机排列.培养至3叶1心期后取幼苗根系进行相关生理指标的测定.
-
参照陈建勋等[14]的相对电导率法并稍加修改.将根系用去离子水冲洗干净,滤纸吸干表面水分,剪取约1 cm段,称取1 g放入试管中,用20 mL去离子水浸泡2 h后测电导率R1,然后将各试管放入沸水浴中煮沸20 min,冷却至室温后测电导率R2.相对电导率R/%=R1/R2×100表示根系细胞膜的相对透性.
-
用流水小心冲洗根系并将每株根系分开,以单株为单位测定根长、根数、根鲜质量、根干质量和根系总体积.用滤纸吸干根系表面水分后测定根鲜质量;将鲜根置于105℃的烘箱烘干至恒质量测定根干质量;用排水法测定根系总体积;用常规测量和计数法测定根长与根数.以上形态指标各测定10株,取平均值,重复4次.
-
采用张志良等[15]的α-萘胺氧化法.将称量好的根系样品浸入含0.5 mol/L磷酸缓冲液(pH值为7.0)和50 μg/mL的α-萘胺溶液各25 mL的三角瓶中,以不放根系作为α-萘胺自动氧化的对照.室温下静置10 min后取待测液2 mL,加入10 mL蒸馏水,再加入1%对氨基苯磺酸与亚硝酸钠溶液各1 mL,混匀后室温下静置5 min,蒸馏水定容至25 mL.于510 nm处测定吸光值,在标准曲线上查得α-萘胺质量分数.剩余溶液置于25 ℃温箱中避光保温1 h,取待测液2 mL,按上述方法在510 nm处测定吸光值,并计算α-萘胺的质量分数.以每小时每克样品鲜质量氧化的α-萘胺量(μg)表示.
-
采用张志良等[15]的活体法.取一定量的根系样品浸入含0.1 mol/L磷酸缓冲液(pH值为7.5)5 mL与0.2 mol/L硝酸钾溶液5 mL的50 mL锥形瓶中,置于30 ℃温箱避光保温30 min.然后取1 mL反应液,加入磺胺试剂与α-萘胺试剂各2 mL,于30 ℃温箱中静置30 min,测定540 nm处的吸光值,从标准曲线上读出NO2-的质量分数,再计算酶活力,以每小时每克样品鲜质量产生的NO2-(μg)表示.
-
用Microsoft Excel整理数据和制图,运用SPSS 13.0对数据进行单因素方差分析和最小显著性差异法(LSD)进行多重比较(p<0.05).
1.1. 材料培养
1.2. 实验方法
1.2.1. 根系细胞膜透性的测定
1.2.2. 根系形态指标的测定
1.2.3. 根系活力的测定
1.2.4. 根系硝酸还原酶活性(NR)的测定
1.3. 数据处理
-
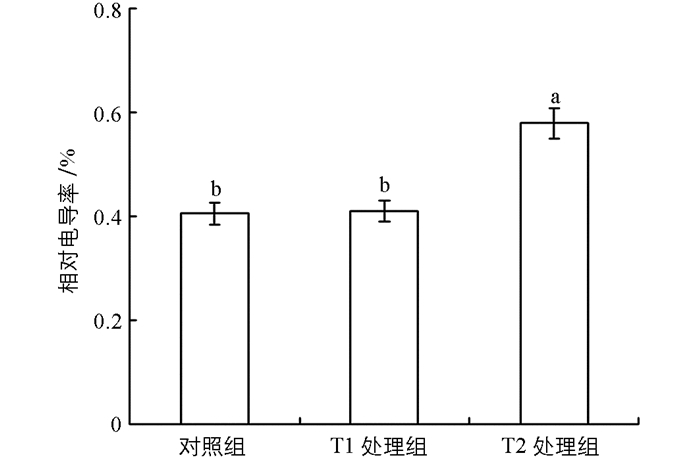
图 1的结果显示,在不同浓度的NaCl浸种处理下,各实验组的“两优培九”幼苗根系的细胞膜透性总体上表现为逐渐增大的趋势. T1处理组的相对电导率与对照组基本上处于同一水平,仅比对照组增加了1.2%,差异无统计学意义(p>0.05).而T2处理组则增加明显,其相对电导率分别比对照组与T1处理组增加了42.93%与41.24%,与二者的差异均有统计学意义(p<0.05).这说明,用一定浓度的NaCl溶液浸种处理并不会明显增大根系的细胞膜透性,但NaCl的浸种浓度过高则会增大细胞膜的透性,从而对细胞结构和功能产生不良影响.
-
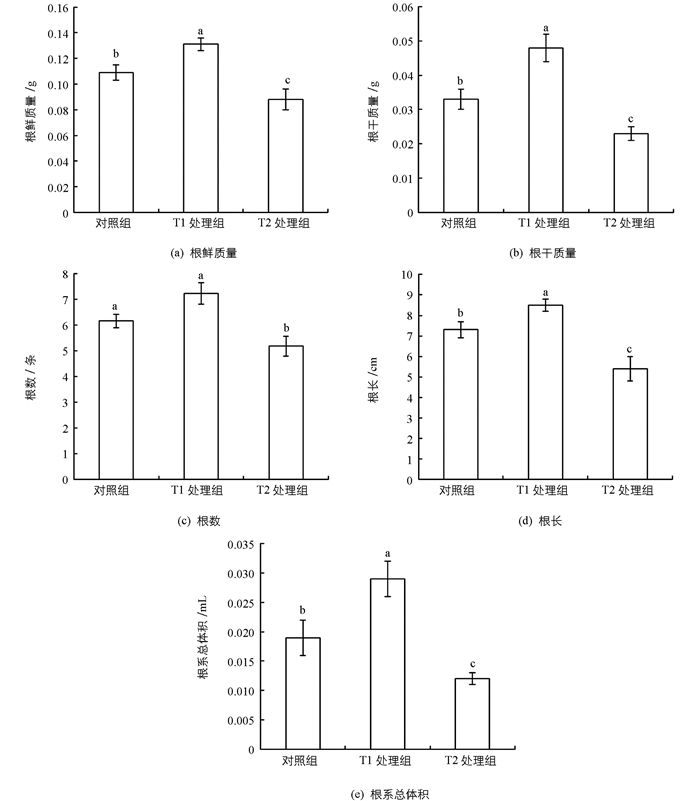
如图 2a与2b所示,随着浸种NaCl浓度的增加,“两优培九”幼苗根系的鲜质量与干质量均表现为先升后降的趋势,其中T1处理组的值最大,而T2处理组最小.与对照组相比,T1处理组根系的鲜质量和干质量分别增加了20.21%和45.45%,两者差异均有统计学意义(p<0.05).而T2处理组均比对照组有明显下降(p<0.05),其根系的鲜质量和干质量分别下降了23.86%和43.48%.
幼苗根系的长度、数量与总体积也具有相似的变化情况.对不同浓度NaCl浸种处理下的幼苗根系数量进行统计分析发现(图 2c),与对照组相比,T1处理组的根系数量增加了9.25%,但差异无统计学意义(p>0.05).而T2处理组的根系数量则比对照组和T1处理组有明显减少(p<0.05),分别减少了18.97%和39.54%.
图 2d的结果显示,不同浓度的NaCl浸种处理影响了“两优培九”幼苗的根系长度. T1处理组的根系长度比对照组增加了16.44%,差异有统计学意义(p<0.05).与对照组和T1处理组相比,T2处理组的根系长度均明显减少(p<0.05),分别降低到对照组和T1处理组的79.37%和63.52%.
由图 2e可知,T1处理组的根系总体积分别比对照组和T2处理组增加了52.63%和141.67%,差异有统计学意义(p<0.05).与对照组相比,T2处理组的根系总体积则下降了36.84%,差异有统计学意义(p<0.05).
以上结果表明,用低浓度的NaCl溶液浸种处理会对植株幼苗根系的生长发育产生不同程度的促进作用,但NaCl溶液的浸种浓度过高则会抑制根系的生长发育.
-
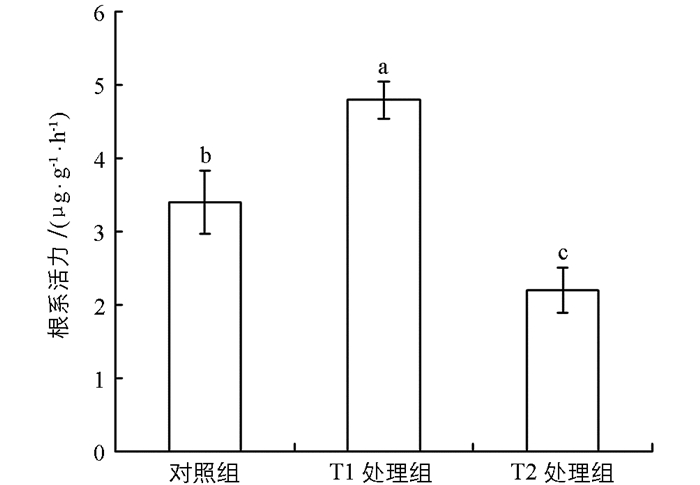
图 3的结果表明,不同浓度的NaCl溶液浸种处理对盐胁迫下“两优培九”幼苗根系活力的影响不同. T1处理组的幼苗根系活力为4.84 μg/(g·h),分别比对照组与T2处理组增加了41.18%和118.18%,与二者的差异均有统计学意义(p<0.05). T2处理组的根系活力大幅度下降,与对照组相比,根系活力下降了54.55%,差异有统计学意义(p<0.05).这表明,一定浓度的NaCl浸种处理可以显著提高植株幼苗的根系活力,增强对盐胁迫环境的抗性.
-
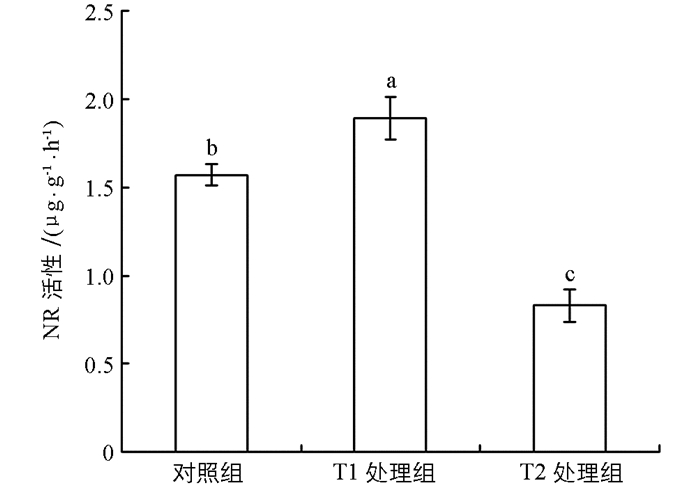
由图 4可知,随着NaCl溶液的浸种浓度升高,“两优培九”幼苗根系的硝酸还原酶活性呈现先升后降的趋势. T1处理组幼苗根系的硝酸还原酶活性提高明显,分别比对照组和T2处理组增加了20.38%和127.71%,与二者相比差异有统计学意义(p<0.05).而T2处理组的根系硝酸还原酶活性则大幅度下降,比对照组降低了47.13%,差异有统计学意义(p<0.05).这表明,一定浓度的NaCl浸种处理可以明显提高盐胁迫下根系的硝酸还原酶活性,进而增强根系对土壤氮元素的吸收和转化利用能力.
2.1. NaCl浸种对盐胁迫下幼苗根系细胞膜透性的影响
2.2. NaCl浸种对盐胁迫下幼苗根系生长形态的影响
2.3. NaCl浸种对盐胁迫下幼苗根系活力的影响
2.4. NaCl浸种对盐胁迫下幼苗根系硝酸还原酶活性的影响
-
根系是植物吸收土壤营养的重要组织器官,其生长形态及构型特征在很大程度上决定着植物汲取水分和养分的能力.此外,根系还是植物合成氨基酸与激素等物质的主要场所,与地上部的生长发育和植株的产量形成密切相关[16].在土壤盐渍等非生物逆境条件下,植物最先感受环境胁迫信号的器官是根系[17].因此,根系的生长情况与活力状况将对植物的生长发育、营养状况和产量水平产生直接的影响[18].形态发达与活力强盛的根系有力地保证了水稻对土壤水分和养料的高效吸收与利用,对水稻的生长发育和产量形成具有非常重要的作用[19].
根系的形态是根系生长及分支的整体表现,是遗传因素和环境因素相互作用的综合结果,在某种程度上体现了根系的生长发育状况[20],根系的长度、数量、总体积以及生物量等指标是根系对水分和营养成分吸收的强度和广度的综合反映.盐害可引起植物生理干旱,抑制根的生长,导致植物叶片生长不良,出现叶尖枯黄、叶面斑黄等症状[21].本实验中,在不同浓度的NaCl溶液浸种处理下,“两优培九”幼苗的根鲜质量与干质量、发根数、根长以及根系总体积等参数总体上表现出完全一致的变化趋势,仅增减幅度有所不同.其中,T1处理组的幼苗根系形态各参数表现良好.除根系数量外,根系的鲜质量与干质量、根长以及根系总体积均显著高于对照组与T2处理组(p<0.05).而与对照组相比,T2处理组的根系形态则显著降低.由此可见,一定浓度的NaCl溶液浸种处理(如T1处理组),可以促进“两优培九”幼苗根部的生长,扩大根系吸收水分和营养物质的广度和强度,为根系正常的生理活动奠定良好的结构基础,从而使植株对盐胁迫的适应力得以提高.
在盐胁迫下,植物细胞膜会受到不同程度的破坏,其透性增大,导致电解质大量向胞外渗漏.盐胁迫对植物的毒害很大程度上是通过破坏膜的结构和功能引起的[22].细胞膜的破坏程度越低,则植物对盐胁迫的抗性越强[23].本实验中,与对照组相比,T1处理组的“两优培九”幼苗的根系细胞质膜透性基本保持不变.而T2处理组的根系细胞质膜透性则比对照组和T1处理组显著增加.这说明,低浓度的NaCl浸种处理对“两优培九”幼苗的根系细胞质膜损伤不明显,但浸种盐浓度过高,则会对幼苗根系的细胞膜产生较大损伤,进而影响植株根系的生长发育.这与他人的研究结果是一致的[24-25].
植物的根系活力是根系的吸收、合成、氧化以及还原等能力的综合体现,客观反映根系的活动能力和活力水平[26].根系活力越高,表明植株生长势越强,抗逆性就越强;反之,则植株的生长势越弱,抗逆性就越差[27].本实验中,当浸种的NaCl溶液浓度为17 mmol/L时(T1处理组),“两优培九”幼苗的根系活力最大,均显著高于对照组和T2处理组(p<0.05).当NaCl溶液的浸种浓度为34 mmol/L时(T2处理组)时,根系活力明显下降(p<0.05),而且显著低于对照组(p<0.05).由此可见,一定浓度的NaCl浸种处理,可以提高盐胁迫下“两优培九”幼苗的根系活力,间接地保证了根对地上部营养物质及细胞分裂素等生理活性物质的有效运送,从而有利于地上部正常的生命活动,为植物在盐胁迫环境下的健康生长打下良好的物质基础.
硝酸还原酶是植物体内同化硝酸盐反应过程的限速酶,对植物氮代谢至关重要,其活性大小影响植物的生长发育、蛋白质与核酸等物质的生物合成[28].该酶对盐胁迫很敏感,盐胁迫可以抑制其活性,使NO3-大量积累,NO2-的含量降低,最终导致植物体内一系列含氮化合物的代谢发生紊乱[29].实验结果表明,与根系活力的变化情况相似,T1处理组的“两优培九”幼苗的根系硝酸还原酶活性大幅度升高,显著高于对照组和T2处理组(p<0.05);而T2处理组的硝酸还原酶活性不但明显低于T1处理组,而且也明显低于对照组(p<0.05).这说明,一定浓度的NaCl浸种处理,能明显提高“两优培九”幼苗根系的硝酸还原酶活性,从而促进根系对硝态氮素的吸收利用,最终有利于植物体合成叶绿素、蛋白质及核酸等含氮化合物,增强“两优培九”幼苗对盐胁迫环境的适应能力.
结合前期的研究结果,我们认为,用17 mmol/L的NaCl溶液浸种处理,不仅能促进杂交稻“两优培九”种子在盐胁迫下的正常萌发,以及萌发后幼苗根系的生长发育,还有利于幼苗地上部的正常生理活动,从而增强“两优培九”幼苗对盐胁迫环境的适应性.这为在盐碱土地上种植和栽培杂交稻提供了一种新的思路.






 DownLoad:
DownLoad: