-
过氧化物酶(EC 1.11.1.7)是一类以铁卟啉为辅基的氧化还原酶,该酶参与了植物的光合作用、呼吸作用、乙烯和木质素生物合成[1],对细胞的生长发育、细胞膜完整性、自身损伤修复、疾病抵抗、逆境胁迫抵抗都起到了积极的作用,同时能催化大量酚类化合物以解除细胞毒性[2].目前,该酶在环境治理、免疫学、医学、食品产业等领域得到广泛应用[3-5].
‘忠薯1’(Ipomoea batatas L. Lam)又名甘薯,为1年生旋花科植物.甘薯富含多种营养物质,如淀粉[6]、蛋白质、膳食纤维[7]、维生素[8]、酚类[9]、黄酮[10]、花青素[11]等.甘薯具有提高免疫力、抗氧化、抗动脉硬化和抗肿瘤等生理功能[12-14].随着人们生活水平的提高以及消费者对新鲜食材营养价值的日趋重视,近年来,鲜切甘薯因其营养丰富、便捷以及高利用率等特点迅速获得了广大消费者的青睐[15].但是鲜切甘薯在生产过程中容易受到机械力伤害,在氧气作用下,过氧化物酶与酚类化合物迅速接触生成醌类物质,醌类物质通过脱水以及自身聚合反应生成棕色或黑色聚合物形成甘薯褐变.褐变不仅会影响甘薯的外观,降低营养价值,还能导致甘薯变质腐烂和浪费,从而制约着甘薯产业的发展.因此,本实验以西南大学重庆市甘薯工程技术研究中心培育品种‘忠薯1’为实验材料,通过色谱技术成功从甘薯薯皮中分离纯化得到‘忠薯1’过氧化物酶,并对相关酶学特性以及酶促动力学进行探讨,为进一步揭示过氧化物酶酶促褐变分子机理、设计出有效控制鲜切甘薯褐变方法以及筛选出高效褐变抑制剂提供针对性的理论参考,也为甘薯产业的长远发展提供新的方向.
HTML
-
‘忠薯1’由西南大学重庆市甘薯工程技术研究中心提供. DEAE-Sepharose,Superdex-200,凝胶过滤层析标准品,美国GE Healthcare公司;SDS-PAGE预制胶,上海Beyotime公司;蛋白质SDS-PAGE标准品,上海Beyotime公司;其余试剂均为国产分析纯.
-
蛋白质低压分离纯化系统,美国Bio-Rad公司;UV-2550型紫外分光光度计,日本岛津公司;垂直蛋白质电泳槽和电泳仪,美国Bio-Rad公司;高速冷冻离心机,美国Thermo Scentific公司;GL-21M冷冻干燥机,德国Uni Equip公司.
-
‘忠薯1’采摘后,用双蒸水清洗,削取表皮,按照1:5的比例与磷酸盐缓冲液(0.05 mol/L,pH值为7.2)混合匀浆,4 ℃条件下静置抽提2.5 h;8层纱布过滤,弃去滤液,滤渣用预冷双蒸水重悬,每隔1 h更换双蒸水,重复多次,直至重悬液滤液中检测不到可溶性过氧化物酶活性.收集重悬液滤渣,按照1:5的比例与磷酸盐缓冲液(0.05 mol/L,2 mol/L NaCl,pH值为7.2)重悬,超声破碎45 min(100 W),在磁力搅拌器上搅拌过夜,过滤后弃去滤渣,滤液在4 ℃条件下7 000 r/min离心35 min,分别测定溶液中过氧化物酶总活性以及蛋白质质量.
-
向过氧化物酶提取液中加入预冷无水乙醇至40%饱和度,4 ℃静置2h后,5 000 r/min离心15 min,收集上清液;再加入无水乙醇至70%饱和度,4 ℃静置2 h,5 000 r/min离心20 min,用缓冲液溶解沉淀,分别测定溶液中过氧化物酶活性以及蛋白质质量.
-
用磷酸盐缓冲液(0.05 mol/L,pH值为7.2)平衡层析柱24 h,10 mL初酶液作为上样液,用磷酸盐缓冲液(0.05 mol/L,pH值为7.2,1 mol/L NaCl)进行线性梯度洗脱,流速0.7 mL/min;分别测定各管过氧化物酶活性和蛋白质质量,收集活性较高的酶液,透析脱盐,冷冻干燥后进行Superdex-200凝胶过滤层析.
-
用磷酸盐缓冲液(0.05 mol/L,pH值为7.2)平衡层析柱24 h,用磷酸盐缓冲液(0.05 mol/L,pH值为7.2)溶解离子交换层析纯化后活性最高部分,上样量为5 mL,流速设为0.27 mL/min;分别测定各管过氧化物酶活性和蛋白质质量,收集活性最高的酶液透析除盐,冷冻干燥.
-
过氧化物酶活性采用庞学群等方法进行测定[16],2.775 mL磷酸盐缓冲液(0.05 mol/L,pH值为7.2),100 μL愈创木酚(4%)和100 μL H2O2(1%)与25 μL过氧化物酶酶液混合,UV-2550型分光光度计记录120 s内光密度OD470的变化.酶活力单位(U)指在该反应条件下,每分钟发生光密度OD470改变0.01所需的酶量为1个酶活力单位.
-
采用Bradford法测定蛋白质质量.使用牛血清蛋白(Sigma Chemical,St.Louis,USA)作为蛋白质标准品,测定过氧化物酶提取物中蛋白质质量[17].
-
利用12%分离胶,5%浓缩胶,1 0 μL样品在80 V电压下电泳30 min,120 V电压下电泳60 min,电泳结束后,用考马斯亮蓝超快染液染色15 min,用去离子水脱色1 h,直至条带清晰.利用凝胶过滤试剂盒测定过氧化物酶总分子量,其计算公式为
式中Kav为分配系数,Ve为洗脱体积,Vo为外水体积,Vt为柱床总体积.
-
将纯化后并经过稀释的过氧化物酶酶液与最适温度不同pH值(2~6,梯度为1;6~7,梯度为0.2;7~10,梯度为1)缓冲液,100 μL愈创木酚(4%)和100 μL H2O2(1%)混合测定酶活力,最高酶活力设定为100%,从而确定反应最适pH值.将Superdex-200凝胶过滤后稀释的酶液与不同pH值(3.0~8.0)的缓冲溶液等体积混合,室温放置6 h后,每1 h测定1次相对酶活力,通过该酶在不同pH值、不同时间条件下的相对酶活力变化情况,确定该酶的pH稳定性.
-
将纯化后并经稀释的过氧化物酶酶液与最适pH不同温度(20~30 ℃,梯度为10 ℃;30~70 ℃,梯度为5 ℃;70~90 ℃,梯度为10 ℃)缓冲液,100 μL愈创木酚(4%)和100 μL H2O2(1%)混合,测定各温度下过氧化物酶相对酶活力,确定最佳反应温度.将Superdex-200凝胶过滤后并经过稀释的过氧化物酶酶液置于(25~75 ℃)下孵育0~6 h,每间隔1 h测定1次过氧化物酶相对酶活力,通过该酶在不同温度、不同时间条件下的相对酶活力变化情况,确定该酶的温度稳定性.
-
分别将100 mmol/L不同金属离子(Co2+,Mg2+,Pb2+,Ca2+,Cu2+,Fe3+)按一定比例与反应液混合,使得各金属离子在反应体系中最终浓度为10,20,30,40,50 mmol/L,在最适条件下测定酶活力,以不含金属离子时的反应液酶活力为100%,计算在不同浓度金属离子条件下过氧化物酶的相对酶活力.
-
在最适温度和最适pH值条件下,以不同浓度的愈创木酚(5,10,20,30,40,50 mmol/L)为底物,利用UV-2550型紫外分光光度计测定过氧化物酶的速率,采用Lineweaver-Burk方程求出该反应速率常数Km.
-
分别固定愈创木酚浓度为1,2,4 mmol/L,在H2O2浓度为0.1,0.2,0.4,0.5 mmol/L条件下测得酶促反应速率;分别固定H2O2浓度为0.2,0.3,0.4 mmol/L,愈创木酚浓度为1,2,3,4,5 mmol/L条件下测得酶促反应速率.通过Lineweaver-Burk双倒数作图,根据酶动力学确定过氧化物酶双底物反应类型[18].
式中V为反应速率,Km为米氏常数,Vmax为最大反应速率,S为底物浓度.
1.1. 材料与试剂
1.2. 仪器与设备
1.3. 方法
1.3.1. 粗酶液提取
1.3.2. 无水乙醇分级沉淀
1.3.3. DEAE-Sepharose离子交换层析
1.3.4. Superdex-200凝胶过滤层析
1.3.5. 过氧化物酶活力测定
1.3.6. 蛋白质质量测定
1.3.7. SDS-PAGE和总分子量测定
1.3.8. 酶学性质测定
1.3.8.1. 最适pH值和pH稳定性
1.3.8.2. 最适温度和温度稳定性
1.3.8.3. 金属离子对过氧化物酶影响
1.3.8.4. 过氧化物酶米氏常数(Km)和最适底物测定
1.3.8.5. 过氧化物酶双底物反应类型鉴定
-
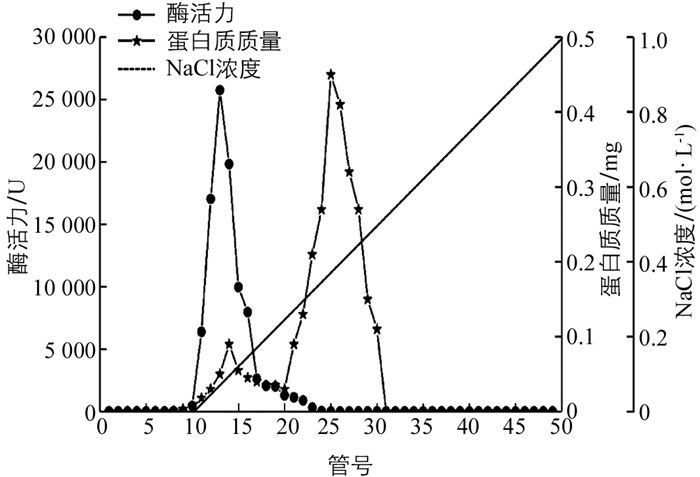
‘忠薯1’过氧化物酶初酶液经DEAE-Sepharose层析后,过氧化物酶酶活力集中在第10~20管,蛋白质集中在第10~30管,图 1显示了1个酶活力峰和2个蛋白质质量峰,可知粗酶液中不存在过氧化物酶同工酶.在10~20管范围内,蛋白质质量曲线与酶活力曲线趋势范围相似,表示在此范围内酶活力和蛋白质质量均较高,且存在非目标蛋白质,非目标蛋白质会影响后续过氧化物酶纯化以及过氧化物酶纯度,而在20~30管范围内过氧化物酶酶活力较低,蛋白质质量较高,说明20~30管大部分均为非目标蛋白质.因此,还需进一步通过Superdex-200凝胶过滤层析分离纯化除去非目标蛋白质.
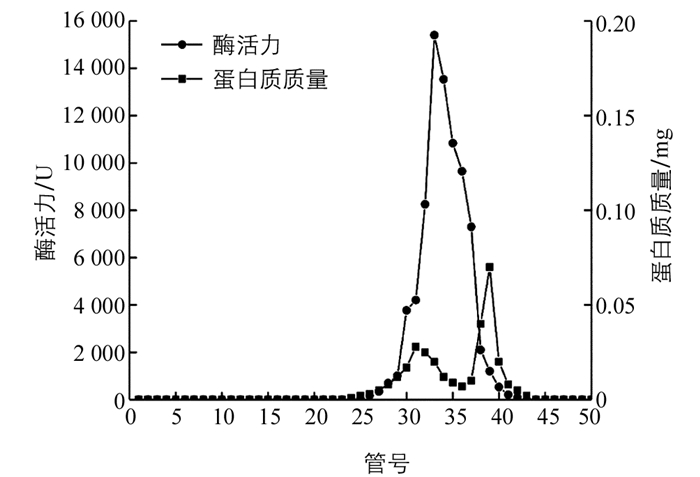
图 2显示,过氧化物酶酶活力集中在第25~40管,蛋白质集中在25~45管,其中酶活力最高峰位于第35管,此时蛋白质质量最低,表明过氧化物酶纯度较高,纯化效果较好.
甘薯过氧化物酶的分离纯化结果见表 1,该酶的粗酶液经过分离纯化后,比活力为571 975.93 U/mg,纯化倍数为51.72,活性回收率为33.80%,表明该酶具有较高纯度和酶活性,可以继续利用该酶深入探究相关酶学性质和酶促动力学.
-
收集经Superdex-200纯化后活性最高的过氧化物酶酶液,利用透析袋透析24 h,冷冻干燥后样品经SDS-PAGE电泳分析(图 3).聚丙烯酰胺凝胶上标准蛋白质和样品均显示为单一的条带,说明该过氧化物酶纯度超过95%,凝胶成像系统根据与标准蛋白质迁移率计算得到过氧化物酶亚基分子质量为37.0 kDa.
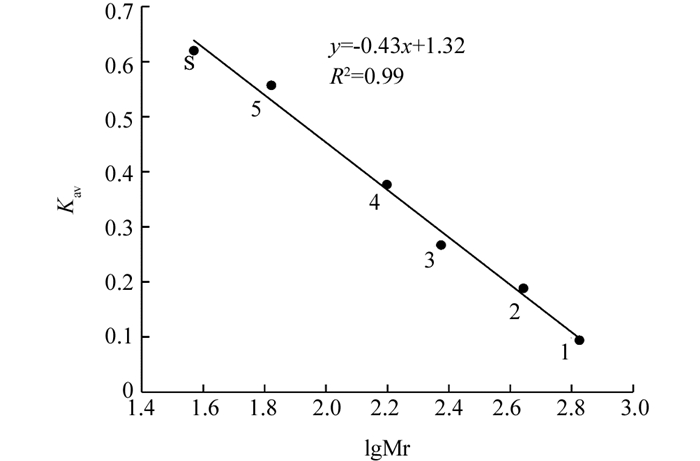
Superdex-200凝胶过滤层析根据蛋白质分子质量与洗脱顺序成正比的原理,将过氧化物洗脱体积与试剂盒中标准蛋白洗脱体积比较,计算得到过氧化物酶总分子量为37.2 kDa,表明‘忠薯1’过氧化物酶是由单一亚基组成的蛋白质(图 4).
-
在不同pH条件下测得甘薯过氧化物酶的相对酶活力(图 5). ‘忠薯1’过氧化物酶相对酶活力随pH增加先上升后下降.过氧化物酶在pH值为2.0~3.0范围内相对酶活力低于5%,pH值为8.0~10.0范围内相对酶活力低于50%,表明强酸强碱环境都可以使酶的空间结构破坏,引起酶的构象改变,酶活性降低.而在pH值为4.0~7.0范围内活性较高,其最适pH值为6.2,表明‘忠薯1’过氧化物酶在弱酸性环境中较稳定.
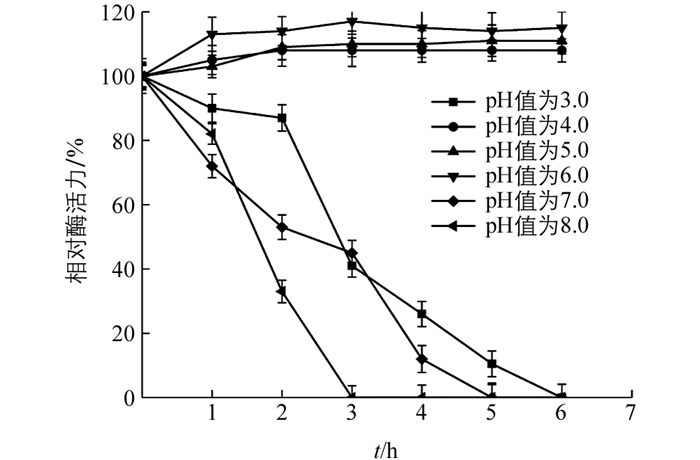
将酶与不同pH值缓冲液混合(图 6),在pH值为3.0,7.0,8.0时相对酶活力随着时间逐渐降低;5 h时其相对酶活力不及20%,而在pH值为4.0~6.0范围内相对酶活力均保持在100%水平,表明‘忠薯1’过氧化物酶在弱酸性环境中具有良好的稳定性.
-
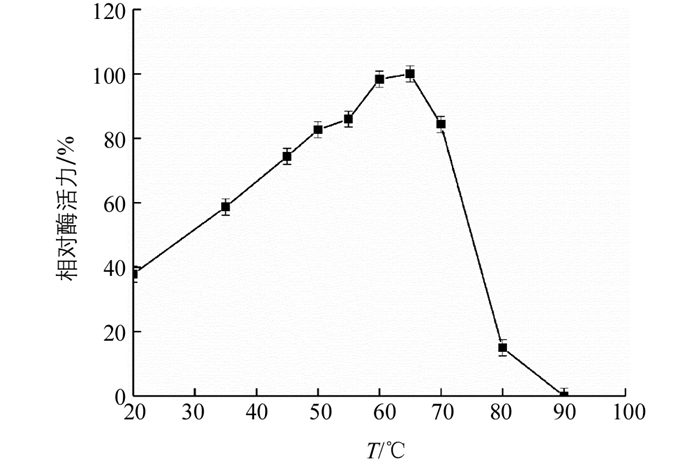
在不同温度条件下测得‘忠薯1’过氧化物酶的相对酶活力(图 7),显示其相对酶活力随温度增加先上升后下降.在20 ℃和80 ℃时,相对酶活力分别为39.7%,17.3%.而在30~70 ℃相对酶活力均高于50%,温度升高能提高分子运动速率以及分子间的碰撞,提高了反应速率.其最适反应温度为65 ℃,表明‘忠薯1’过氧化物酶在30~70 ℃范围内较为稳定.
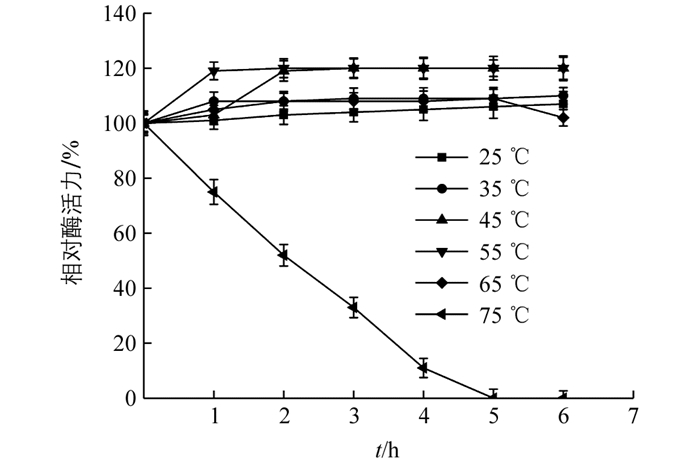
将酶液在不同温度下孵育(图 8),在25~65 ℃范围内相对酶活力均未受影响,表明过氧化物酶有良好的热稳定性;75 ℃时酶活力迅速下降,2 h时酶活性仅有50%,5 h后活性丧失,表明酶已经完全变性失活.
-
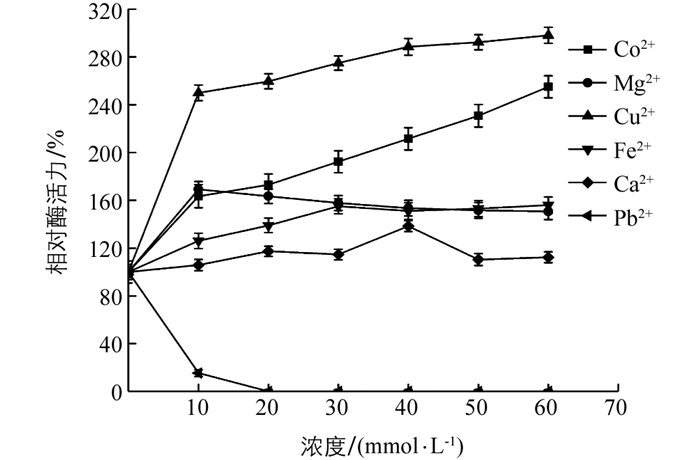
当Co2+,Mg2+,Cu2+,Fe3+,Ca2+逐渐增加时,该酶相对酶活力均大于100%(图 9),最高分别能达到230.76%,169.23%,298.07%,156%,138.46%,显示Co2+,Mg2+,Cu2+,Fe3+对该酶有很强的激活作用.当Ca2+为60 mmol/L时,相对酶活力为103%,表明Ca2+对该酶激活作用较弱. Pb2+作为重金属对植物过氧化物酶具有很强抑制作用,当浓度为10 mmol/L时相对酶活力低于10%,说明Pb2+是酶促褐变反应的有效抑制剂.
-
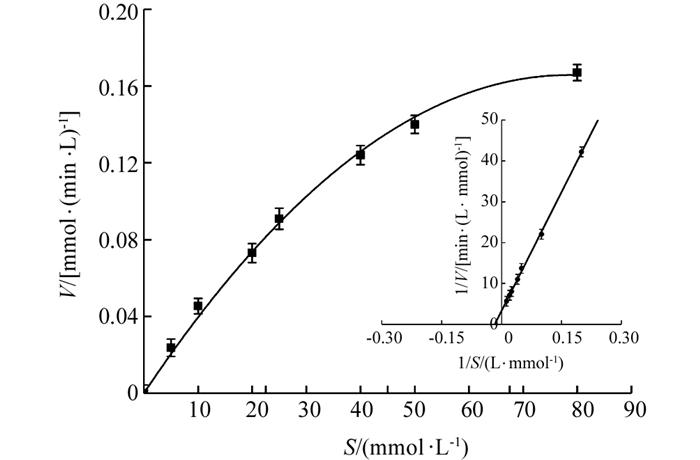
在最适条件下,以(10~50 mmol/L)愈创木酚S作为底物,通过UV-2550型紫外分光光度计得到相应的反应速率V,将米氏方程两侧取双倒数,以1/V~1/S线性拟合分析,得到‘忠薯1’过氧化物酶Lineweaver-Burk双倒数图(图 10),当1/V=0时,横坐标截距为-1/Km,求得该酶的Km值为52.833 mmol/L.
-
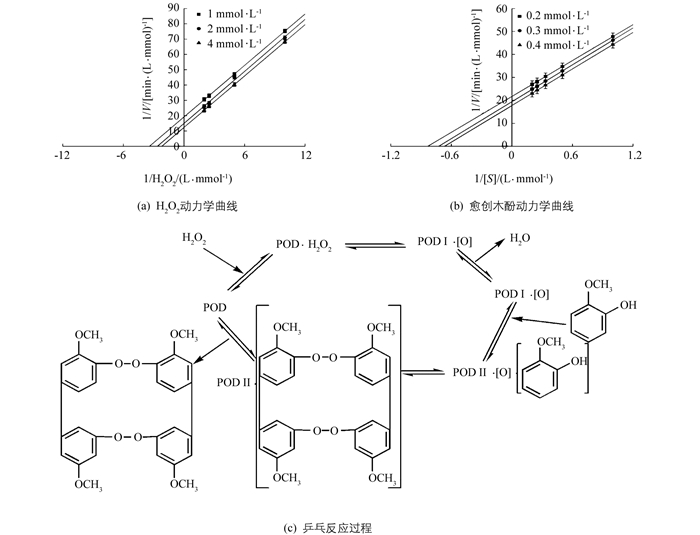
酶促双底物反应按照动力学机制分为序列反应和乒乓反应.乒乓反应类型特征是将其中一个底物固定在几个不同浓度范围内,用另一个底物浓度与反应速率作图,可以获得几组相互平行的直线,而在序列反应中,得到的却是相交的直线.通过Lineweaver-Burk双倒数作图可知,当固定不同浓度愈创木酚,过氧化氢浓度与反应速率的双倒数曲线相互平行;当固定不同浓度过氧化氢,愈创木酚浓度与反应速率的双倒数曲线相互平行(图 11a,b),表明在酶促动力学方面‘忠薯1’过氧化物酶的双底物酶促反应类型为乒乓反应且与底物反应存在先后顺序(图 11c).
2.1. 过氧化物酶分离纯化
2.2. 过氧化物酶分子质量测定
2.3. 最适pH和pH稳定性
2.4. 最适温度和温度稳定性
2.5. 金属离子对过氧化物酶影响
2.6. Km和反应速率测定
2.7. 过氧化物反应类型鉴定
-
本实验以‘忠薯1’为实验材料,通过一系列分离纯化技术后得到高纯度的过氧化物酶,与其他研究报道的过氧化物酶相比具有以下特点:取材便捷,原材料品质较高;成本低廉,纯化操作快速简便.由于纯化过程中,乙醇分级沉淀以及色谱层析柱纯化会除去一部分过氧化物酶,酶活力会有所下降.透析袋透析以及冷冻干燥会使酶暴露在外界环境中,会影响酶活性.纯化后该酶比活力为571 975.93 U/mg,高于藕带过氧化物酶比活力(1 272.74 U/mg)[19],高于大豆过氧化物酶比活力(4 432.52 U/mg)[20].纯化倍数为51.72,高于羊蹄叶(4.8)[21],沙田柚(26.22)[22].回收率为33.80%,高于韭菜(10.85%)[23],甘薯叶[24](1.59%).鉴于纯化后‘忠薯1’薯皮过氧化物酶比活力较高,无其他同工酶且纯化易操作等优点,可考虑充分利用废弃资源薯皮制备成商品化过氧化酶出售,也为后续深入研究甘薯酶促褐变打下基础.
本实验提取的‘忠薯1’过氧化物酶在pH值为4.0~7.0以及温度在30~70 ℃时都表现出较好的酶活性,pH值为4.0~6.0和温度在25~65 ℃范围孵育6 h,酶活性均高出100%,表现出良好的稳定性,表明该酶能够耐受一定的酸性和高温环境.最适pH和温度分别为6.2,65 ℃,其最适pH高于香草豆荚(3.8)[25],茶叶(4.5)[26],油棕叶(5.0)[27],与龙须菜(6.0)[28]较为接近.最适温度高于藜麦麸(60 ℃)[29],枇杷果肉(35 ℃)[30].该结果表明不同实验材料中过氧化物酶的酶学性质稍有差异,可以采用高温或热处理方式来控制甘薯褐变.亚基分子量为37.0 kDa,总分子量为37.2 kDa,与黄瓜(40.21 kDa)[31],莲藕(41.0 kDa)[32]接近.
Co2+,Mg2+,Cu2+,Fe3+对该酶有很强的激活作用,原因可能是金属通过促进底物与酶结合位点结合激活该酶. Fe3+是大多数植物过氧化物酶辅基卟啉环中心必不可少的部分,Fe3+参与了H2O2的结合和化合物I的形成[2];Ca2+作为一种辅助因子能维持酶活性位点的构象完整性,对酶活性有激活作用;Pb2+作为重金属离子对该酶活性影响最大,原因是Pb2+容易破坏蛋白质的二硫键,影响了酶的结构稳定性,使得活性降低,表明Pb2+是酶促褐变反应的有效抑制剂[33].该研究结果表明金属离子也能有效控制甘薯褐变.
通过动力学方法测得‘忠薯1’过氧化物酶Km为52.833 mmol/L,通过分别固定双底物H2O2、愈创木酚浓度得到‘忠薯1’过氧化物酶反应类型为乒乓机制.此结论与棕树、大豆、鹰爪豆过氧化物酶反应类型一致[34-36].并对当前‘忠薯1’过氧化物酶的研究起到了补充作用,为控制甘薯酶促褐变提供了方向.
综上所述,本实验通过生物化学手段从甘薯中成功分离出高活性、耐酸耐热的‘忠薯1’过氧化物酶,并对相关的酶学性质进行了研究,掌握了‘忠薯1’过氧化物酶的酶学特性.研究结果将有助于开发出控制鲜切甘薯褐变的新工艺和方法,为进一步揭示甘薯褐变分子机制和筛选出高效无毒害抑制剂提供了理论基础.同时可以进一步充分利用废弃资源薯皮制备成商品化的过氧化物酶出售,充分挖掘甘薯的潜在价值,拓展了甘薯的应用范围.








 DownLoad:
DownLoad: