-
开放科学(资源服务)标志码(OSID):

-
猫传染性腹膜炎病毒(FIPV)可导致猫科动物传染性腹膜炎(FIP)的发生,使猫科动物内脏器官出现肉芽肿病变、腹腔出现大量腹水以及腹膜出现炎症[1]. FIP的流行病学特点是传染率和死亡率都比较高,感染途径主要是口鼻,经呼吸道、消化道或昆虫媒介进行传播[2]. 目前研究表明,猫传染性腹膜炎病毒是因猫冠状病毒发生突变而产生的[3]. 猫冠状病毒突变为猫传染性腹膜炎病毒后,在巨噬细胞内进行复制,然后脱离肠道转移至脏器或腹腔,从而引发传染性腹膜炎[4]. 迄今为止该病仅能做到在临床上缓解轻微症状,延长患猫的寿命,但难以治愈[5]. 目前使用常规疫苗和重组疫苗对猫传染性腹膜炎进行预防均没有取得理想的效果. 研究发现,FIPV的感染具有抗体依赖性增强现象[6],而大部分猫体内都存在猫冠状病毒,如果接种强毒株反而会加剧猫传染性腹膜炎的发作.
猫传染性腹膜炎病毒主要编码了刺突蛋白、膜蛋白、小包膜蛋白和核衣壳蛋白4种结构蛋白[7]. 研究表明,冠状病毒的核衣壳蛋白(Nucleocapsid protein,N蛋白)作为一个多功能蛋白,能包装病毒的基因组形成核糖核蛋白复合体,与病毒的基因组之间存在相互作用,这对病毒粒子的装配有重要影响[8]. 同时,N蛋白作为免疫原性最强的蛋白,其对应的抗体是最早产生的,所以N蛋白常被用来作为早期诊断的指标[9]. 本实验在前人研究的基础上,对FIPV的N基因进行了克隆和原核表达,并以纯化后的重组N蛋白作为抗原皮下免疫比利时兔,制备出了相应的多克隆抗体. 旨在为进一步研究N蛋白的生物学功能奠定基础,同时丰富FIPV检测技术体系以及为FIP的进一步研究和临床治疗奠定基础. 此外有研究表明,FIPV与猪传染性胃肠炎病毒(TGEV)有相近的抗原性,FIP病猫的血清和腹腔液中可检出对TGEV的高价中和抗体[10]. FIPV N蛋白多抗的制备,也为进一步研究FIPV与TGEV之间的关系提供了可能.
HTML
-
含FIPV病料收集自重庆市某动物医院患病致死猫. 经基因测序鉴定后,放置于-80 ℃速冻保存备用.
山羊抗鼠HRP-IgG,山羊抗兔HRP-IgG购自BBI公司,FIPV N蛋白鼠源单克隆抗体为实验室保存;氯霉素,卡那霉素,DL 1 000 Marker,DL 5 000 Marker,DL 10 000 Marker,2×Taq Master Mix,PrimeScriptTM RT Master Mix购自TaKaRa公司;E.Z.N.A.TM Gel Extraction Kit DNA购自Omega Bio-tek公司;Enhanced BCA Protein Assay Kit试剂盒购自上海碧云天生物技术有限公司;LB购自Biowest公司;蛋白纯化试剂盒ProteinIso Ni-NTA Resin购自北京Transgen公司.
-
根据FIPV转录组数据N基因的序列,采用Primer Premier 5.0软件设计特异性引物,并且在引物上增加限制酶EcoRⅠ和SalⅠ的酶切位点,预计扩增片段长度为967 bp,上下游引物信息见表 1. 引物均由生工生物工程(上海)股份有限公司合成.
-
采用Trizol试剂分别对因患FIPV而致死的猫肝脏、肾脏、胃、小肠等组织的总RNA进行提取,采用核酸测定仪检测总RNA的浓度和纯度,以提取的FIPV总RNA为模板,按照PrimeScriptTM RT Master Kit试剂盒说明合成cDNA.
-
以FIPV的cDNA为模板进行PCR扩增,反应体系(12.5 μL):2×Taq Master Mix 6.25 μL,上下游引物各0.5 μL,dH2O 4.25 μL,模板1 μL. PCR反应条件:94 ℃预变性3 min,94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min,共35个循环,72 ℃延伸10 min.
按照Omega Bio-tek的E.Z.N.A.TM Gel Extraction Kit DNA胶回收试剂盒进行PCR产物的回收,与pMD19-T载体进行连接,转化Trans5α感受态细胞,涂布于含16 μL IPTG(24 mg/mL)和38 μL X-GAL(20 mg/mL)的LB/Amp+琼脂平板中,于37 ℃恒温培养箱培养13 h,然后对阳性克隆进行菌液PCR鉴定.
-
将鉴定正确的质粒命名为pMD19-T-N,将pMD19-T-N和Pet-28a用EcoRⅠ和SalⅠ进行双酶切,将酶切产物进行切胶回收纯化,构建Pet-28a-N重组表达质粒,经菌液PCR、双酶切验证后,转入大肠杆菌Rosetta感受态细胞,挑取单菌落接种于LB(Kana+/Camr)的液体培养基中,于37 ℃下200 r/min振荡培养3 h,测菌液OD600值为0.6~0.8,加入IPTG进行诱导,具体浓度及时间见表 2,将菌液于4 ℃,7 500 r/min离心20 min,收集菌体,超声波破碎,分别收集上清和沉淀,并进行SDS-PAGE电泳检测. 检测到目的蛋白后,再分别参照表 2进行时间和IPTG浓度的优化.
-
采用镍柱亲和层析的方法对重组蛋白进行纯化. 首先分别用15 mL包涵体洗涂液Ⅰ-Ⅴ重悬包涵体沉淀,4 ℃,7 000 r/min离心20 min后,在包涵体中加入30 mL(pH值为8.0)8 mol/L尿素使其变性溶解,静置过夜;4 ℃,7 000 r/min离心20 min,收集上清,弃去沉淀,上清用0.45 μm滤器过滤. 再参照ProteinIso Ni-NTA Resin的具体步骤进行蛋白纯化,SDS-PAGE检测最适纯化结果,以最佳咪唑浓度对蛋白进行纯化. 将纯化的N蛋白进行Western Blot鉴定(一抗为FIPV N蛋白鼠源单克隆抗体,二抗为山羊抗鼠HRP-IgG抗体).
将洗涤后的包涵体用PBS缓冲液重悬,具体步骤参照Enhanced BCA Protein Assay Kit试剂盒进行. 之后将处理后蛋白标准和包涵体沉淀按照2,4,6,8,10 μL的体积加入到SDS-PAGE胶的泳道内进行跑胶. 跑胶完成后利用Image J软件计算出蛋白灰度值,再根据公式
$ {C_测} = \frac{{{C_标} \times {C_标} \times {V_测}}}{{{V_标} \times {C_测}}}$ ,测出重组N蛋白的浓度,式中,C测为待测蛋白浓度,G测为待测蛋白灰度值,V测为待测蛋白加样体积,C标为标准蛋白浓度,G标为标准蛋白灰度值,V标为标准蛋白加样本体积. 用洗涤过后的包涵体蛋白跑SDS-PAGE胶,跑胶后KCl染色,将目的蛋白的条带切下. 收集切下的目的蛋白条带于50 mL灭菌离心管内,用组织匀浆器进行冰浴研磨,直至研磨均匀,-20 ℃保存备用. -
选择2只健康的比利时雄兔在脊柱两侧皮下进行多点注射免疫,采用1,15,30,45 d的免疫周期,免疫剂量为100 μg/kg. 首次免疫周龄为12周龄,体质量为2.5 kg. 免疫30 d后耳缘静脉采血2 mL,将装有血液的EP管呈45~60度角于室温放置1 h,4 ℃静置过夜. 用移液枪将析出的血清转移至1.5 mL EP管内,4 ℃,2 500 r/min离心30 min,分装至PCR管内,封口膜封口后-80 ℃保存备用. 免疫后45 d于耳缘静脉采血2 mL,步骤同上.
Western Blot鉴定多克隆抗体与重组N蛋白的反应性. 将制备的多克隆抗体用TBST按1∶1 000,1∶2 000,1∶4 000,1∶6 000的比例稀释作为一抗. 将山羊抗兔HRP-IgG用TBST按1∶5 000的比例稀释作为二抗.
以实验得到的多克隆抗体作为一抗对病死猫的低温恒冷组织切片进行免疫组织化学实验以验证其是否具有特异性,并以实验室保存的FIPV鼠源单克隆抗体制备的免疫组化切片作为阳性对照. 本实验中,FIPV鼠源单克隆抗体使用山羊抗鼠HRP-IgG,制备的FIPV兔源多克隆抗体使用山羊抗兔HRP-IgG作为二抗,最后使用DAB显色液进行显色、染色.
1.1. 材料
1.2. 方法
1.2.1. 引物的设计与合成
1.2.2. FIPV总RNA的提取及反转录
1.2.3. N基因的克隆
1.2.4. N蛋白的原核表达
1.2.5. N蛋白的纯化及鉴定
1.2.6. 多克隆抗体的制备、特异性鉴定
-
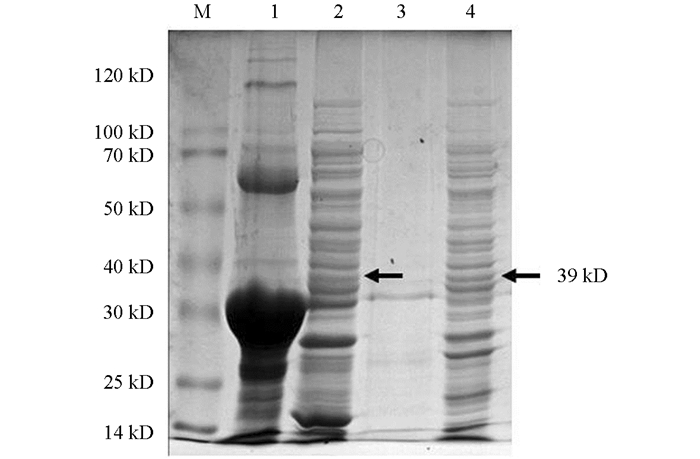
分别对病死猫肝脏、肾脏、胃、小肠等组织进行检测,电泳检测显示所有组织的PCR产物中均可见1条约967 bp特异性条带(图 1a). 将该序列克隆至pMD19-T载体,测序结果显示序列长度为3 659 bp(含限制性内切酶识别序列和保护碱基);通过ORF Finder预测N基因的开放阅读框,可知该基因从第1个碱基到第1 131个碱基为一个完整的CDS,共编码377个氨基酸,编码的蛋白为N蛋白. 将该CDS序列克隆至Pet-28a表达载体,经双酶切鉴定,结果表明目的基因成功连接到Pet-28a载体上(图 1).
-
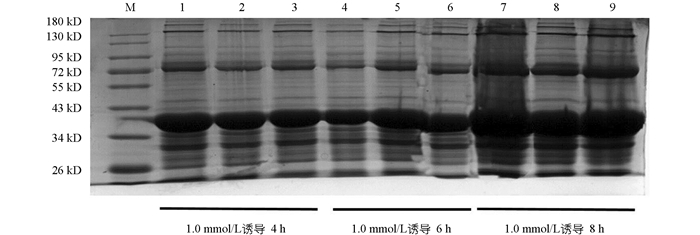
将阳性重组质粒Pet-28a-N转化至大肠杆菌Rosetta感受态细胞后,在IPTG诱导下重组N蛋白以包涵体形式表达,蛋白的大小约为39 kD,与理论预测值相符(图 2). 对诱导表达条件进行优化,诱导温度为16 ℃,诱导时间为8 h,IPTG浓度为1.0 mmol/L时为诱导最佳条件,目的蛋白表达效率最高(图 3和图 4).
-
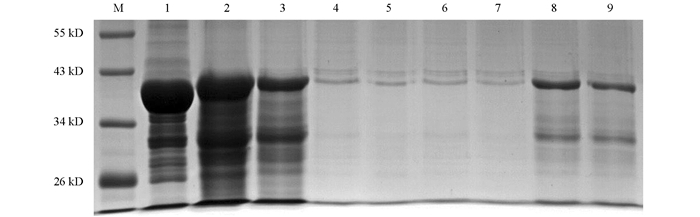
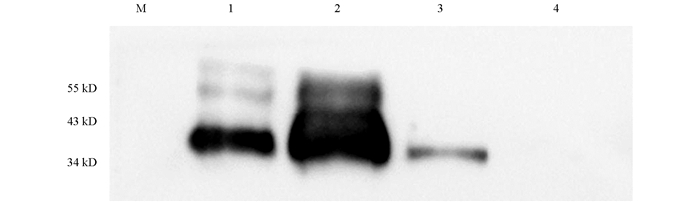
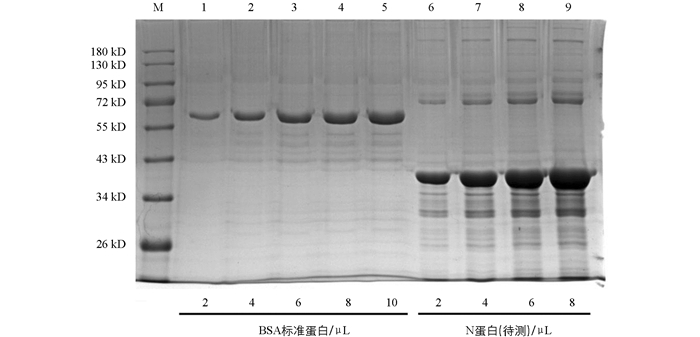
利用优化的条件大量诱导表达重组蛋白,参照Transgen的ProteinIso Ni-NTA Resin对变性后的N蛋白进行4次纯化,结果如图 5. 洗脱后经检测在39 kD处有目的蛋白,与预期大小相符. 将纯化的N蛋白进行Western-Blot鉴定,结果显示,在39 kD处出现的目的条带,与实际的N蛋白大小一致(图 6).
-
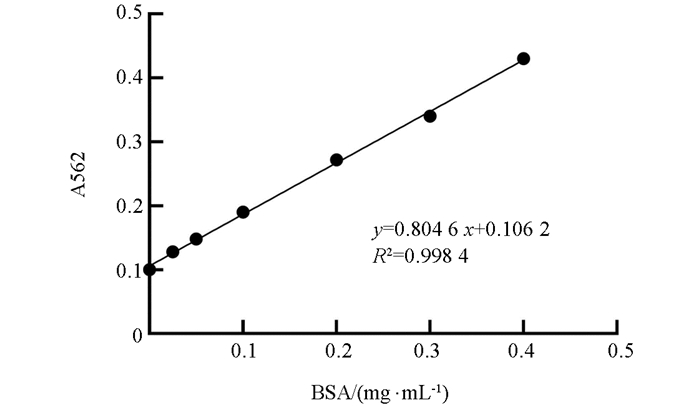
参照Enhanced BCA Protein Assay Kit试剂盒测包涵体总蛋白浓度,标准曲线如图 7. R2=0.998 4,表明拟合程度较好,根据标准曲线方程计算出包涵体总蛋白的浓度为1 320 μg/mL.
将处理后的标准蛋白和包涵体沉淀按照2,4,6,8,10 μL的体积加入到SDS-PAGE胶的泳道内,结果如图 8. 利用Image J软件,由灰度比和加样体积定量出N蛋白浓度为950 μg/mL.
-
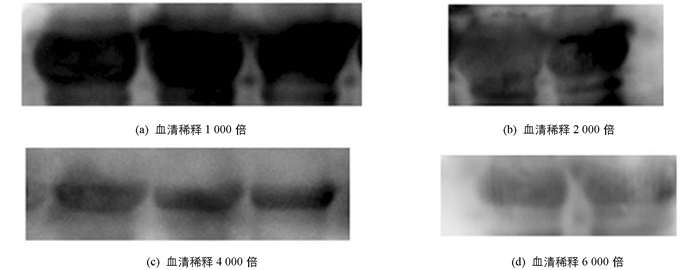
以采取到的耳缘静脉血清稀释后作为一抗、山羊抗兔HRP-IgG稀释后作为二抗,Western-Blot检测多克隆抗体与重组N蛋白的反应性,结果如图 9. 不同稀释度的多克隆抗体均能与重组N蛋白反应,表明家兔3免后可产生有效抗体,与重组N蛋白反应性良好,稀释度可达1∶6 000. 同时也发现,在将血清与TBST按照1∶4 000的比例进行稀释后,抗体的反应性最好.
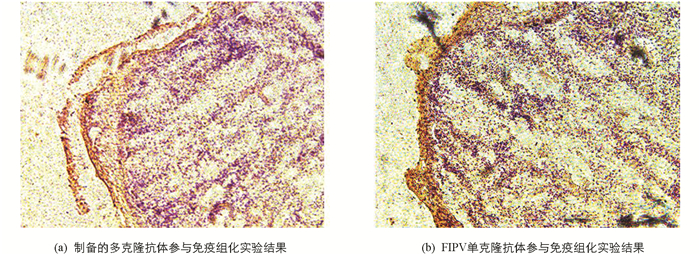
查阅DAB染液说明可知,经过DAB染液染色后HRP二抗呈现棕色. 将病变的肝脏组织免疫组化切片放在显微镜下观察,可在病变组织表层黏膜处发现明显阳性结果(图 10),因此可证明本实验制备的多克隆抗体能够较好地与FIPV特异性结合.
2.1. N基因的克隆及原核表达载体的构建
2.2. N蛋白的表达形式及条件优化
2.3. N蛋白的纯化及鉴定
2.4. 包涵体总蛋白与N蛋白浓度的测定
2.5. 多克隆抗体特异性鉴定
-
抗体作为一种研究工具,在目前的诊断、科研以及医学治疗等工作中起到举足轻重的作用[11]. 多克隆抗体是针对各种抗原决定簇产生的,其优点是制备周期相对较短,并且应用广泛,包括抗原物质的鉴别、定位、分析和纯化,以及作为疾病的诊断、检疫试剂和治疗制剂等[12]. 因此,在科研领域中多克隆抗体的使用相对较多.
本实验选用N蛋白作为抗原物质,主要是因为N蛋白作为FIPV的主要结构蛋白,与病毒的致病性密切相关,其不仅能与病毒基因组RNA结合,参与病毒的转录与复制,而且具有较强的抗原性,诱导的细胞免疫应答能促进病毒清除[13]. 用纯化后的N蛋白作为抗原,能刺激网状内皮细胞系统产生相应的抗体. 而本研究选用雄性家兔作为免疫对象来制备多克隆抗体,原因是家兔是最适合制备抗体的动物,制备后可采集量较大,性格相对温顺,易于进行免疫注射和采血操作[14]. 选用雄性家兔不仅可避免雌性家兔因性周期带来免疫系统的波动,也可避免因雌性家兔妊娠而使实验被迫终止.
Pet系统载体是目前应用最广泛的表达载体[15]. 其宿主菌Rosetta为高效率表达菌株,生长速度快,可在短时间内产出大量蛋白[16]. 然而,表达速度过快容易导致蛋白质二硫键不能进行正确的配对,过多蛋白间的非特异性结合,从而形成不可溶形式的包涵体[17]. 为了获取天然有活性的目的蛋白,包涵体首先需要进行纯化,然后使用变性剂进行变性溶解,再进行复性操作,去除变性剂[18].
实验过程中通过蛋白切胶回收可以获得纯度较高的蛋白,但该方法操作略显烦琐,难以大批量纯化蛋白,因此,重组N蛋白的纯化与复性条件还需要进一步的探索. 含有目的蛋白的SDS-PAGE胶研磨后无需与免疫佐剂混合可直接免疫动物,原因是聚丙烯酰胺可以作为佐剂,提高抗原对机体的免疫原性,延缓抗原的释放,延长抗原在体内的停留时间,从而提高产生抗体的效价[19]. 一般情况下,二免后即可耳缘静脉采血分离出血清,通过Western-Blot与免疫组织化学方法检测抗体的特异性并初步检测其效价.
本实验对FIPV的N基因进行了克隆与原核表达,并利用纯化后重组N蛋白免疫家兔制备出多克隆抗体,为下一步包被N蛋白建立间接ELISA检测未知抗体或包被纯化后的多克隆抗体建立双夹心法ELISA检测未知抗原打下坚实基础. N基因的表达为进一步研究N蛋白在感染过程中的作用机理及基因工程亚单位疫苗的研制奠定了基础. 然而,重组N蛋白的纯化与复性的条件、多克隆抗体纯化方式的优化还需要进一步研究.








 DownLoad:
DownLoad: