-
开放科学(资源服务)标志码(OSID):

-
水稻是重要的粮食作物,提高水稻产量是每个育种家的不懈追求[1]. 然而,水稻产量的形成是复杂的,往往与株高、有效穗数、每穗粒数和千粒质量等密切相关. 株高决定水稻生物量,植株过高易引起倒伏,从而影响光合效率. 因此,合适的水稻植株高度对提高产量至关重要. 同时,细胞扩张会影响粒型,粒型影响千粒质量,也是产量的决定性因素之一. 然而,这些性状均由多个基因控制,遗传机制非常复杂,属于典型的数量性状[2-5]. 随着分子标记技术的快速发展,研究人员通过构建不同的遗传群体对水稻农艺性状进行了QTL定位分析[6]. 利用传统分离群体(如F2,F2:3,重组自交系和双单倍体系进行株高和粒型的QTL定位,郑跃滨等[7]以短粒普通野生稻突变体和长粒栽培稻品种KJ01构建的F2分离群体,检测到24个控制水稻粒型的QTLs;Zhou等[8]以广占63-4S和TGMS29为亲本构建的F2及其衍生的F2:3群体共检测到36个粒型QTLs;Liu等[9]利用两个籼稻品种Taifeng B和Tesanai 2为亲本构建的170个家系的重组自交系(Recombinant Inbred Lines,RILs)群体共检测到34个控制水稻粒型的QTLs;封功能等[10]利用籼粳交组合Nanjing 11号×Balilla创建的DH群体,鉴定出50个与产量相关性状的QTLs. 然而,由于初级分离群体中个体间遗传背景的干扰常使QTL定位不准确,也较难直接与育种应用相结合,一定程度上限制了这些QTL的进一步克隆和育种. 为了提高QTL的定位准确度,且实现QTL定位和设计育种的一体化,染色体片段代换系(Chromosome segment substitution lines,CSSL)、近等基因系(NIL)等次级作图群体逐渐受到研究者的青睐. 水稻染色体片段代换系是创造自然变异的理想材料,同时又可将多位点控制的复杂性状进行遗传分解,尤其定位出的QTL可直接应用于育种实践,因而是理想的遗传研究材料[11]. 姚国新等[12]利用大粒品种SLG-1与小粒日本晴杂交、回交构建的一套关于千粒质量和粒型的姊妹近等基因系(Sister Near-isogenic Lines,SNILs)群体,并检测到12个QTLs;游佳等[13]以‘9311’为受体亲本,普通野生稻为供体亲本创建的染色体片段代换系群体共定位到水稻千粒质量、粒长、粒宽和长宽比等性状的16个QTLs;Fan等[14]以HHZ为受体亲本,BAS为供体亲本构建的染色体片段代换系群体,检测到25个QTLs. 本课题组也分别以日本晴和西恢18为受体亲本创建了两套水稻染色体片段代换系,并进行了一些产量相关性状的QTL定位和QTL聚合分析,如Liang等[15]以西恢18为受体亲本和沪旱3号为供体亲本构建的7代换片段CSSL-Z563为材料鉴定出11个水稻粒型QTLs;Sun等[16]以西恢18为受体亲本和沪旱3号为供体亲本构建的6代换片段水稻CSSL-Z431为材料鉴定出13个水稻穗数和粒型QTLs;Wang等[3, 17]以日本晴为受体亲本和西恢18为供体亲本构建的2个CSSL-Z747和CSSL-Z749为材料分别鉴定出46个和15个水稻产量相关性状QTLs;Ma等[18-19]以日本晴为受体亲本和西恢18为供体亲本构建的3代换片段CSSL-Z1364和6代换片段CSSL-Z744为材料分别鉴定出8个和17个水稻产量相关性状QTLs;Wang等[20]以日本晴为受体亲本和西恢18为供体亲本构建的6代换片段CSSL-Z741为材料鉴定出20个水稻重要农艺性状QTLs;Zhang等[21]以日本晴为受体亲本和西恢18为供体亲本构建的3代换片段CSSL-Z741为材料鉴定出7个水稻粒型QTLs. 由于这些CSSL所含的代换片段各不相同,且检出不同性状的QTL,为以CSSL为平台的水稻设计育种计划奠定了良好的基础.
尽管定位了大量水稻产量相关性状的QTL,但由于水稻株高、粒型等性状受多个QTL控制,要实现全基因组水稻分子设计育种,有必要鉴定出更多的有利QTL,且将这些QTL分解到单个单片段代换系(Single segment substitution lines,SSSL)中,以便更精准地研究单基因功能和实现设计育种操作. 因此,本研究在6代换片段的染色体片段代换系Z744重要农艺性状QTL定位的基础上[19],以受体日本晴与Z744杂交后代中进一步选育的矮秆、长粒水稻染色体片段代换系Z688为研究材料,进行水稻株高、粒型性状的QTL定位,并进一步培育目标QTL的纯合和杂合单片段代换系,研究来自供体西恢18等位基因的加性和显性效应,为设计育种提供重要遗传信息.
HTML
-
本研究使用的材料是4代换片段的水稻矮秆长大粒染色体片段代换系Z688. Z688在Ma等[19]培育的6代换片段代换系Z744(平均代换长度为2.72 Mb)的QTL定位基础上选育而成的. Z744以日本晴为受体亲本,西恢18为供体亲本,经高代回交和自交,以水稻全基因组选出二者间有多态性的263个SSR标记[22],从BC2F1开始分子标记辅助选择(Molecular marker-assisted selection,MAS),每代每个株系选20株,继续MAS选择,在日本晴/BC2F4的F6代选出了6代换片段的水稻纯合染色体片段代换系Z744[19]. 本研究从受体日本晴与Z744杂交的F2:3群体(经QTL初定位[19])进一步MAS选育出1个纯合4代换片段的矮秆长粒染色体片段代换系Z688. 选择过程中,与受体日本晴带型一致时标“A”,与供体西恢18的带型一致时标“B”,杂合带型标“H”. Z688的代换片段鉴定参照Liang等[15]描述的方法,估计代换片段长度计算参照Paterson等[23]的方法进行.
-
2019年在西南大学水稻基地(重庆市歇马镇),以日本晴与Z688杂交,收取杂交种并于同年在海南基地种植F1,并收取F1种子. 2020年3月8日,在西南大学水稻基地育苗,4月15日,以株距和行距分别为16.67 cm和26.67 cm移栽日本晴和Z688各30株,用于QTL定位的150个单株组成的F2群体于同一试验田,按常规模式进行田间管理. 2021年3月10日,在西南大学水稻基地对日本晴,Z688和从F2群体选出的10个单株进行育苗,于4月18日,将日本晴,Z688和10个株系(Z1038-Z1047)各移栽30株,按常规方式进行管理.
-
成熟后,平地面收取日本晴和Z688各10株以及150株F2群体. 考察株高、10粒长、10粒宽、千粒质量,然后用粒长除以粒宽计算长宽比. 具体参照Wang等[20]描述的方法测定,株高用5 m卷尺测定从地面到每株最长穗顶端的距离. 每株选30粒饱满一致的籽粒,随机将10粒分别按长和宽首尾相连,然后用20 cm直尺测量其总长度和总宽度,重复3次,平均数计为10粒长度和10粒宽度,然后换算为每粒长和宽. 谷粒长宽比以粒长与粒宽的比值计算. 对于日本晴和Z688的千粒质量,随机选取3 000粒,然后用电子天平每1 000粒为1组进行测量,重复测定3次. 对于QTL定位群体的千粒质量测量,则每株随机取200粒,用电子天平测量,重复3次,然后乘以5计算. 最后,使用Microsoft Excel 2016统计10株日本晴和Z688及F2群体每株性状的平均值和标准差,并进行t测验.
-
以日本晴与Z688杂交构建的由150个单株组成的次级F2群体作为QTL定位群体,用十六烷基三甲基溴化铵法(CTAB)法提取亲本和150个F2单株的DNA,参照Zhao等[24]描述的方法进行PCR扩增和非变性聚丙烯酰胺凝胶电泳. 将日本晴带型、Z688带型、双亲带型、缺失带型基因型赋值,分别用“-1”“1”“0”和“.”来表示. 结合150个F2单株对应的表型值,使用SAS9.3统计软件(SAS Institute Inc,Cary,NC,USA)的混合线性模型(Mixed linear model,MLM)法进行QTL定位[24],以p<0.05为阈值,决定QTL是否存在.
-
根据2020年QTL定位信息,从F2选择10个含目标QTL的单株(仅含纯合或杂合目标代换标记,其余标记带型与受体日本晴一致),2021年种成株系(Z1038-Z1045),每个株系取30株的叶片提取DNA,利用MAS对其中的目标代换标记进行进一步跟踪筛选,选育出纯合的SSSL和杂合的SSSL(H). 于2021年7月下旬,收获10株日本晴和选育出的SSSL及SSSL(H)的所有单株(8~10株),按相同的方法测量株高、粒长、粒宽、长宽比和千粒质量,用于纯合目标QTL的加性效应和杂合QTL的显性效应分析.
-
对于纯合SSSL(S1-S4),首先假设H0:SSSLi的代换片段不存在控制某一性状的QTL,然后对每个SSSL和受体日本晴性状进行t测验,若p<0.05时,表明SSSLi的代换片段存在控制某一性状的QTL. 根据在特定环境条件下,日本晴的遗传模型为
和单片段代换系的遗传模型为
式中,μ为日本晴某一性状的表型值,ai为QTL的加性效应,pi和p0分别表示SSSL和日本晴的表型值,ε为随机误差[15].
我们可估计出该QTL的加性效应(ai)为
表型差一半被估算为由遗传引起.
所有计算均在Microsoft Excel 2016中进行.
-
对于杂合SSSL(H),首先假设H0:呈杂合状态时的SSSLi(H)不存在显性效应d,即
式中,pi(H),p0和pi分别为SSSLi(H),日本晴和SSSLi的表型值,然后对pi(H)和(p0+pi)/2做t测验,若p<0.05,则说明H0不成立,即该代换片段所含控制某一性状的QTL存在显性效应d. 根据显性效应原理,杂合SSSLi(H)的显性效应(di)为
所有计算均在Microsoft Excel 2016中进行.
1.1. 试验材料
1.2. 植物材料与田间种植
1.3. Z688的株高、粒型性状评价
1.4. QTL定位
1.5. 目标QTL的纯合和杂合单片段代换系选育及QTL加性和显性效应分析
1.5.1. 基于4个纯合SSSLs的QTL加性效应分析
1.5.2. 基于4个杂合SSSL(H)的QTL显性效应分析
-
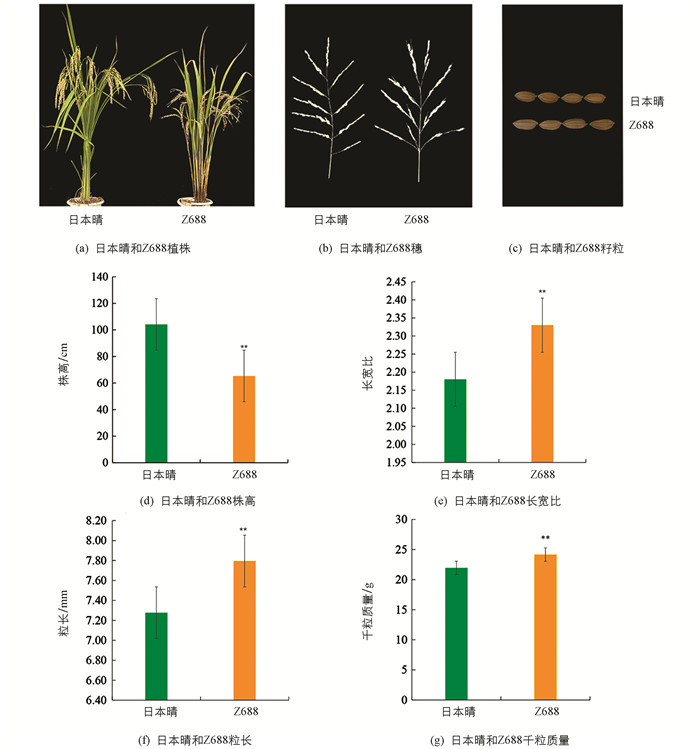
Z688含有来自西恢18的4个染色体代换片段,分布于水稻第1,2,6和12染色体上(图 1),其总代换片段的估计长度为8.53 Mb,最长代换片段的估计长度为5.06 Mb,最短为0.55 Mb,平均为2.13 Mb.
Z688的株高(65.29 cm)显著矮于受体日本晴(104.11cm),比日本晴降低了38.82 cm(图 2a,d);Z688的长宽比(2.33)比日本晴(2.18)显著增加了0.15(图 2c,e);Z688的粒长(7.80 mm)比受体日本晴(7.28 mm)显著增加了0.52 mm(图 2c,f);Z688的千粒质量(24.16 g)比日本晴(21.94 g)显著增加了2.22 g(图 2g).
-
以日本晴和Z688杂交构建的次级F2群体共鉴定出7个控制Z688株高与粒型性状的QTLs,分布于第1,第6和第12染色体的代换片段上,解释了从0.84%到23.94%的表型变异(表 1). 来自西恢18的主效qPH1-1和微效qPH1-2与Z688的矮秆性状连锁,均位于第1染色体的代换片段上,连锁于不同的分子标记,其加性效应分别使株高减少了3.20 cm和2.16 cm,分别解释了15.00%和0.84%的株高变异. 来自西恢18的2个主效qGL1和qGL6及微效qGL12与Z688的粒长性状连锁,其加性效应分别使Z688的粒长增加了0.11 mm,0.09 mm和0.06 mm,分别解释了23.94%,15.36%,8.83%的粒长变异. 来自西恢18主效qGWT1影响Z688的大粒,其加性效应使千粒质量增加了0.66 g,解释了9.76%的表型变异. 此外,qPH1-1,qRLW1,qGL1和qGWT1连锁于同一标记RM128.
在qPH1-1的代换区间内有已克隆基因OFP3和OsHXK6,在qPH1-2的代换区间内有已克隆基因OsERF3和PSD1,在qGWT1的代换区间内有已克隆基因OsMKKK55,OsMKKK70和OsMKKK62(表 1).
-
基于QTL定位,通过MAS在F3群体选育出5个纯合单片段代换系SSSLs(S1-S5)和5个对应的杂合单片段代换系(S1(H)-S5(H)). S1的代换片段为RM403-RM128-RM1268,位于第1染色体上,估计代换长度为0.67 Mb;S2的代换片段为RM128-RM6950-RM5389,位于第1染色体,估计代换长度为1.82 Mb;S3的代换片段为RM3294-RM6378-RM2483,位于第2染色体上,估计代换长度为0.55 Mb;S4的代换片段为RM400-RM7412-RM439-RM494-RM20769,位于第6染色体上,估计代换长度为2.20 Mb;S5的代换片段为RM6288-RM247-RM491,位于第12染色体上,估计代换长度为0.72 Mb(表 2).
在2020年定位的7个QTLs中,有6个(qPH1-1,qPH1-2,qGL1,qGL12,qRLW1和qGWT1)可被相应的纯合单片段代换系(S1-S5)在2021年验证. 此外,在这5个纯合单片段代换系中还新检测到11个QTLs,分别为qPH2,qGL1-2,qGL2,qGW1,qRLW1-2,qRLW2,qRLW12,qGWT1-2,qGWT2,qGWT6和qGWT12. 这些结果表明,由于单片段代换系消除了个体间遗传背景的干扰,SSSL具有比F2群体更高的QTL检测效率(表 2).
我们还利用5个杂合单片段代换系(S1(H)-S5(H))对QTL的显性效应进行了分析,结果表明,杂合位点QTL的显性效应也对表型有较大的影响(表 2).
利用纯合的单片段代换系和杂合的单片段代换系可反映出纯合位点加性效应和杂合位点显性效应同时影响株高的遗传. 位于第1染色体的来自西恢18的qph1-1,qPH1-2和位于第2染色体的qPH2的加性效应分别使株高降低11.34 cm,1.76 cm和2.41 cm,qPH1-1/qph1-1的显性效应使株高增加12.58 cm,暗示来自西恢18的株高qph1-1表现为相对隐性,而来自日本晴的qPH1-1则相对显性. qPH1-2/qph1-2和qPH2/qph2的显性效应分别使株高降低2.25 cm和2.85 cm,表明来自西恢18的株高qPH1-2和qPH2等位基因表现为相对显性,而来自日本晴的qph1-2和qph2相对隐性(表 2). 这些结果表明,株高的表型是这些QTL的加性效应和显性效应的叠加效应,揭示了遗传复杂的数量性状可通过单片段代换系的构建分解为单位点进行研究.
对于粒长性状,来自西恢18的qGL1的加性效应在遗传上使S1的粒长增加0.11 mm,而来自西恢18的qGL1-2,qGL2和qGL12的加性效应使粒长分别减少了0.14 mm,0.08 mm和0.18 mm,qGL1/qgl1的显性效应使粒长增加了0.18 mm,表明来自西恢18的qGL1相对来自日本晴的qgl1表现显性. 对于减少粒长的qGL1-2,qGL2和qGL12对应的杂合位点没有检出显性效应(表 2). 同样表明,粒长是由多基因控制的数量性状,其长粒表型是多个QTL加性和显性效应的叠加.
来自西恢18的qGW1的加性效应使S1的粒宽增加0.05 mm,而在相应的杂合位点无显性效应(表 2),Z688的粒宽也与日本晴的差异无统计学意义.
对于水稻谷粒长宽比,来自西恢18的qRLW1的加性效应使长宽比增加0.01,而来自西恢18的qRLW1-2,qRLW2和qRLW12的加性效应分别使谷粒长宽比减少0.05,0.04和0.09. qRLW1/qrlw1的显性效应使谷粒长宽比增加0.04,表明来自西恢18的增加谷粒长宽比的qRLW1相对来自日本晴的qrlw1表现显性. qRLW2/qrlw2的显性效应使谷粒长宽比减少0.04,表明来自西恢18的减少谷粒长宽比的qRLW2对日本晴的qrlw2也表现相对显性. 另外,在其他杂合位点并未检出显性效应(表 2).
对于千粒质量,来自西恢18的qGWT1,qGWT1-2,qGWT2,qGWT6和qGWT12的加性效应分别在遗传上使千粒质量增加1.78 g,1.30 g,1.43 g,1.50 g和1.32 g,qGWT1/qgwt1,qGWT1-2/qgwt1-2,qGWT2/qgwt2,qGWT6/qgwt6和qGWT12/qgwt12的显性效应分别使千粒质量增加2.48 g,0.86 g,1.39 g,1.39 g和1.08 g(表 2),表明来自西恢18的增加千粒质量的qGWT1,qGWT1-2,qGWT2,qGWT6和qGWT12相对日本晴的相应等位基因表现显性. 这些结果进一步验证了千粒质量是由微效多基因控制的数量性状,但可通过构建单片段代换系加以分解研究.
2.1. Z688的代换片段和差异性状统计分析
2.2. Z688代换片段携带的株高和粒型QTL
2.3. 目标QTL的次级单片段代换系(SSSLs)的培育及加性和显性遗传效应分析
-
水稻产量主要由3要素构成:有效穗数、每穗实粒数和千粒质量[30]. 千粒质量主要由粒长、粒宽和粒厚决定. 此外,水稻株高与产量的形成密切相关[31]. 本研究选育了1个以日本晴基因组为遗传背景含来自西恢18基因组的4代换片段的水稻CSSL-Z688,与日本晴相比,Z688的籽粒显著变长,千粒质量显著增加,其千粒质量的显著增加主要由籽粒长度变长引起,与Ma等[19]鉴定的水稻染色体片段代换系Z744的长粒表型相似,但Z688的水稻株高显著变矮. 矮秆突变的发现曾引起第一次绿色革命,矮秆基因是宝贵的遗传资源. 选育高度适中的水稻品种,不易倒伏,灌浆良好,是水稻理想的高产株型[32]. 因此,Z688为研究株高和粒型基因提供了良好的遗传资源. 水稻染色体片段代换系,与受体亲本相比,仅存在少量代换片段的差异,因而减少了遗传背景的干扰,是QTL准确定位的良好材料[24]. 通过染色体片段代换系的构建可将由多基因控制的数量性状进行分解,进而挖掘出更多的有利等位变异,为目标基因的遗传解析和水稻分子聚合育种奠定良好的基础[33-34].
经日本晴/Z688构建的次级F2群体的QTL定位,发现7个控制株高和粒型性状的QTLs,其中2个(qPH1-1和qPH1-2)使株高变矮,3个(qGL1,qGL6和qGL12)使粒长增加,1个(qRLW1)使谷粒长宽比增加和1个(qGWT1)使千粒质量增加. 此外,我们进一步分离出5个纯合单片段代换系(S1-S5)和5个杂合单片段代换系(S1(H)-S5(H)). 在5个纯合单片段代换系中,6个QTLs能够被验证,此外还新检出了11个QTLs. 与前人研究结果相比,发现编码卵形家族蛋白的OFP3[25]与编码己糖激酶的OsHXK6 [26]与株高qPH1-1的连锁标记RM128分别相距0.16 Mb和0.29 Mb;编码乙烯应答转录因子的OsERF3及编码光周期敏感的矮秆基因PSD1与株高qPH1-2的连锁标记RM6950分别相距0.84 Mb和0.63 Mb[27-28];编码丝裂原活化蛋白激酶的OsMKKK55,OsMKKK70和OsMKKK62与千粒质量qGWT1的连锁标记RM128分别相距1.80 Mb,1.81 Mb和1.82 Mb[29]. qGL1和qGWT1也被Ma等[19]利用日本晴为受体的水稻6代换片段CSSL-Z744鉴定出. 同时,也与李锋等[35]定位的qGL1-1,江静[36]定位的qGL1-1位于相近区间,两者qGL1-1可分别解释1.80%,16.2%的表型变异[35-36]. 而在本研究中qGL1对粒长的贡献率达到23.94%,表明qGL1可在多年多点、多个遗传背景下被检出,是遗传稳定的QTL,而且当遗传背景纯化后,其加性效应会更大. qGL6还能被沈文强等[37]、Zhang等[21]用不同的水稻染色体片段代换系检测到. qGL12与王大川等[3]、丁膺宾等[38]定位的QTL区间相近,表明这些QTL遗传稳定,在基因设计育种中有重要的价值. qGW1,qGL1,qGL6,qGL12,qRLW1,qRLW1-2和qRLW12还尚未见报道,可能是新鉴定的QTL,这些研究结果为后续功能研究奠定了良好基础.
加性效应和显性效应是水稻性状的重要遗传组成,了解目的基因的加性和显性效应对作物设计育种有重要意义. 本研究结果表明,其株高、粒型等性状的遗传受到多个QTLs加性和显性效应的共同影响,是其加性和显性效应的叠加. 如株高qph1-1,qPH1-2,qPH2的加性效应分别使株高降低11.34 cm,1.76 cm和2.41 cm. qPH1-1/qph1-1的显性效应使株高增加12.58 cm,而qPH1-2/qph1-2和qPH2/qph2的显性效应分别使株高降低2.25 cm和2.85 cm. 来自西恢18的qGL1的加性效应在遗传上使粒长增加0.11 mm,而来自西恢18的qGL1-2,qGL2和qGL12的加性效应使粒长分别减少了0.14 mm,0.08 mm和0.18 mm. qGL1/qgl1的显性效应使粒长增加了0.18 mm. 这些结果表明,遗传复杂的数量性状可通过单片段代换系的构建分解为单位点进行研究,而且通过多个单基因的聚合可揭示复杂性状的遗传组成,并预测聚合基因型的表型. Liang等[15]研究表明,在西恢18的遗传背景下,聚合加性效应为-0.86 mm的粒长qGL3-2与加性效应为-0.82 mm的粒长qGL3-1产生了-1.02 mm的加性×加性上位性互作效应,最终使该双基因聚合系产生了比单个单片段代换系更短的籽粒. Zhang等[21]在日本晴遗传背景下,加性效应为0.30 mm的粒长qGL5和加性效应为0.13 mm的粒长qGL6聚合产生了0.31 mm的加性×加性上位性互作效应,使双位点聚合系D2的粒长显著长于仅含单个粒长QTL的单片段代换系S2和S3. Liang等[15]认为以单片段代换系为平台的多基因聚合系的表现依赖于加性效应与上位性互作效应的代数和与单个QTL加性效应的比较,因此了解单片段代换系QTL的加性效应及其上位性互作效应对植物设计育种有重要意义. 此外,显性效应及显性×显性上位性互作效应是杂种优势利用的遗传基础,Zhang等[21]研究表明,杂种优势包括单座位的超显性效应、显性互补和上位性互作. 本研究首次利用杂合单片段代换系分析了水稻株高、粒长、粒宽、千粒质量等性状单座位的显性效应,各个性状都呈现出较大的显性效应,如qGWT1/qgwt1,qGWT1-2/qgwt1-2,qGWT2/qgwt2,qGWT6/qgwt6和qGWT12/qgwt12的显性效应分别使千粒质量增加2.48 g,0.86 g,1.39 g,1.39 g和1.08 g,因此本研究鉴定出的重要QTL的加性和显性效应,为以后利用这些QTLs进行设计育种提供了可靠的遗传信息.
-
本研究以受体日本晴和一个4代换片段的水稻矮秆长大粒染色体代换系Z688杂交构建的次级F2群体为QTL作图群体,鉴定了7个控制株高、粒长、长宽比和千粒质量的QTLs,并进一步培育了目标QTL的5个纯合单片段代换系和5个杂合单片段代换系. 其中6个QTLs能够被纯合单片段代换系所验证,此外还在单片段代换系上新鉴定出11个QTLs,分别为qPH2,qGL1-2,qGL2,qGW1,qRLW1-2,qRLW2,qRLW12,qGWT1-2,qGWT2,qGWT6和qGWT12,其中qGW1等7个QTLs尚未被报道. QTL加性和显性效应表明,株高、粒型、千粒质量等性状的遗传受到多个QTL的加性和显性效应的共同影响,暗示了遗传复杂的数量性状可通过单片段代换系的构建分解为单基因进行研究. 这些结果为以单片段代换系为平台的水稻分子设计育种提供了重要的遗传信息.







 DownLoad:
DownLoad: