-
开放科学(资源服务)标志码(OSID):

-
十字花科根肿病又称根瘤病,是由芸薹根肿病菌(Plasmodiophora brassicae Woron.)引起的一种土传病害,该菌专门为害十字花科植株根部[1],在白菜、甘蓝、花菜等蔬菜上为害严重,甚至会导致蔬菜大面积绝收,被称为十字花科蔬菜的癌症[2]. 根肿病的休眠孢子具有极强的生命力,在土壤中存活20年后仍能有侵染能力[3]. 根肿病菌侵染植株根部,初期外观症状不明显,侵染40~60 d后根部出现形状、大小不一的肿瘤. 主根上的肿瘤大而少,侧根上的肿瘤小而多,肿瘤一般呈纺锤形、圆筒形、手指形等. 发病初期植株生长缓慢、矮小,晴天中午出现萎蔫现象,后期地上部分叶片会变枯黄,严重时不生长甚至死亡[4]. 根肿病在全世界范围内均有发生. 解放前我国极少有关于该病的信息报道,1955年,黄齐望等在福州地区发现了该病[5],目前,我国大部分省(市、区)都有蔬菜根肿病的发生,特别在我国西南地区、长江中上游地区等为害严重[6]. 据统计,根肿病一般发生年份为害面积占十字花科种植区总面积的近1/3,大流行年份甚至可达3/4[7]. 重庆地区十字花科蔬菜种植产业也深受根肿病的困扰,以蔬菜种植产业为主的武隆区的仙女山片区进行的调查结果显示,仅2011年7月,白菜根肿病的发病率占蔬菜发病率的45%,其中发病较重地块占80%[8]. 2021年11月至2022年11月,武隆区选取4个乡镇的12个村开展了十字花科蔬菜根肿病发生情况调查,据不完全统计,武隆区因根肿病造成的直接经济损失每年高达6 000万元以上[9],严重影响蔬菜种植的积极性.
根肿病一直是国内外学者研究的热点,近几十年来,在抗病育种、生物防治、病原菌的检测、致病性分化、发生条件、流行规律等方面有不少的研究报道. 对重庆地区根肿病的研究多集中在抗性种质、综合防治方面,少有报道根肿病菌的生理小种及其生物学特性. 本研究对重庆市内甘蓝种植区及发生根肿病的5个区县进行采样,对样品进行检测分析,以期初步了解重庆市甘蓝根肿病病原菌的生理小种及其生物学特性,为解决重庆市甘蓝根肿病成灾的问题提供理论依据.
HTML
-
2023年9—10月对重庆市内甘蓝根肿病发生严重的5个区县进行样品采集,具体采样地点详细信息如表 1所示. 每个采样点取6~10株发病甘蓝根际土壤和根肿组织:根际土壤于阴凉处风干后备用;根肿组织病样带回实验室及时清洗干净,晾干表面水分后装入自封袋中,标明采样编号、地点,存入—20 ℃冰箱备用.
-
研究报道目前我国十字花科蔬菜根肿病菌以4号生理小种为主[10-11],受试验材料限制,本研究参考易春霖等[12]通过转录组测序筛选出的特异鉴定根肿病菌4号生理小种的方法来初步鉴定采集的重庆市甘蓝根肿病是否以4号生理小种为主要生理小种. 具体方法如下:
采用高效植物基因组DNA提取试剂盒,天根生化科技(北京)有限公司生产(DP350),对根肿组织总DNA进行提取. 本试验以4号生理小种(由西南大学天然产物农药研究室提供[13])为阳性对照(CON1),以采集的健康甘蓝根部组织为阴性对照(CON2),以清水为空白对照(CON3). 设计4号生理小种分子标记基因PBRA-000030的特异性引物,以提取的DNA样本为模板采用常规PCR技术,利用Phanta® Max Super-Fidelity DNA Polymerase(南京诺唯赞生物科技股份有限公司,P505-d1)试剂进行扩增检测.
-
供试根肿病菌:根据生理小种鉴定结果和采样点地理信息综合考量选择WX2、WL1两个根肿样品.
供试试剂:蔗糖、Hoagland营养液、1%地衣红染色液,0.5%伊文思蓝染色液.
-
1) 孢子悬浮液配制. 采集的甘蓝根肿组织用自来水冲洗干净后再用无菌水冲洗3次. 将组织加无菌水磨成匀浆,16层纱布过滤,弃沉淀. 将滤液移入50 mL离心管中,4 ℃ 3 000 r/min离心20 min,弃上清液,沉淀重悬于40 mL无菌水,4 ℃ 3 000 r/min离心20 min,重复上述步骤2~3次. 弃上清液,在沉淀中加入5 mL 50%蔗糖溶液,混匀后,4 ℃ 3 000 r/min离心10 min,将上清液轻轻移入50 mL离心管,加入30 mL灭菌水,4 ℃ 3 000 r/min离心10 min,弃上清液,沉淀重悬于30 mL灭菌水,4 ℃ 3 000 r/min离心10 min,最后沉淀悬于40 mL灭菌水. 通过血球计数法稀释根肿病滤液至终浓度1×108个/mL.
2) 病原孢子萌发测试[14]. 病原孢子萌发测试主要采用伊文思蓝染色法和地衣染色法.
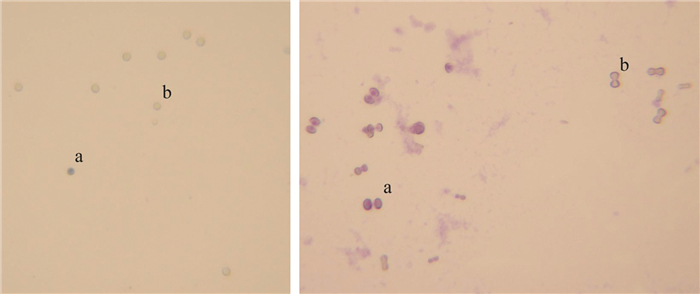
伊文思蓝染色:吸取一滴孢子悬浮液于载玻片上,在常温下烘干,0.5%伊文斯兰染液染色约10 min,无菌水冲洗干净,盖上盖玻片,显微镜下观察孢子的染色情况. 依据活性的细胞对伊文斯兰具有排斥作用不易着色的原理,故染成深蓝色的是已经丧失活性的休眠孢子,而未染色的则是具有活性的休眠孢子. 染色情况如图 1A所示,说明伊文思蓝染色方法可行,可用此方法对休眠孢子活性率计数.
地衣红染色:吸取一滴孢子悬浮液于载玻片上,在常温下烘干,用1%地衣红染色10~15 s,无菌水冲洗干净,盖上盖玻片,在显微镜下观察孢子的染色情况. 已萌发的休眠孢子不染色,没有萌发的休眠孢子被染成红色. 染色情况如图 1B所示,说明地衣红染色方法可行,可用此方法对休眠孢子萌发率计数.
-
1) 培养体系pH条件对休眠孢子萌发的影响[14]. 将休眠孢子悬浮液用过滤灭菌的Hoagland营养液稀释至浓度为103个/mL(显微镜下的每个视野100~200个孢子),然后用1 mol/L NaOH和1 mol/L HCl溶液分别将孢子悬浮液调至pH值依次为4、4.5、5、5.5、6、6.5、7、7.5、8、8.5、9(pH值用pH计测定),置于24 ℃、黑暗条件下培养,7 d后镜检观察休眠孢子萌发情况.
2) 致死温度的测定. 将孢子悬浮液用无菌水稀释,取200 μL于灭菌的离心管(北京兰杰柯科技有限公司,1.5 mL微量离心管,透明聚丙烯制成)中,置于水温分别为42 ℃、45 ℃、48 ℃、51 ℃、54 ℃的水浴锅中,水浴处理10 min;每隔2 min摇晃一次,保证孢子悬浮液受热均匀,将水浴处理过的孢悬液放置于24 ℃、黑暗条件下培养;24 h后用伊文斯兰对孢子进行染色,丧失活性的孢子被染成深蓝色,未丧失活性的孢子不着色,镜检孢子的死亡率. 每处理3次重复,每重复观察4个视野.
3) 根肿腐烂与未腐烂处理对休眠孢子萌发的影响. 在自然条件下发病的肿根容易在田间腐烂,为了明确肿根腐烂与否是否会对休眠孢子寿命及其萌发率产生影响,设定新鲜肿根与腐烂肿根两种处理的对比试验,方法如下:
将冷冻的甘蓝肿根组织置于24 ℃、黑暗条件下腐烂处理,将处理2 d、3 d、4 d、5 d、6 d与未进行腐烂处理的肿根组织分别制成孢子悬浮液,用过滤灭菌的Hoagland营养液将孢子悬浮液稀释至103个/mL,取5 mL置于灭菌的离心管中,在24 ℃、黑暗条件下培养,每隔24 h镜检一次,观察休眠孢子萌发情况,连续观察5 d.
-
供试根肿病菌:采集的WL1根肿样品作为病原. 用自来水冲洗干净后,再用无菌水冲洗3次,冷冻根肿组织置于25 ℃、黑暗条件下腐烂处理5 d,根据1.4.2的方法制成孢子悬浮液. 通过血球计数法稀释根肿病滤液至终浓度1×105个/mL、1×106个/mL、1×107个/mL和1×108个/mL,即得根肿病病原菌悬液.
供试寄主:京丰一号甘蓝(高感品种).
-
甘蓝种子直播于育苗基质进行播种,播种后置于温度(25±1) ℃、相对湿度60%~70%、光照∶黑暗为16 h∶8 h温室条件下培养,以播种后不同时间点接种芸薹根肿病菌模拟甘蓝幼苗(种子)在不同时期接触病原菌. 本试验设置了根肿病菌接种时期和接种浓度两种因素,共有13个处理,即分别于幼苗第一片真叶出现后0 d、10 d、20 d用浓度为1×105个/mL、1×106个/mL、1×107个/mL和1×108个/mL菌悬液进行接种,以接种无菌水作为空白对照(CK). 每个处理10盆(即20株幼苗),采用灌根法接种病原菌悬液,接种量为10 mL. 同上述温室条件下培养,每天定时补充水分,接种病原菌后共培养45 d. 每处理重复3次.
-
1) 病情调查统计. 在病原菌接种45 d后调查发病情况,参照周金华[15]的分级标准,确定甘蓝根肿病发病等级,根据病情调查结果计算发病率(%)及病情指数.
病级 分级标准 0 根部无肿大 1 侧根有小根肿 3 主根肿大,其直径小于2倍茎基部 5 主根肿大,其直径是茎基部的2~3倍 7 主根肿大,其直径是茎基部的3~4倍 9 主根肿大,其直径是茎基部的4倍以上或肿大的根部变黑 寄主植株发病率(%)及病情指数计算公式如下:
2) 甘蓝长势调查. 调查病情后,每处理随机选取10株调查统计甘蓝株高、有效叶片数、根质量、地上部鲜质量.
利用Excel 2016进行试验数据的基本处理及作图.
1.1. 样品采集
1.2. 重庆部分地区甘蓝根肿菌生理小种初步鉴定
1.3. 甘蓝根肿病菌生物学特性测定
1.3.1. 试验材料
1.3.2. 试验方法
1.3.3. 试验设计
1.4. 不同侵染时期及浓度对甘蓝根肿病发生情况的影响
1.4.1. 试验材料
1.4.2. 试验方法
1.4.3. 调查方法
-
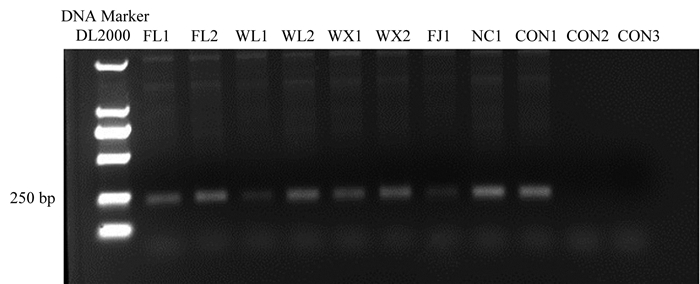
5个地区8个样品PCR扩增检测结果如图 2所示. PCR扩增出特异条带,标记基因PBRA-000030的特异性引物均存在于WL1、WL2、WX1、WX2、FL1、FL2、NC1、FJ1这8个样品中,表明所采集的样品均以4号生理小种为主要的生理小种.
-
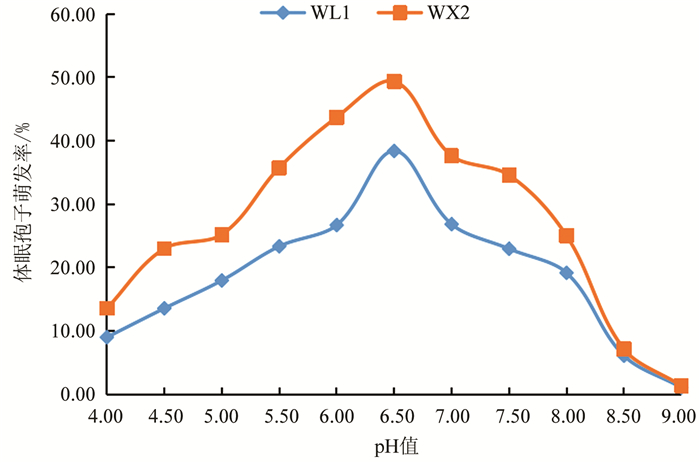
由图 3可以看出,油菜根肿病菌休眠孢子在弱酸性溶液中萌发较好,pH值为4~9时休眠孢子萌发率呈先升高后降低的趋势;在pH值6.5时萌发率最高,WL1和WX2的萌发率分别为49.34%和38.36%;pH值在6.5之前萌发率逐渐增加,大于6.5后逐渐下降,大于8后迅速下降.
-
42 ℃水浴处理10 min后WL1、WX2的休眠孢子活性率分别为6.75%和6.14%,45 ℃处理下可见少量孢子未着色,孢子活性率分别为1.5%和1.11%,48 ℃、51 ℃、54 ℃处理后,休眠孢子全部着色,表明致死温度为48 ℃(表 2).
-
对WL1和WX2两个甘蓝根肿组织进行不同时长(2 d、3 d、4 d、5 d、6 d)的腐烂处理,并在不同时间点(培养的第2 d、3 d、4 d、5 d)对休眠孢子进行地衣红染色. 结果发现,腐烂处理能显著促进根肿菌休眠孢子的萌发,如表 3所示. WL1和WX2未腐烂的根肿菌休眠孢子在培养后的第2天有少数的孢子萌发,萌发率仅为2.02%和2.39%,培养5 d后的孢子萌发率分别为20.92%和17.36%;腐烂处理2 d、3 d、4 d、5 d、6 d的休眠孢子在培养第5 d的萌发率分别为24.40%和20.82%、26.88%和25.74%、31.57%和29.01%、37.57%和35.80%、36.07%和36.23%,均高于未腐烂处理组. 在培养天数相同的情况下,随着腐烂处理时间的增加,根肿菌休眠孢子的萌发率呈上升的趋势,这些均表明,对甘蓝肿根进行腐烂处理能显著增加根肿菌休眠孢子的萌发率(表 3).
-
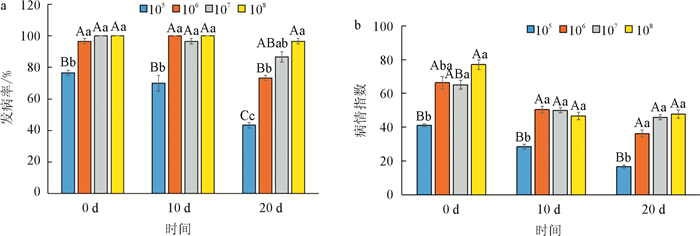
对不同时期接种4个浓度甘蓝根肿菌后的发病率和病情指数进行调查统计发现,随接种浓度的升高,发病率和病情指数整体呈上升趋势,随接种时期的推后,发病率和病情指数整体呈下降趋势. 真叶出现0 d和10 d接种病菌,低浓度(105个/mL)处理的根肿病发病率最低,而106个/mL、107个/mL和108个/mL菌液处理间发病率没有显著性差异;真叶出现第20 d接种病菌,低浓度(105个/mL)处理的根肿病发病率最低,其次为106个/mL浓度处理,107个/mL和108个/mL菌液处理间发病率最高(如图 4a). 如图 4b所示,第一片真叶出现后0 d、10 d和20 d接种病菌后,低浓度(105个/mL)处理的病情指数最低,而106个/mL、107个/mL和108个/mL菌液处理间没有显著性差异. 试验结果说明病菌侵染时间对根肿病的发生程度有显著影响,侵染时间越早,病害发生越重,环境中病菌浓度越高,病害发生越严重,106个/mL是病害严重发生的关键浓度.
-
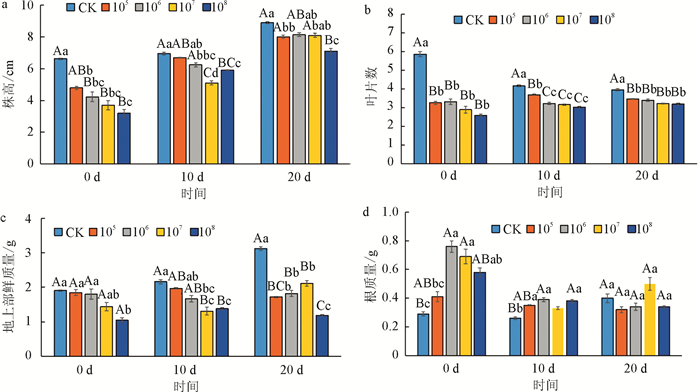
对不同时期接种4个浓度甘蓝根肿菌后甘蓝的株高、叶片数、地上部鲜质量和根质量进行调查统计,结果如图 5所示. 病菌接种浓度越高对甘蓝株高、叶片数的影响越大;随着接种时期的推后,同一接种浓度对甘蓝株高和叶片数的影响越小. 就地上部鲜质量而言,随着接种时间的推后,病菌接种对甘蓝地上部鲜质量的影响越大,产生此结果可能与甘蓝本身的生长速率变化也有关. 第2次取样(真叶出现10 d接菌处理)和第3次取样(真叶出现20 d接菌处理)间隔期间空白对照的地上部鲜质量增加量为0.96 g,较第一次(真叶出现0 d接菌处理)与第2次取样期间快速(增加量为0.25 g),同时加上病原菌侵染的影响,对地上部鲜质量的影响就越严重. 随着病菌接种时间的延后,对甘蓝根部鲜质量的影响越小,根据病情指数调查结果可知0 d接种病菌后甘蓝根部肿大较10 d、20 d严重,因此根部质量较空白对照增加显著. 试验结果说明病菌侵染时间越早,对甘蓝长势影响越大,而且环境中病菌浓度越高,影响越严重,环境中病菌浓度为105个/mL时就能对甘蓝长势造成严重影响.
2.1. 重庆部分地区甘蓝根肿菌生理小种鉴定结果
2.2. 甘蓝根肿病菌生物学特性测定结果
2.2.1. 培养体系pH条件对休眠孢子萌发的影响
2.2.2. 致死温度的测定结果
2.2.3. 根肿腐烂与未腐烂处理对休眠孢子萌发的影响
2.3. 不同侵染时期及浓度对根肿病发生的影响
2.3.1. 病原菌接种时期及浓度对根肿病发病的影响
2.3.2. 病原菌不同接种时期及浓度对甘蓝长势影响
-
蔬菜根肿病难以防治,主要原因之一就是根肿病菌的生理分化小种较多,了解根肿病菌生理小种分化的情况,才可以有针对性地进行有效防治. 本研究采集了重庆甘蓝根肿病发生严重的5个区县的根肿样品,室内进行病菌生理小种分类试验,从结果来看,所有病菌均以4号生理小种为主要生理小种,这与目前中国各地区报道的优势生理小种一致[16-18],所以从抗病育种方面而言,需要以抗4号生理小种作为育种的目标. 但是本研究受试验材料限制,仅仅初步验证了所采集样品是否是以4号生理小种为主要生理小种,是否存在其他生理小种仍需进一步系统验证.
本研究还对采集的根肿病菌生物学特性进行了测定,结果表明甘蓝根肿休眠孢子萌发率随pH值的增加呈先上升后下降的趋势,且在pH值6.5时达到最大值,说明在酸性条件下根肿病更易发生. 土壤pH值是土壤的重要化学性质,有研究表明土壤pH值影响着根肿病菌休眠孢子的萌发、根毛感染、根肿胀病发生和根肿胀形成等,土壤酸性条件根肿病的发病率会显著高于碱性土壤[19-20]. 重庆大部分地区的土壤酸化严重[21-22],这可能也是蔬菜根肿病为害较重的原因之一,根据本研究结果,在甘蓝实际生产中,可施用土壤调理剂来改良土壤的酸性,提高土壤的pH值,从而降低甘蓝根肿病的发生率. 研究结果还发现随根肿组织腐烂处理时间的增加,根肿菌休眠孢子的萌发率呈上升的趋势,因此田间发生甘蓝根肿病时,要及时清除病株并集中销毁,避免根肿在田间腐烂,增加土壤中带菌含量,进而增加发病的可能. 当然也可以在夏季高温时用塑料膜覆盖种植地块进行高温消毒,起到杀死休眠孢子的作用. 土壤pH值、养分、水分等与孢子萌发之间存在复杂的相互关系,应根据土壤具体情况,减少化肥的施用,改用有机肥配以土壤改良剂、微生物菌剂等改善土壤状况[23-24],有效抑制病原菌生长,预防根肿病的发生.
通过不同接种时期接种不同浓度根肿病菌试验发现,随接种浓度的升高,根肿病发病率和病情指数整体呈上升趋势,接种菌液浓度达106个/mL时病害将严重发生,这一结果与发病率随着接种浓度的增加而增加的研究结果一致[25]. 而随接种时期的推后,发病率和病情指数整体呈下降趋势,与榨菜移栽时期越早,根肿病越严重[13]研究结果一致. 病菌接种时期越早,对甘蓝长势影响越大,接种菌液浓度达105个/mL能严重影响甘蓝长势. 因此,在甘蓝实际生产中,要尽可能延缓根肿病发病时期,减少土壤中带菌含量,从而降低发病率,尽量降低根肿病发病带来的损失.
综上所述,本研究初步鉴定了重庆部分地区甘蓝根肿病菌以4号生理小种为主要生理小种,并测定了休眠孢子最适萌发pH值为6.5,致死温度为48 ℃,根肿腐烂时间越长,休眠孢子萌发率越高,病原菌接种越长浓度越高,甘蓝根肿病发病越严重. 这些结果在一定程度上为重庆市种植户采取调节土壤酸碱度、改善农艺措施等防治方法来有效降低蔬菜根肿病发生率提供了理论依据.





 DownLoad:
DownLoad: