-
开放科学(资源服务)标识码(OSID):

-
由小麦条锈菌(Puccinia striiformis f. sp. tritici,Pst)引起的小麦条锈病是全球小麦种植区普遍发生的一种毁灭性的真菌病害,该病害流行对小麦造成不同程度的产量损失,一般流行年份会使小麦产量下降10%~20%,大流行年份产量下降40%~60%,严重时甚至绝收,严重危害小麦的安全生产并对全球粮食供应构成威胁[1-2]。小麦条锈菌通过有性生殖、异核现象和突变[3-7]等方式不断产生新的毒力小种,导致部分小麦抗病基因及抗病品种不断被克服,最终完全丧失抗性[8],因此小麦抗病品种的筛选和选育工作面临严峻的挑战[9-10]。1944年,我国最先利用8个不同的小麦品种对小麦条锈菌进行生理小种的鉴定,至今更新为由19个小麦品种(Chinese Differentials,CD1—CD19)组成的一套鉴别寄主,为中国小麦条锈菌生理小种的研究提供了主要依据[11-12]。目前利用中国鉴别寄主已鉴定、命名34个生理小种(CYR1—CYR34)和超过35个致病类群[13]。持续监测小麦条锈菌生理小种的变化动态,对条锈病流行区以持久抗病为目标的抗病品种的选育和布局具有重要意义。
小麦条锈病是一种喜低温、高湿环境的病害,青海省的高原地形、夏季冷凉湿润的气候使其成为我国小麦条锈菌西北越夏区的重要组成部分[14-15]。近年来随着全球气候变暖,适宜小麦种植区的海拔不断上升,青海省小麦种植面积呈逐年扩大趋势,形成春小麦与冬小麦在垂直生态位上的交替种植布局[16],在同一时期不同海拔的小麦生育期差异较大,为小麦条锈菌的持续侵染和病害循环提供了良好的寄生条件。同时现有部分栽培品种抗性失效,为小麦条锈病的爆发积累了大量菌源,造成小麦条锈病的持续流行,加剧了该病害的防治难度,导致青海省每年春小麦产量损失高达15%[17]。研究表明,小麦条锈菌在青海省部分冬小麦种植区可完成周年循环[18],周年循环区内小麦条锈菌毒性变异频繁,产生新的毒力小种,条中32号(CYR32)是在青海省湟中区首次发现,因此青海省很可能成为小麦条锈菌新的毒性异变区和新小种的策源地[19]。已有研究表明甘肃陇南地区是我国小麦条锈菌新小种的策源地[20-22],但由于“一喷三防”以及对甘肃省小麦条锈病重灾区种植的作物进行调整,甘肃省小麦条锈菌得到了很好的抑制,近些年在对青海省和甘肃省越夏菌源调查中发现,甘肃省越夏菌源的病田率和普遍率都较往年低[23-24]。甘肃陇中南地区的天水、武都、定西、临夏等冬小麦种植区,是我国小麦条锈病的重要越夏区之一,其越夏菌源不仅可以侵染当地冬小麦秋苗而造成条锈病的流行,而且条锈菌在秋苗上繁殖后可向我国东部广大冬小麦种植区传播,为我国小麦条锈病的发生提供大量秋季菌源[25]。
近年来,研究者们对青海和甘肃地区小麦条锈菌越夏菌源和越冬菌源流行作用及群体遗传多样性进行了大量研究。张学飞[14]和姚强[18]的研究中,通过生理小种鉴定及毒性结构分析,发现青海省夏季初始菌源群体的遗传多样性高于越冬菌源,且两菌源群体间基因交流频繁。贾秋珍等[26]2019— 2020年对甘肃省内小麦条锈菌生理小种检测发现,贵农22为优势致病类群。陈万权等[25]对秋苗条锈病发生规律进行研究,发现甘肃、青海和陕西等地冬小麦播种较早,造成秋苗条锈病发生早、发病重,极大影响了我国东部平原地区小麦条锈病的发生。青海由于近年来冬小麦的种植扩大,小麦条锈菌在越夏的最关键时期为8—10月,青海同时具有大面积的晚熟春小麦,感病植株可以持续生长至10月上旬,冬小麦和早熟春小麦收获后产生了大量的自生麦苗,受条锈菌侵染后可持续发病至11月[18]。冬小麦在9月上中旬开始播种,9月下旬出苗,晚熟春小麦和自生麦苗产生的大量条锈菌可为冬小麦的秋苗发病提供菌源[26]。目前对青海和甘肃地区小麦条锈病越夏流行期晚熟春小麦和冬小麦秋苗初期小麦条锈菌群体生理小种及群体毒性结构研究较少,本研究通过对青海省和甘肃省小麦条锈菌越夏菌源进行毒性结构分析,明确小麦条锈菌群体毒性结构以及动态变化规律,可为小麦条锈病的综合防控与抗病育种等工作提供重要理论依据。
HTML
-
2020年8月至11月,在青海省和甘肃省小麦主要种植区采集具有单条病斑且夏孢子堆新鲜饱满的样品,每个采样点调查、采集3~5块田,每块田采集1~2片小麦病叶,将样品叶片平整地装入硫酸纸采样袋中,并标注采集编号、时间、地点、经纬度、海拔等信息。其中,8-9月份,在晚熟春小麦上采集条锈菌样品,甘肃同期没有发现病害,在青海共采集样品86份;11月中旬,在冬小麦秋苗发病初期,采集条锈菌样品,在青海共采集样品44份,甘肃采集样品18份。具体采集样品详细信息见表 1。采集的样品于阴凉通风处自然晾干后置于干燥皿中,存放在4 ℃冰箱中保存备用。
-
使用19个中国鉴别寄主材料对供试菌系进行生理小种的鉴定(表 2),以感病品种“铭贤169”作对照,铭贤169对目前发现的小麦条锈病生理小种均感病[27]。
-
挑选健康饱满的铭贤169种子点播于装有营养基质(由内蒙古蒙肥生物科技有限公司提供)的花盆(7 cm × 7 cm × 8 cm)中,每盆约15粒种子,覆土后移至育苗室,在设定好的光周期(16 ℃条件16 h光照,光照强度8 000~10 000 lux;13 ℃条件8 h黑暗)下培养,直至一叶完全展开。接种前8~12 h,选取干净且具有典型症状的小麦条锈病叶片,经清洗表面杂质后置于湿润滤纸的培养皿中,在叶片表面喷一层水雾促使孢子堆萌发,于4 ℃黑暗保湿12 h。将待接种麦苗叶片进行喷水脱蜡后,用大头针挑取单个夏孢子堆涂抹于叶片正面中间部位,每盆铭贤169幼苗只接种1只样品叶片,每只叶片只接种1个条锈菌孢子堆,接种后套上透明塑料罩。在叶片表面喷上一层均匀细密的水雾后放入底部有适量水的保湿箱中,于10 ℃黑暗条件下保湿24 h。之后,将接种苗置于与育苗室相同条件的可控变温培养室中,待鉴别寄主出现密集褪绿斑后剪去心叶,约14 d后收集夏孢子。收集时,将产孢叶片置于贴有标签的玻璃试管内,用玻璃棒敲击试管壁致使孢子落入试管底部,干燥后置于4 ℃冰箱短期保存,或于-80 ℃冰箱进行长期保存。
-
进行小麦条锈病生理小种鉴定时,首先将19个鉴别寄主材料依次播种在花盆角落,每个花盆角落种植一个鉴别寄主品种,每个品种播种5~8粒并插好标签以便记录,同时单独播种一盆铭贤169作为感病对照。接种采用抖粉法,将新鲜小麦条锈菌夏孢子与滑石粉按1∶100比例充分混匀装入50 mL离心管,管口用皮筋将双层纱布扎牢。接种前,在叶片表面喷一层1‰浓度的吐温溶液,然后手持菌粉管,用敲棒轻轻敲击管壁使菌粉均匀抖落在叶片正面。接种完成后,将麦苗放入保湿箱,喷一层水雾增加湿度,在10 ℃黑暗条件下保湿24 h。待感病对照铭贤169充分发病后,调查并记录各菌系在鉴别寄主上的反应型,按0~9级分级标准[28]记录,其中0~6级视为抗病,7~9级为感病[29]。最后,根据中华人民共和国农业行业标准(NY/1443.1—2007)《小麦抗病虫性评价技术规范:第一部分小麦抗条锈病评价技术规范》进行生理小种或致病类型鉴定[25]。
-
小麦条锈菌在鉴别寄主上的反应型数据遗传多样性使用VAT软件分析[30],将记录的反应型数据转换成由“0”和“1”组成的数据集,0~6级替换成“0”,7~9级替换为“1”,数据转换完成后,利用VAT软件计算毒性多样性指数和毒性频率。毒性多样性指数包括Nei's多样性指数(Hs)、辛普森指数(Si)、标准化Shannon指数(Sh)、Kosman指数(K)、Stoddart指数(St)、Shannon指数(SH)、丰富度(E)和Gleason指数(G)。
1.1. 材料
1.1.1. 供试菌系
1.1.2. 供试鉴别寄主
1.2. 方法
1.2.1. 小麦条锈菌的分离
1.2.2. 生理小种鉴定
1.3. 数据分析
-
使用19个鉴别寄主从148个菌株中鉴定出30个生理小种或致病类型,包括13个已报道的小种或致病类型和17个未知的致病类型(表 3)。2020年青海和甘肃省小麦条锈菌生理小种鉴定结果显示,贵农22类群的CYR34小种流行频率较高为24.32%,其在各市/州分布范围广,流行频率较高,是青、甘两省主要的优势小种;其次为洛夫林10类群的CYR32小种(16.89%);另外水源11类群的CYR33小种流行频率也较高,占12.84%。Hybrid 46类群中的HY-4、HY-8、HY-29和HY-184小种,水源11类群中的Su11-17、Su11-24和Su11-86小种,贵农22类群中的G22-13和G22-108小种,以及中四类群中的ZS -1共10个小种流行频率(0.68%~7.43%)较低。同时,鉴定结果发现,不同地区的生理小种或致病类型存在差异,其中,海东市的生理小种(74份)最为丰富,其次为西宁市(34份)和临夏州(15份),而海北州(2份)最少,定西市(3份)次之。不同生理小种或致病类型在不同地区的流行频率也存在差异,CYR34小种在不同地区的流行频率在13.33%~66.67%之间,CYR33小种在10.00%~17.65%之间,CYR32小种在6.67%~20.27%之间,其他小种流行频率处于1.35%~33.33%之间。除已知的13个生理小种,未明确的致病类型有25种,在各地区占据较高比例。由此可见,青海省和甘肃省小麦条锈菌群体毒性结构比较复杂并存在一定的多样性。
-
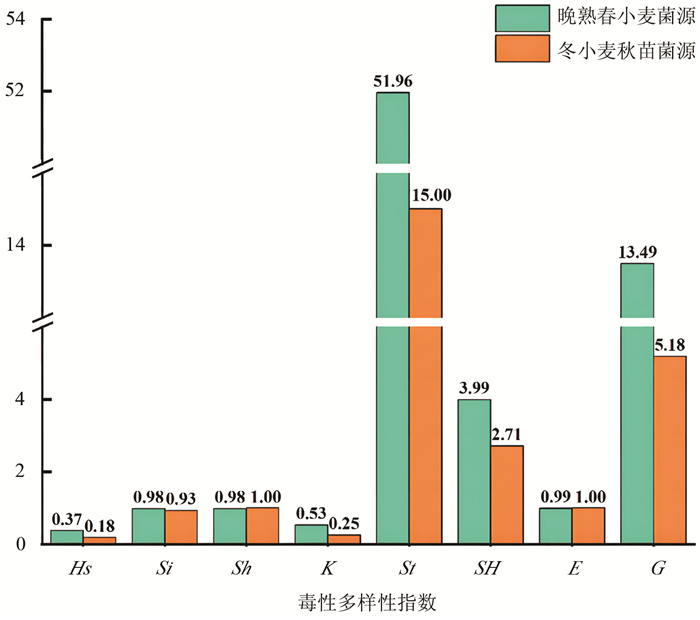
小麦条锈菌群体基于毒性表型遗传多样性分析表明,2020年青海省和甘肃省小麦条锈菌晚熟春小麦菌源与冬小麦秋苗菌源群体毒性多样性存在差异(图 1)。晚熟春小麦菌源群体除标准化Shannon指数(Sh)与丰富度(E)略低于冬小麦秋苗菌源群体外,其余6个毒性多样性指数均高于冬小麦秋苗菌源,其中,晚熟春小麦菌源群体Nei's多样性指数(Hs)是冬小麦秋苗菌源群体2倍,Stoddart指数(St)是冬小麦秋苗菌源群体的3倍多。不同流行时期小麦条锈菌群体毒性多样性指数结果表明,晚熟春小麦菌源群体毒性多样性高于冬小麦秋苗菌源群体。
-
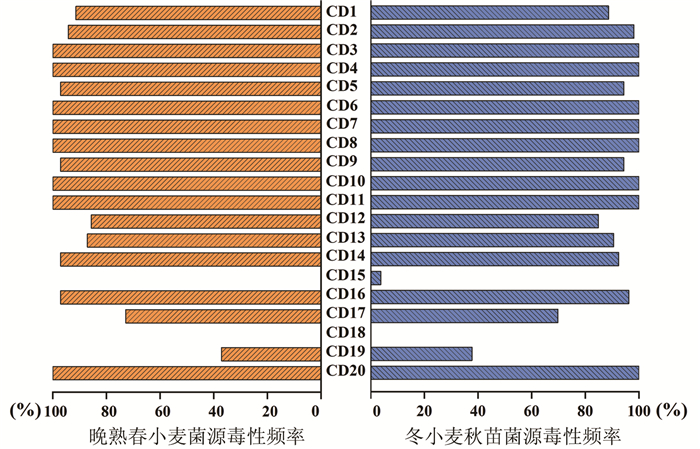
根据148个菌株在中国鉴别寄主上的反应型,利用VAT软件分析小麦条锈菌对19个鉴别寄主材料和感病对照铭贤169的毒性频率分布(图 2)。结果表明,两个不同流行期群体在CD3(保春128)、CD4(南大2419)、CD6(阿勃)、CD7(早洋)、CD8(阿夫)、CD10(尤皮2号)、CD11(丰产3号)和CD20(感病对照材料铭贤169)8个鉴别寄主材料上的毒性频率最高,均为100%。在CD18(Triticum spelta Album)材料上的毒性频率最低,两个流行期的频率均为0,说明青海和甘肃的小麦条锈菌对Triticum spelta Album材料没有任何的毒力。晚熟春小麦菌源群体在CD1(Tirgo-Eureka)、CD5(维尔)、CD9(丹麦1号)、CD12(洛夫林13)、CD14(水源11)、CD16(洛夫林10)和CD17(Hybrid 46)7个小麦品种上的频率高于冬小麦秋苗菌源群体,仅在CD2(Fulhard)、CD13(抗引655)、CD15(中四)和CD19(贵农22)低于冬小麦秋苗菌源群体的频率。
根据不同流行期小麦条锈菌在中国鉴别寄主携带Yr基因上的毒性频率,晚熟春小麦菌源和冬小麦秋苗菌源小麦条锈菌越夏群体在携带抗条锈基因YrA、YrJu1、YrJu2、YrJu3、YrJu4和Yr1的3个鉴别寄主品种载体上的毒性频率达100.00%,说明这些抗性基因在两个小麦条锈菌群体中完全丧失抗性;而在携带抗条锈基因YrVir1、YrVir2、YrVir3、YrVir4、Yr3、YrSu、Yr9、Yr6、Yr1、YrKy1、YrKy2、YrKy3、YrKy4、Yr3b和Yr4b的7个鉴别寄主品种载体上的毒性频率在69.00%~98.00%之间,表明这些抗性基因基本失效,其中Yr1基因抗性完全失效;在携带抗条锈基因Yr10、Yr24、Yr26的鉴别寄主品种载体上的毒性较弱,频率均在37.00%左右;两个群体对Yr5基因均无毒。结果对比发现,两个流行期的小麦条锈菌群体毒性频率存在一定的差异,晚熟春小麦菌源群体在携带抗条锈菌基因Yr1、YrKy1、YrKy2、YrKy3和YrKy4的鉴别寄主品种载体上的毒性频率低于冬小麦秋苗菌源群体,而在Yr3、Yr6、Yr9等多个Yr基因上的毒性频率均高于冬小麦秋苗菌源群体。鉴别寄主与Yr毒性频率结果表明,青、甘两省小麦条锈菌携带的毒性基因类型多样且丰富,且晚熟春小麦菌源群体整体毒性要高于冬小麦秋苗菌源群体。
2.1. 鉴定结果
2.2. 毒性多样性分析
2.3. 基于中国鉴别寄主的毒性分布和频率
-
小麦条锈病是一种全球性的生物灾害,为小麦生产带来严峻的挑战[31-32]。小麦品种抗性丧失的主要原因是小麦条锈菌的毒力变异[13, 33],自20世纪50年代以来,由于新毒性小种的频繁出现,中国已先后进行了8次全国性的小麦品种替换[34]。因此,了解品种组成和监测品种动态是预测Pst发生、流行及指导抗病育种的重要前提,可以为有效预防和控制病害提供科学依据[35-36]。青、甘两省是我国小麦条锈菌越夏异变区的重要组成部分,在我国控制小麦条锈病大流行体系中占据着重要地位,加强对越夏流行群体和冬小麦秋苗菌源群体小麦条锈菌生理小种的持续监测尤为重要。
在本研究中,使用19个中国鉴别寄主从148个菌株中鉴定出13个已知的生理小种或致病类型和17个未知的致病类型。其中,流行频率较高的小种是CYR34、CYR32和CYR33,其次为Su11-24、HY-184、HY-29和G22-108。青海省小麦条锈菌流行区的生理小种或致病类型比较丰富。流行的优势小种是贵农22类群的CYR34,这个小种是近年来引起小麦产量严重损失的主要病原体小种[37-38]。小麦条锈菌优势生理小种在同一个地区的不同时间段呈现动态变化,2011—2012年间,青海省内小麦条锈菌优势小种为CYR33,流行频率是27.60%[39]。刘博等[40]在2015年对青海省小麦条锈菌生理小种检测发现,CYR34在青海省已跃升为第一大流行小种,流行频率是15%左右,如今在青、甘两省的流行频率已达到24.32%,主要原因是该生理小种具有毒性强、毒力谱广等特点,能够迅速在青海省和甘肃省麦区广泛传播。因此,加强对青、甘两省小麦条锈菌生理小种的持续监测,可及时掌握流行的主要优势小种,适时调整小麦品种布局以减少产量损失,同时对新毒力小种可能成为优势小种的潜在风险进行评估。青海省采集样品的5个市(州)监测到的小麦条锈菌生理小种或致病类型存在差异,可能与鉴定样品的数量、海拔及不同海拔小麦种植区的小气候有关。例如,在样品数量多的海东市鉴定到12个已知的生理小种或致病类型和8个未知的致病类型,但在定西市3个样品中只检测到2个已知致病类型,在海北州的2个样品中只鉴定到1个已知的致病类型和1个未知的致病类型。在未来对青海省及周边麦区进行小麦条锈菌生理小种持续监测时,应考虑到采集样品的代表性和合理性。不同生理小种或致病类型在不同地区流行频率也存在一定差异,可能与不同地理区域小麦的栽培管理、耕作制度以及不同的环境条件有关。
由于不同生理小种的致病性和毒性存在差异,生理小种或不同致病类型在不同地区的流行会导致小麦产量出现不同程度的减产,这对当地抗病品种的选择提出了更高的要求。因此,在制定病害防控策略时,需要综合考虑当地实际情况与病害流行特点,以确保防控措施的有效性和针对性。晚熟春小麦越夏流行期和冬小麦秋苗初期小麦条锈菌群体的毒性多样性之间存在一定的差异,整体上看,晚熟春小麦群体的毒性多样性要高于冬小麦秋苗菌源群体,说明晚熟春小麦越夏菌源群体要比冬小麦秋苗菌源群体的毒性多样性更丰富。据此推测,青、甘两省冬小麦秋苗菌源来自晚熟春小麦越夏流行期,因为青、甘两省是中国小麦条锈菌越夏流行区的重要组成部分,当该区域内的冬小麦收获后,小麦条锈菌可以借助晚熟春小麦和自生麦苗循环侵染,保存大量的菌源顺利越夏,进而成功侵染秋播冬小麦。青、甘两省相邻,两者的越夏流行菌源是否会在晚熟春小麦越夏流行期传播至对方的麦区还需进一步的实验来证明。虽然晚熟春小麦菌源群体的毒性多样性指数多数高于冬小麦秋苗菌源群体,但标准化Shannon指数(Sh)和丰富度(E)却小于冬小麦秋苗侵染期。猜测冬小麦秋苗初期的菌源除了晚熟春小麦越夏流行的菌源外,可能有临近的小麦条锈病流行区菌源传播至青海省和甘肃省。根据不同流行期对中国鉴别寄主所携带的已知Yr基因的毒性频率结果,可知青、甘两省流行的小麦条锈菌早已克服Yr1、YrJu1、YrJu2、YrJu3、YrJu4,同时也完全克服了未明确携带Yr基因的保春128、南大2419、阿勃、早洋4个小麦品种。值得注意的是,青海省由于缺乏优质的抗病品种,以及当地农民对小麦品种抗条锈能力的认知不全面,在青海省的部分麦区种植大面积的阿勃[17]。除此之外,两省流行的小麦条锈菌对Yr3、Yr6、Yr9等数十个Yr基因的毒性频率远高于80%,几乎对条锈菌没有任何的抵抗能力。青、甘两省的小麦条锈菌对Yr10、Yr24、Yr26的毒性频率是37%左右,尚有抵抗小麦条锈病的能力,若没有其他优良的Yr基因与其聚合使用,相信在不久的将来,Yr10、Yr24、Yr26将会像Yr1、Yr9一样,彻底丧失其抗锈性。
为了有效降低青、甘两省小麦条锈病的危害,应加强对青、甘两省麦区的小麦条锈菌流行小种或致病类型的监测,中国鉴别寄主结合单基因材料以评估小麦条锈菌的毒力谱和毒力频率,在应用抗病品种方面,要加强新抗源的鉴定和转育,同时结合分子标记和基因编辑等技术选择育种,加快育种进程,创制具有持久、广谱抗性的小麦品种[41]。此外,为了延缓出现条锈菌毒性更强的新致病类型,不仅需要发掘和利用抗病新基因,还要将为数不多的有效抗病基因在时间和空间上合理布局,延长抗病品种的使用寿命。同时,利用抗病品种群体抗性多样化或异质性来控制条锈病菌群体组成的变化和优势小种的形成[34, 42],避免单一抗病基因小麦品种的大面积种植,以减少菌源的积累,从而降低小麦条锈病防治的难度。最终实现种植抗病品种为主、药剂防治和栽培管理措施为辅的综合防治策略,才能有效地控制其危害,保障青、甘两省麦区的安全生产。





 DownLoad:
DownLoad: