-
肌原纤维蛋白是鱼糜凝胶制品形成的关键蛋白组分,其凝胶特性对鱼糜制品独特质构、保水性等有着决定性的作用[1].近年来,随着优质海水鱼资源的日益锐减和人们对鱼糜制品需求量的快速增长,如何合理开发利用以养殖的淡水鱼类为原料生产鱼糜制品,已成为当今世界各鱼糜生产大国共同关注的热点[2].
鳙鱼(Aristichthys nobilis)又叫花鲢、黑鲢等,是中国四大家鱼之一,因其分布广泛、数量庞大以及相对低廉的价格,是生产淡水鱼糜原浆的重要原材料[3].然而,鳙鱼鱼糜的凝胶性差且极易凝胶劣化,因此,如何有效地改善鱼糜制品的凝胶强度是开发和利用鳙鱼鱼糜的关键点[4].
为了提高鱼糜制品的凝胶特性,以食品胶为代表的天然生物大分子是一类常用的鱼糜凝胶改良剂.魔芋葡甘聚糖(konjac glucomannan,KGM)是一种从魔芋块茎中提取出来的高分子量植物多糖,其分子主链由甘露糖和葡萄糖以1.6:1比例通过β-1,4糖苷键连接而形成的[5-6]. KGM主链上大约每19个糖残基C-3上有一个以酯键形式结合的乙酰基[7]. KGM的凝胶性能与其分子链的乙酰基残基的数量密切相关.研究表明,通过适当的碱处理KGM,使其分子链上的乙酰基残基脱去,是KGM形成稳定凝胶的重要途径[8]. KGM具有很强的水结合能力、乳化性和凝胶性等,是食品加工中常用的增稠剂、乳化剂以及凝胶改良剂[9-10].此外,KGM还具有改善人体胃肠道生态、调整脂类代谢、降低糖尿病和心血管疾病发生率等功效[11]. KGM被广泛应用于鱼肉糜制品,但目前有关脱乙酰基KGM对鳙鱼肌原纤维蛋白热诱导凝胶特性影响的研究还未见报道.因此,本试验以鳙鱼肌原纤维蛋白为材料,通过脱乙酰基KGM添加量、加热温度和NaCl浓度对其凝胶性质的影响及优化凝胶制备条件,为开发高品质鳙鱼鱼糜制品提供理论依据.
全文HTML
-
新鲜鳙鱼(平均质量1.5 kg)购于农贸市场,用两倍体积的碎冰保鲜后运到实验室,放置于4 ℃备用.
KGM(纯度为92%),由云南三艾有机魔芋发展有限公司提供.其他试剂均为分析纯.
TA-XT plus质构仪,英国Stable Micro Systems公司;GB204万分之一电子天平,瑞士Mettler Toledo仪器有限公司.
-
参考Zhang et al[12]的方法并做一定的修改.称取30 g KGM与150 mL 50%的乙醇混匀,于40 ℃下搅拌30 min,迅速加入Na2CO3(添加量为KGM量的1/30),40 ℃下反应24 h.将产物反复用50%的乙醇冲洗,直到样品溶液的pH为中性为止.然后用95%的乙醇将样品脱水,于40 ℃下烘干,得脱乙酰度为62.3%的脱乙酰基KGM.
-
参考Kobayashi et al[13]的方法并做一定的修改.新鲜鳙鱼宰杀后,去头、去皮、去内脏后进行采肉.将鱼肉捣碎,加入5倍体积预冷过含0.10 mol/L NaCl的磷酸盐缓冲液(20 mmol/L,4 ℃,pH值为7.5),冰浴条件下高速均质2 min得匀浆液后,将匀浆液低温离心15 min,弃除上清液,收集沉淀物.将沉淀物复溶于上述缓冲液中,重复以上步骤3次;将得到的沉淀加入4倍体积的冷0.10 mol/L NaCl溶液,高速均质30 s,调整混合液的pH值为6.25,低温离心(4 ℃,8 000 g,15 min),弃除上清液,收集沉淀物,重复2次,收集的沉淀为肌原纤维蛋白,并将其于4 ℃下保存,且3 d内使用.
-
将提取的肌原纤维蛋白复溶于超净水中,配成30 mg/mL的溶液.将脱乙酰基KGM按0.1%,0.3%,0.5%,0.7%,1.0%加到肌原纤维蛋白分散液中,并搅拌混匀.将混合溶液置于水浴锅中加热形成凝胶.之后冰水冷却,然后贮存在2~4 ℃的冰箱中备用.制备好的凝胶在每次分析前要在室温(18~20 ℃)条件下放置30 min.
-
参考Yin et al[14]的方法,采用英国TA公司的TA-XT plus质构仪来测定样品的凝胶强度.采用直径为5 mm圆柱形探头,测试前、测试时和测试后探头速度均为60 mm/s,测试距离为20 mm.每组样品分别进行5次的平行试验,结果取平均值.
-
根据纪蓉等[15]的方法,在肌原纤维蛋白凝胶中间部分切取厚5 mm,质量为m1的薄片,置于上、下各3层的定性滤纸中间,在其上加10 kg的重物,保持2 min后,称质量为m2.持水性按以下公式计算:
每组样品分别进行3次的平行试验,结果取平均值.
-
将样品切成小块,放于2.5%戊二醛溶液中4 ℃浸泡过夜,用磷酸缓冲液(0.10 mol/L,pH值为7.0)漂洗样品3次,每次15 min;接着用1%锇酸溶液固定样品2 h,用磷酸缓冲液(0.10 mol/L,pH值为7.0)漂洗样品3次,每次15 min;用50%,70%,80%,90%和100%的乙醇溶液对其进行梯度脱水处理,再用纯醋酸异戊酯处理样品2 h;临界点干燥,离子溅射仪镀膜,扫描电子显微镜观察,加速电压设定为15 kV.
-
选择对试验影响较大的脱乙酰基KGM的添加量、加热温度、加热时间3个因素,考察其对复合肌原纤维蛋白制品凝胶强度、持水性的影响.每组试验重复3次.
-
在单因素的基础上,以凝胶强度为响应值对复合凝胶特性进行响应面优化设计(表 1).
所有试验重复3次,数据以平均值及方差表示.使用Origin 8.5,SPSS 22.0,Design Expert V8.05进行数据处理和显著性分析,p<0.05表示差异有统计学意义.
1.1. 材料
1.2. 方法
1.2.1. 脱乙酰基KGM的制备
1.2.2. 鳙鱼肌原纤维蛋白的提取
1.2.3. 复合凝胶的制备
1.2.4. 复合凝胶性质的测定
1.2.4.1. 凝胶强度测定
1.2.4.2. 持水性测定
1.2.4.3. 电子显微镜扫描
1.2.5. 单因素试验
1.2.6. 优化设计及数据处理
-
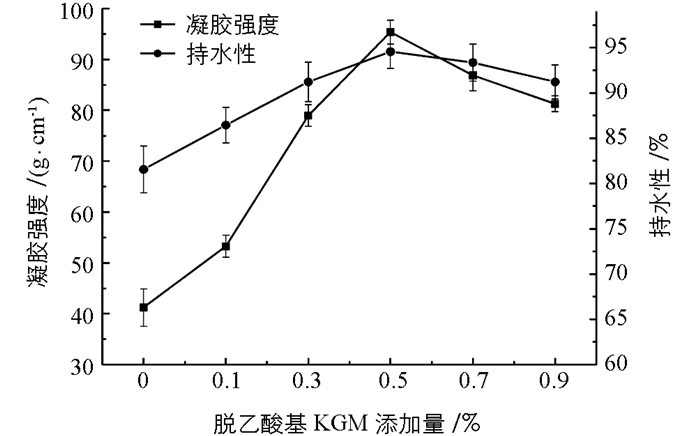
图 1可以看出,随着脱乙酰基KGM添加量的增加,肌原纤维蛋白凝胶的凝胶强度逐渐增强,在脱乙酰基KGM添加量为0.5%时,其凝胶强度由初始的41.25 g/cm增大到95.39 g/cm,提高了约2.31倍(p<0.05).这可能是添加脱乙酰基KGM后,脱乙酰基KGM与肌原纤维蛋白发生交联或者以填充物的形式包含于肌原纤维蛋白凝胶网络中,从而使得复合凝胶的凝胶强度逐渐增强[16];而当脱乙酰基KGM继续增多时,反而阻碍肌原纤维蛋白之间的交联作用[17].
脱乙酰基KGM添加量对肌原纤维蛋白凝胶的持水性也呈现出类似的变化趋势.在脱乙酰基KGM添加量为0.5%时,持水性达到94.51%,较空白组提高了13%.其原因可能是KGM本身吸水膨胀并填充于肌原纤维蛋白凝胶网络,从而提高其持水性;脱乙酰基KGM与肌原纤维蛋白发生交联,增加复合凝胶的网络结构而提高复合凝胶的持水性[16].但是,过多的脱乙酰基KGM能够阻碍肌原纤维蛋白之间的交联,使得复合凝胶体系的持水性反而降低[7].这与Zhang et al[12]结果相一致.综合复合凝胶强度和持水性分析,本试验选择脱乙酰基KGM添加量0.5%为最佳添加量.
-
从图 2可以看出,肌原纤维蛋白凝胶的凝胶强度随着加热温度(60~80 ℃)的上升而提高,且添加脱乙酰基KGM的复合凝胶的凝胶强度明显高于空白组(p<0.05).加热有利于肌原纤维蛋白变性,促进蛋白质重新聚集而形成凝胶网络结构[18].然而,当加热温度超过80 ℃,复合凝胶的凝胶强度则有所减弱.这可能是高温能加快肌原纤维蛋白的变性速率,较为迅速地促进其蛋白簇形成,且蛋白簇颗粒较大,不利于进一步形成有序的三维网络结构,降低凝胶网络的致密性,从而使得肌原纤维蛋白凝胶强度降低[19].此外,不同的加热温度,脱乙酰基KGM自身的凝胶行为与肌原纤维蛋白发生的反应也有所不同,对肌原纤维蛋白空间结构的影响不同,从而导致其凝胶强度降低[16, 20].
从图 2还可以看出,肌原纤维蛋白凝胶的持水性随着加热温度呈现出上升的趋势,但在80 ℃以后上升趋势较为缓慢,差异无统计学意义(p>0.05).这现象可能与不同加热温度下肌原纤维蛋白与脱乙酰基KGM形成的凝胶差异有关[16].综合复合凝胶强度和持水性分析,本试验中加热温度选择80 ℃为宜.
-
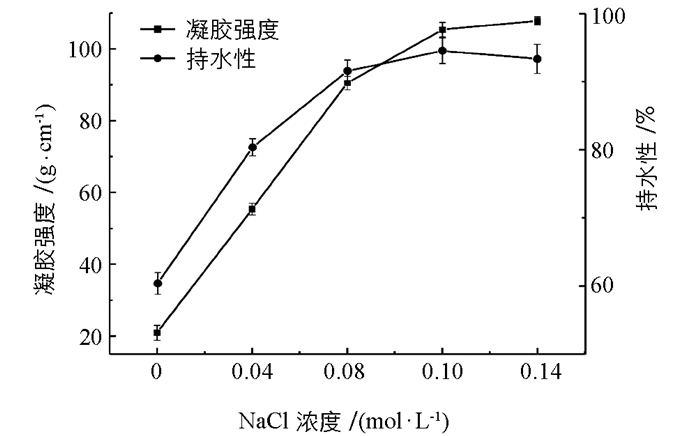
由图 3可知,随着体系中NaCl浓度的增大,肌原纤维蛋白凝胶的凝胶强度呈显著增大趋势(p<0.05),在NaCl浓度为0.10 mol/L时,其凝胶强度为初始值的3.5倍.然而,当体系中NaCl浓度超过0.10 mol/L时,肌原纤维蛋白凝胶的凝胶强度变化则不显著(p>0.05).对于复合凝胶的持水性,当加入NaCl浓度在0.04~0.10 mol/L时,持水性随浓度的增加而上升,比空白组提高了34%;在浓度处于0.14 mol/L时,持水性达到最高;随后浓度继续增大,复合凝胶的持水性则逐渐趋于稳定(p>0.05).这现象可能与NaCl有利于肌原纤维蛋白的溶解有关[21].适当地添加NaCl,能促进肌原纤维蛋白溶解度的提高,从而促进肌原纤维蛋白的凝胶化,形成稳定的网络凝胶结构[22].同时,KGM可能与肌原纤维蛋白在低离子浓度下存在协同作用,促进复合网络凝胶的形成,进而影响复合凝胶的性质.另一方面,高盐浓度条件下盐的水化能力强于蛋白和多糖,从而夺去了多糖分子和蛋白质外围的水膜,使复合凝胶的持水性下降[2, 23].综上,本试验选择NaCl浓度0.10 mol/L为最佳浓度.
-
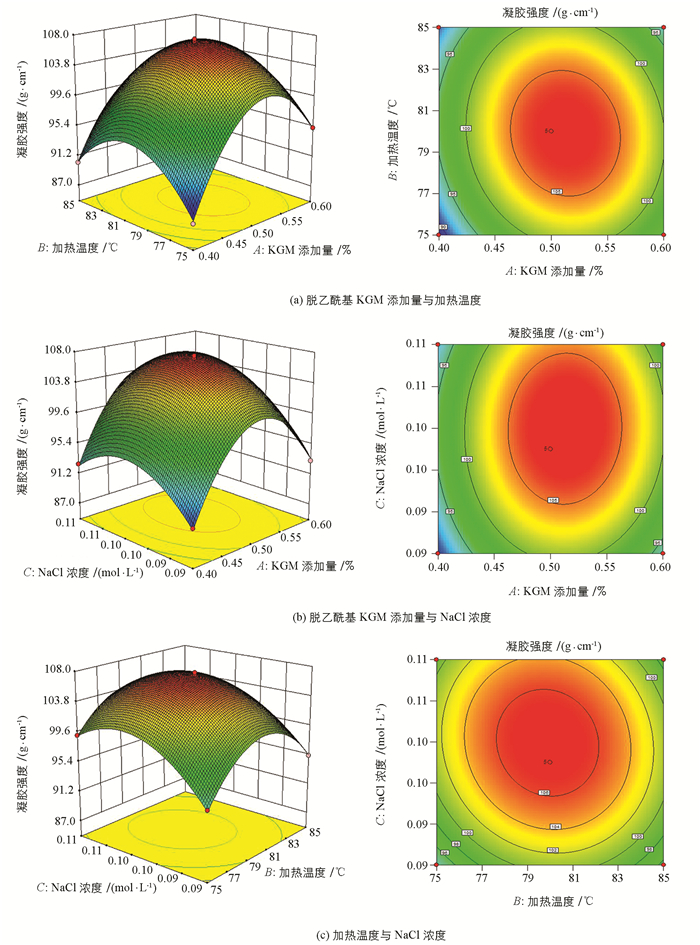
响应面试验结果如表 2,回归方程方差分析见表 3.经Design-Expert软件对表 2数据进行多元回归拟合后,得到试验因素对响应值的二次多项回归方程:
由表 3可知,建立的模型差异有统计学意义(p<0.01),失拟项p=0.148 5>0.05(差异无统计学意义),模型的决定系数R2为0.9986,校正决定系数R2为0.996 9,表明该模型的拟合良好.同时,脱乙酰基KGM添加量(A)和NaCl浓度(C)对肌原纤维蛋白凝胶强度的影响均有统计学意义(p<0.01),而加热温度对肌原纤维蛋白凝胶强度的影响无统计学意义(p>0.05).
根据多元回归分析结果作相应的响应曲面图(图 4),脱乙酰基KGM添加量与加热温度间交互作用,NaCl浓度与加热温度间交互作用对凝胶强度的影响有统计学意义;而脱乙酰基KGM添加量和NaCl浓度间交互作用对凝胶强度的影响无统计学意义,这与表 3的方差分析结果相一致.
由Design-Expert软件对模型的各因素进行回归优化,得出改善鳙鱼肌原纤维蛋白凝胶强度的最佳条件:脱乙酰基KGM添加量0.52%,加热温度79.5 ℃,NaCl浓度0.10 mol/L.在此条件下,鳙鱼肌原纤维蛋白凝胶强度的预测值可达到107.96 g/cm.
为检验RSM法的可靠性,采用上述优化条件进行鳙鱼肌原纤维蛋白凝胶热诱导凝胶强度的验证.结果3次平行试验测得的鳙鱼肌原纤维蛋白热诱导凝胶强度的平均值为107.35 g/cm,与理论预测值相比相对误差在1.0%内.因此,采用RSM法优化得到的工艺条件准确可靠,具有实用价值.
-
从图 5的电镜扫描图像可以看出,未添加脱乙酰基KGM的肌原纤维蛋白热诱导凝胶的结构比较松散,空洞大而多,而添加0.52% KGM的肌原纤维蛋白热诱导凝胶结构更加紧致,空洞较少且小.凝胶的性质与其微观结构密切相关[24].适当添加脱乙酰基KGM于肌原纤维蛋白体系中,KGM部分能与肌原纤维蛋白之间部分形成相互交联作用[17, 23, 25],另一部分以填充的形式包含于肌原纤维蛋白交联而形成的三维网状结构中,从而增加复合凝胶网络结构的致密性,提高其凝胶强度[16, 26].同时,紧致凝胶微观结构能够更容易截留水分,提高其持水性[27].因此,在其他相同的条件下,添加0.52% KGM的肌原纤维蛋白热诱导凝胶样品具有较高的凝胶强度和持水性,这与上述结果相一致.
2.1. 脱乙酰基KGM添加量对肌原纤维凝胶性质的影响
2.2. 加热温度对肌原纤维凝胶性质的影响
2.3. NaCl浓度对肌原纤维凝胶性质的影响
2.4. 响应面试验优化
2.5. 鳙鱼肌原纤维蛋白热诱导凝胶微观结构分析
-
脱乙酰基KGM添加量、加热温度和NaCl浓度等对鳙鱼肌原纤维蛋白凝胶特性有影响,最优的制备条件:脱乙酰基KGM添加量0.52%,加热温度79.5 ℃,NaCl浓度0.10 mol/L;在此条件下混合凝胶强度可达107.35 g/cm,与预测值相对误差在1.0%内.且SEM观察优化前后的鳙鱼肌原纤维蛋白凝胶发现,添加脱乙酰基KGM的肌原纤维蛋白热凝胶结构更加致密,空洞小而少,进而提高复合肌原纤维蛋白凝胶的性质.



 下载:
下载: