-
诺丽属茜草科巴戟天属的一种乔木或小灌木[1],在我国产于台湾、海南岛、云南西双版纳及西沙群岛等地[2-4].诺丽含有60多种营养成分,其中有一种叫做赛洛宁的营养成分最为珍贵,可以促进细胞再生,改善体质及睡眠,恢复活动能力等[3].据文献报道,诺丽鲜果具有清除DPPH自由基活性的能力,诺丽果汁还能显著降低老龄老鼠肝组织中SOD,GSH-Px的活力,降低血中过氧化脂质MDA含量[5].如今市面上销售的诺丽深加工产品多以诺丽果酵素、诺丽果复合果汁等与果实相关的产品为主,但是,成熟诺丽的果实质地柔软,果实内多达百粒种子[6],汁液粘稠,较难出汁.所以减少诺丽的种子数量,尽可能达到无籽,提高诺丽果实的出汁率是诺丽生产和育种研究中迫切需要解决的问题.
无籽是果蔬的一项优良品质,无籽果实以其食用便利、品质优良而在市场占有重要地位,深受人们的青睐.随着基因工程的发展,人们对木本植物的转化研究逐渐深入,越来越多的木本植物已获得转化成功和高频转化再生体系[7].木本植物的转化方法主要是根癌农杆菌的介导的遗传转化,研究显示,77%的树种是通过根癌农杆菌介导法达到转化基因的目的[8].农杆菌介导的植物遗传转化具有简单、快速、高效等优点,与其他方法相比,可以获得高频稳定的转化苗并且重复性好[9].如今国内外有关诺丽遗传转化方面的研究还未见报道,实验组通过国家林业局948项目引进无籽果实技术(无籽基因)对诺丽进行转化研究,以获得无籽或少籽的诺丽果实,并通过建立的转基因平台对后续诺丽中其他功能基因的研究奠定基础.
全文HTML
-
实验所用外植体为西南林业大学园林学院组培室的诺丽无菌组培苗,组培苗每90 d左右继代一次,继代培养基为MS+0.2 mg/L NAA.
-
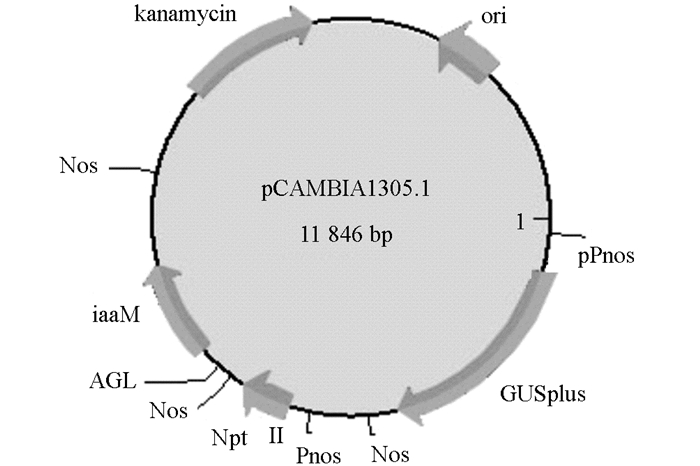
本实验使用的农杆菌菌株为EHA105,由国家948项目引进.质粒为pCAMBIA 1305.1,转化所用载体结构为pPnos-GUSplus-Nos-Pnos-NptII-Nos-AGL-iaaM-Nos,该载体包含标记基因NptII及GUS基因,该质粒质谱图如图 1所示.
-
本实验所用到的药品有北京天根生物技术有限公司植物基因组DNA提取试剂盒,卡那霉素(Kan)、乙酰丁香酮(AS)、利福平(Rif)、6-苄氨基腺嘌呤(6-BA)和萘乙酸(NAA)均为Sigma公司(美国)产品.本实验所用的培养基为YEB培养基和MS培养基.
-
取含有无籽基因的冻存农杆菌菌液,融化,用无菌接种环蘸取少许菌液,在含有50 mg/L Rif、50 mg/L Kan、100 μmol/L AS的YEB固体培养基上划线,在28 ℃恒温培养箱倒置暗培养72~96 h,挑取3~5个单菌落于含有50 mg/L Rif、50 mg/L Kan、100 μmol/L AS的5 mL液体YEB培养基中,28 ℃、200 r/min摇床培养过夜,取1 mL菌液加入含有100 μmol/L AS的50 mL YEB液体培养基中培养,用紫外分光光度计测量农杆菌菌液的OD值,绘制农杆菌生长曲线.
-
诺丽茎段遗传转化参照李菊等人农杆菌转染柑橘上胚轴的方法[10],将继代60 d不含腋芽的诺丽无菌苗茎段用手术刀小心切成2 mm左右薄片,平铺于培养瓶中,加入MS液体培养基,略微盖过外植体,120 r/min摇床自然光照培养3 d.预培养后放入农杆菌菌液浸泡30 min后取出材料,其间不断轻轻摇动瓶子使其充分接触.用无菌滤纸吸干菌液,置于MS+100μmol/L AS的共培养基上暗培养3 d,将共培养3 d的材料用无菌蒸馏水冲洗5~8次,在200 mg/L Cef的蒸馏水中浸泡20 min,期间轻摇几次,取出,用无菌滤纸吸干水分,接种于MS+1.0 mg/L 6-BA+0.05 mg/L NAA+15 mg/L Kan+200 mg/L Cef筛选培养基上培养,统计外植体抗性芽分化率.
-
将分化至1 cm高的抗性芽,转接至含15 mg/L Kan的筛选培养基中,观察抗性芽生长情况,统计抗性芽污染数、抗性芽白化数、转化子获得个数.
-
将分化出抗性芽的植株,取叶片提取DNA,在检测后进行PCR扩增. PCR所用引物为NptIIF(5’-gct atg act ggg cac aac ag-3’)和NptIIR(5’-ata ccg taa agc acg agg aa-3’).以质粒pCAMBIA 1305.1为阳性对照,以野生型诺丽基因组DNA为阴性对照. PCR反应体系为20 μ L(ddH2O:12.8 μL,dNTP:2 μ L,Buffer(Mg2+):2 μ L,NptIIF:1 μ L,NptIIR:1 μ L,Taq酶:0.2 μ L,DNA:1 μ L).反应程序为:95 ℃预变性3 min;94 ℃变性30 s,62.8 ℃退火45 s,72 ℃延伸2 min,35个循环;72 ℃延伸5 min.取5 μ L扩增产物于1%琼脂糖凝胶中电泳检测,统计阳性株系转化率.
1.1. 材料
1.1.1. 供试植物材料
1.1.2. 农杆菌菌株与质粒
1.1.3. 药品及实验所用培养基
1.2. 实验方法
1.2.1. 农杆菌的培养
1.2.2. 以诺丽茎段为外植体的转化实验
1.3. 无籽诺丽转化子的鉴定
1.3.1. 利用Kan快速筛选带有标记基因的转化子
1.3.2. DNA提取和PCR检测
-
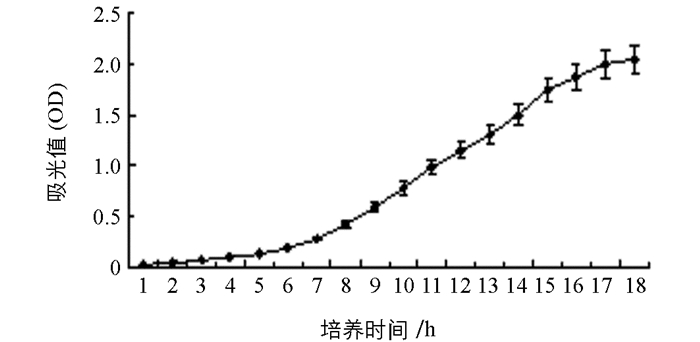
生长曲线表明,目的农杆菌在培养8 h时,OD值达到0.5(图 2),因此后续一般亚培养8 h即可进行侵染实验.
-
以诺丽无菌苗的茎段薄片为外植体进行多次遗传转化实验,外植体在筛选培养基上25 d左右分化出愈伤组织,这些愈伤组织一部分褐化死亡,一部分分化出白色芽点,另一部分在后续40 d左右可以分化出抗性芽(图 3),抗性芽平均分化率为42%(表 1).
抗性芽分化率=(分化抗性芽的外植体数/接种外植体数)×100%
-
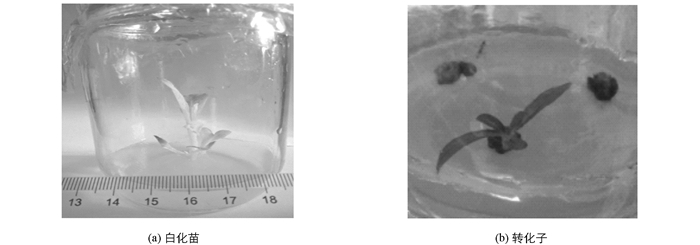
将抗性芽剪下接入Kan培养基中进一步筛选,30 d左右有64株外植体出现白化现象(图 4(a)),又除去农杆菌污染的34株,最终获得转化子70株(图 4(b)).
-
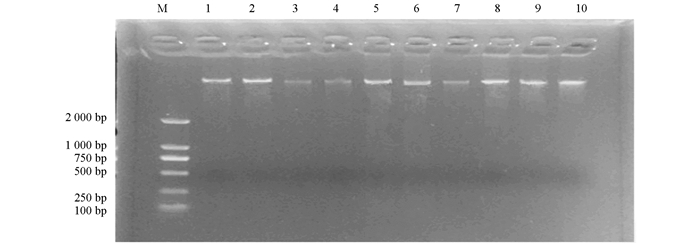
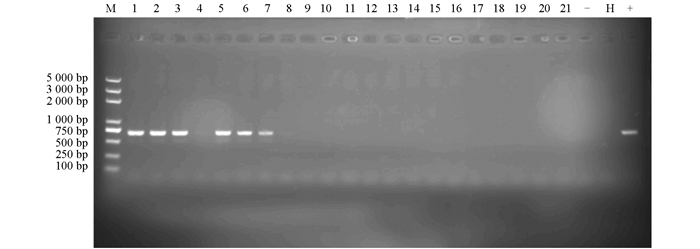
对分化出抗性苗的70株植株提取DNA,以野生型诺丽DNA为对照,将提取的诺丽DNA通过琼脂糖凝胶检测.结果显示DNA条带较为清晰,明亮,无明显拖尾现象(图 5),说明提取的DNA质量较好,浓度较高,并且在此过程中无DNA被降解现象,可用于后续PCR实验.以NptII作为标记基因的PCR检测,发现转基因植株可扩增得到750 bp的特异性扩增产物,阴性对照没有获得特异性扩增产物(图 6).将扩增出的条带进行测序,测序结果显示目的基因即为NptII基因片段.本实验通过PCR共检测到为阳性的转化子9株,转化率为5.4%.
阳性株系转化率=(PCR检测为阳性的植株个数/检测总数)×100%
2.1. EHA105农杆菌生长曲线的绘制
2.2. 诺丽抗性芽分化
2.3. 无籽诺丽转化子的鉴定
2.3.1. 利用卡那霉素快速筛选带有标记基因的转化子
2.3.2. 转化子的PCR检测
-
在以诺丽无菌苗不带腋芽的茎段为外植体的无籽基因转化实验中,参照李菊等人[10]的方法,将茎段剪成1~2 mm的小段,经预培养、农杆菌侵染、共培养、筛选培养及PCR检测后,初步获得9株转化子,为后续获得无籽或少籽的诺丽果实奠定了物质基础.本实验采用农杆菌亚培养8 h,即OD600值为0.5时侵染受体细胞,是基于前人在其他植物上研究的基础上选择的一个OD值,如董志刚认为农杆菌菌液的OD值在0.5~0.7时,葡萄抗性芽的分化率最高[11],张海芹认为当农杆菌菌液OD值为0.5时,被转化的葡萄风信子GUS瞬时表达率最高[12].因此,接下来本实验将采用单因素法设置农杆菌浓度梯度,在OD值分别为0.3,0.4,0.5,0.6,0.7时,去侵染诺丽茎段,统计抗性芽的分化率,选出最适抗性芽分化的农杆菌浓度.
在遗传转化的过程中,所选用的外植体类型也影响着遗传转化率[13],不同的外植体遗传转化效率差别很大,Peyman norouz发现来自顶端分生组织的小麦主叶脉最适合作为转化材料[14].因此,后续可尝试使用诺丽的根段、叶盘、愈伤组织和悬浮细胞等进行转基因实验,如江一北等人用非洲菊的愈伤组织进行遗传转化研究,已经取得了很好的成果[15].而悬浮细胞由愈伤组织培养获得,其转基因将更加具有针对性. Roux等认为细胞悬浮系是遗传转化的理想受体,因为通过体胚发生途径的植株再生通常是单细胞起源的,可大幅减少甚至避免嵌合体的产生[16]. 如:徐春香等人做过香蕉胚性细胞悬浮系的转化并且取得了成功[17],于波等人在研究中发现,利用巴西橡胶树胚性愈伤组织悬浮细胞进行遗传转化,GUS瞬时表达率高达98.5%[18].由此见得,细胞悬浮系在遗传转化方面的应用应该会大有前景,课题组已经建立了诺丽细胞的悬浮系,这为接下来以细胞悬浮系作为受体的遗传转化实验奠定了物质基础,后续将会尝试使用细胞悬浮系作为遗传转化的受体材料,进行无籽基因的遗传转化.
诺丽无籽基因遗传转化的阳性率从目前PCR检测结果来看是5.4%,而无籽基因究竟是否已经整合到这些转化子的染色体上需进一步的Southern杂交实验验证,随着Southern杂交实验也许会进一步检测出假阳性植株,导致转化效率更低,因此,需要进一步优化诺丽的遗传转化方案,提高遗传转化率.由于农杆菌介导的植物遗传转化是复杂的生物过程,受多种因子的共同作用,如外植体的老幼程度、菌株类型、侵染方式及共培养的条件(共培养方法、pH值、温度、时间、培养基)等[19],因此在一些常规的基本转化因子确定后,并不能保证建立的农杆菌介导转基因体系是高效的,所以对遗传转化的主要因素进行优化是十分必要的,如李玉平等人建立大花金挖耳细胞悬浮体系时,利用四因素(A:蔗糖;B:激素;C:pH;D:接种量)三水平的正交试验法,得出最优组合为A1B3C3D3[20].为进一步的研究积累了基本数据.因此,需要寻找影响转化频率各个作用因子之间的最佳组合.在后续实验中课题组可以对影响获得目的基因转化植株的因子进行正交试验,寻找出获得最大目的基因转化效率的组合,使诺丽遗传转化向前进一步发展.



 下载:
下载: