-
托品烷类生物碱(Tropane Alkaloids,TAs)包括莨菪碱和东莨菪碱,是一类重要的抗胆碱药物,提取自茄科植物的次生代谢产物,具有多方面的药用价值,广泛用于麻醉、镇痛、止咳、平喘、抗晕动病,也可用于控制帕金森病的僵直和震颤[1-2].颠茄(Atropa belladonna L.)为茄科颠茄属多年生草本植物,是莨菪碱、东莨菪碱最主要的商业栽培药源,也是我国药典规定的TAs药源植物[3].颠茄全草可入药,叶和根含有莨菪碱和微量东莨菪碱,可制成浸膏和配剂[4].颠茄中的托品烷类生物碱含量极低,但市场需求量巨大,因此培育TAs高产的颠茄植株是该领域一直追求的目标.
近来,土壤盐渍化已经愈发明显,对植物的正常生长影响严重,尤其是对农业栽培生产更是造成巨大损失.颠茄作为一种重要的托品烷类生物碱药源植物,也将面临这一严峻问题. ALA是植物体代谢过程中的一种中间产物,是合成其他重要物质的原料,能够起到提高作物在逆境条件下的抗性作用[5].为了使颠茄得到大面积种植,抵御土壤盐渍化影响,本研究以颠茄幼苗为试验材料,在100 mmol/L盐胁迫下,探究外施不同浓度ALA对颠茄生理指标及托品烷类生物碱含量的影响,寻求缓解盐胁迫的方法,为今后解决颠茄批量栽培中可能遇到的盐胁迫问题提供理论依据.
全文HTML
-
颠茄种子购自湖南永州,经西南大学生命科学学院吴能表教授鉴定为颠茄(Atropa belladonna L.).将颠茄种子浸泡于50 mmol/L赤霉素溶液中,浸泡2 d后置于湿润滤纸上萌发,保持25 ℃,待萌发后移栽到盛有混匀介质(泥炭土:珍珠岩:蛭石=3:1:1)的营养盆(12 cm×13 cm)中,每盆4株,共200盆,于温室内培养3个月,挑选100盆长势一致的颠茄幼苗,开始实验处理.以颠茄叶片MDA含量和叶绿素含量为标准,经预实验后最终确定盐胁迫所用的NaCl浓度为100 mmol/L,并选取4个ALA质量浓度梯度,进行叶片喷施处理,见表 1.连续处理15 d后进行采样,样品于-80 ℃冰箱中冻存,用于各项指标测定;另采样于烘箱中烘干至恒定质量用于托品烷类生物碱含量的测定.每个处理组设置3个重复.
仪器与试剂:十万分之一电子分析天平(METTLER TO-LEDO,瑞士),PAM-2100荧光仪(Walz,德国),岛津LC-20AT高效液相色谱仪,岛津UV-255紫外分光光度计,莨菪碱标准品(Sigma-Aldrich公司,货号37021),东莨菪碱标准品(Sigma-Aldrich公司,货号37022),超声波清洗仪(北京医疗设备二厂)等.
-
参照张宪政的方法[6],称取0.2 g新鲜的颠茄叶片,擦净、剪碎、去中脉,在避光条件下用20 mL丙酮乙醇混合液(1:1)浸泡72 h至白色.取上清液3 mL于比色皿中,测吸光值A663,A645,计算叶绿素含量.
-
使用叶绿素荧光仪PAM-2100预先编好的程序Run 3进行测定,将待测样品于黑暗环境下处理2 h,测定初始荧光(F0)、最大光化学效率(Fv/Fm)、非光化学猝灭系数(NPQ)及光化学猝灭系数(qP),分别取3次数据的平均值进行分析.
-
可溶性糖含量的测定参照李合生[7]的方法,糖类与蒽酮反应生成有色物质,在可见光区的吸收峰为630 nm,可在此波长下进行比色.可溶性蛋白含量与游离脯氨酸含量的测定参照高俊凤的方法[8],考马斯亮蓝G-250可以与蛋白质结合,其结合物在595 nm波长下的吸光值与蛋白质含量成正比,可通过检测其结合物的A595,以此来测定可溶性蛋白含量;在酸性条件下,通过检测脯氨酸和茚三酮反应产物的A520,以此测定出游离脯氨酸含量. MDA含量的测定参照Velikova等[9]的硫代巴比妥酸(TBA)法.
-
超氧化物歧化酶(SOD)活性的测定,参照Giannopolitis等[10]的方法,通过观察NBT的光还原抑制程度,将能够抑制反应酶量的50%定义为1个SOD活力单位(U);过氧化物酶(POD)活性的测定根据张志良等[11]的方法,将每分钟A470值升高0.01定义为1个酶活力单位(U).
-
颠茄叶片中莨菪碱和东莨菪碱的提取,参照Zárate等[12]的提取方法,略有改动;莨菪碱、东莨菪碱含量均采用HPLC测定,色谱仪:日本岛津(Shimadzu)LC-60A高效液相色谱仪(泵:LC-20AD,控制器:SPD-20A,柱温箱:CTO-10AS vp);色谱柱为Ultimate XB-C18液相色谱柱(5 μm,4.6×250 mm);流动相为甲醇:醋酸缓冲液(20 mmol/L醋酸铵,0.1%甲酸,pH值为4.0)=1:4.检测波长226 nm.流速1.0 mL/min;柱温40 ℃;进样量10 μL.
-
采用Microsoft Excel 2010和Spss 22.0对数据进行分析和方差检验,数据均以x±s表示,p<0.05.
2.1. 叶绿素含量的测定
2.2. 叶绿素荧光参数的测定
2.3. 渗透调剂物质和MDA量的测定
2.4. 抗氧化酶活性的测定
2.5. 莨菪碱和东莨菪碱含量的测定
2.6. 数据分析
-
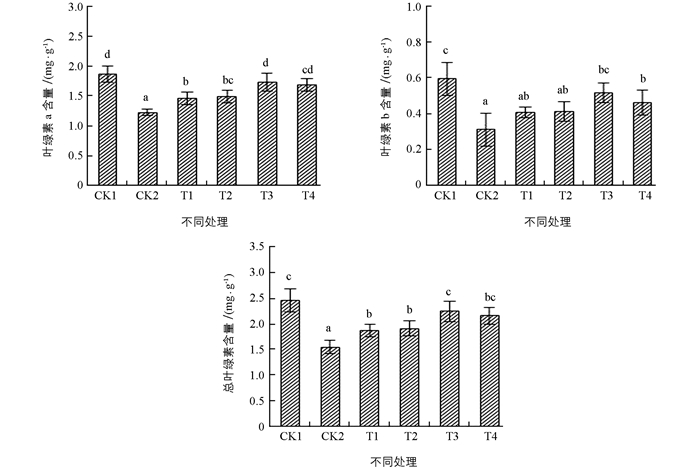
在植物叶片中,叶绿素含量是表征植物体光合能力的重要指标之一.如图 1所示,经过单一的100 mmol/L NaCl胁迫处理后,与对照组CK1相比,叶绿素a、叶绿素b及总叶绿素含量显著降低.经过喷施不同质量浓度ALA溶液处理后,叶绿素a、叶绿素b及总叶绿素含量均表现出升高的趋势,当ALA质量浓度为100 mg/L时,色素含量开始下降.其中,当ALA质量浓度为75 mg/L时,较对照组CK2,其叶绿素含量回升最为显著.叶绿素含量的升高,有利于颠茄在盐胁迫下其光合作用的协调性.
-
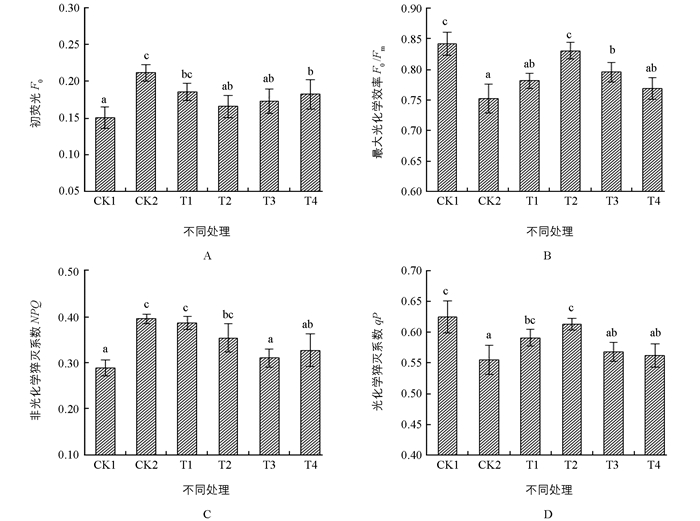
叶绿素荧光参数可以较为灵敏地反映光合作用的变化情况,被称为研究植物光合功能的快速、无损伤探针[13].初始荧光F0表示PSⅡ反应中心处于完全开放时的荧光产量.如图 2A所示,在盐胁迫处理下,CK2的F0较CK1大幅升高,喷施不同质量浓度ALA处理后,不同处理组较CK2有不同程度的回落现象,且当ALA质量浓度为50 mg/L时最为显著.
Fv/Fm代表PSⅡ的最大光化学效率,是较为常用的叶绿素荧光指标之一,此指标在胁迫条件下先通常会降低[14-15],同时也可以表明PSⅡ遭受到破坏[16].如图 2B所示,CK2的Fv/Fm较CK1显著降低,经不同质量浓度ALA处理后,呈现出先升高后降低的趋势,当ALA质量浓度为50 mg/L时,与CK2相比显著提高,且效果最为明显.
NPQ为非光化学猝灭系数,是PSⅡ天线色素吸收的不能用于光合电子传递而以热能形式耗散掉的光能部分,反映光系统对过剩光能的耗散能力[17].如图 2C所示,CK2的NPQ较CK1显著上升,经ALA处理后,各处理组有不同程度的下降趋势,当ALA质量浓度为75 mg/L时,与CK2相比其NPQ下降最为显著.
qP是光化学猝灭系数,即由于光化学反应所引起的荧光猝灭,可以反映PSⅡ原初电子受体QA的氧化还原状态和PSⅡ开放中心的数目,其值越大,说明PSⅡ的电子传递活性越大[17].如图 2D所示,在盐胁迫处理下,CK2的qP显著降低,不同质量浓度的ALA处理后,其光化学猝灭系数呈先升高后降低的趋势.
-
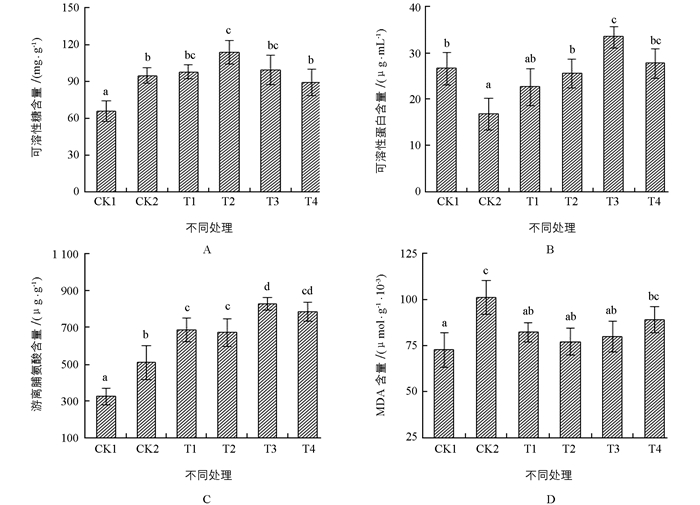
图 3所示为盐胁迫与不同质量浓度ALA处理下颠茄幼苗叶片渗透调节物质与MDA含量的变化情况. 图 3A所示为颠茄叶片可溶性糖含量的变化趋势,经盐处理后CK2较CK1显著升高,经过ALA处理后,与CK2相比,随着ALA质量浓度升高,叶片中可溶性糖含量先增加后降低.当ALA质量浓度为50 mg/L时,可溶性糖含量升高最显著.
如图 3B所示为颠茄叶片可溶性蛋白含量的变化趋势,盐处理后CK2显著降低,经ALA处理后,其含量呈先升高后降低的变化趋势,当ALA质量浓度为75 mg/L时达到最高值,且高于对照组CK1,可见ALA可有效减缓由盐胁迫导致的可溶性蛋白大幅减少.
如图 3C所示为颠茄叶片游离脯氨酸含量的变化趋势,在盐处理条件下,CK2较CK1显著升高,不同质量浓度ALA处理后,再次呈现出不同程度的升高趋势,与可溶性糖含量的变化趋势相类似.
如图 3D所示为颠茄叶片MDA含量的变化趋势,经盐处理后叶片中的MDA含量显著升高,与CK1相比,CK2升高了39.24%,经ALA处理后,有了不同程度的回落,其中当ALA质量浓度为50 mg/L时最为显著,T2与CK1含量基本持平.
-
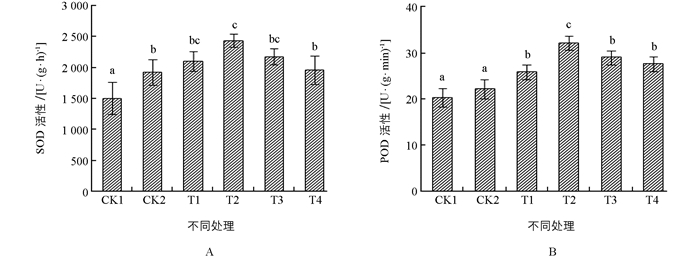
植物体中抗氧化酶活性的变化在一定程度上可以反映出植物体抗盐性的强弱[18],图 4所示为颠茄叶片中SOD和POD两种抗氧化酶活性的变化趋势,两者的变化基本一致,均为先升后降的趋势.如图 4A所示,盐胁迫处理后,SOD活性显著升高,经质量浓度为50 mg/L的ALA处理后其活性相比CK2变化显著,提高了26.34%,其他处理组均不显著.如图 4B所示,盐胁迫处理后,POD活性较对照组CK1仅升高了9.01%,经不同质量浓度ALA处理后,POD活性均显著提高,其中T2处理组最显著,较CK2提高了45.11%.这说明外源性的ALA可显著提高颠茄叶片中的两种抗氧化酶,以此来减轻细胞氧化程度,提高其抗盐胁迫能力.
-
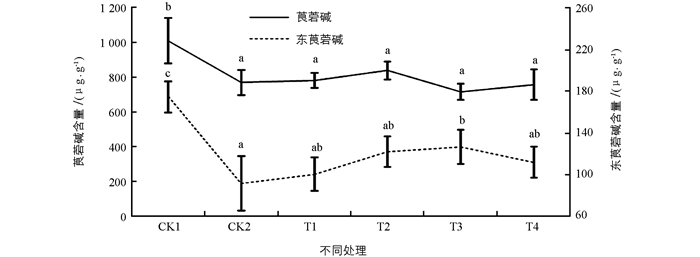
如图 5所示,颠茄叶片中莨菪碱和东莨菪碱含量极低,对照组CK1中的含量分别是0.101%和0.017%.结果显示,经盐胁迫处理后,莨菪碱和东莨菪碱的含量显著降低,分别降低了23.74%,47.49%.用不同质量浓度ALA处理后,莨菪碱和东莨菪碱的含量均有所变化,其中莨菪碱呈现出无规则变化趋势,但差异不具有统计学意义;东莨菪碱含量经ALA处理后有所回升,其中当ALA质量浓度为75 mg/L时,其含量显著增加,其他处理组差异不具有统计学意义.这说明外源性的ALA可缓解盐胁迫导致的东莨菪碱合成障碍,但是对于促进莨菪碱的合成不起显著作用.
3.1. 不同质量浓度ALA对盐胁迫下颠茄叶片叶绿素含量的影响
3.2. 不同质量浓度ALA对盐胁迫下颠茄叶绿素荧光参数的影响
3.3. 不同质量浓度ALA对盐胁迫下颠茄叶片渗透调剂物质和MDA含量的影响
3.4. 不同质量浓度ALA对盐胁迫下颠茄叶片抗氧化酶活性的影响
3.5. 不同质量浓度ALA对盐胁迫下颠茄叶片莨菪碱和东莨菪碱含量的影响
-
光合作用的强弱对植物生长、产量及抗逆性都具有十分重要的影响[19],而叶绿素是参与光合作用光能吸收、传递和转化的重要色素[20],因此叶绿素含量会直接影响植物生长.在盐胁迫条件下,植物体各种生理过程受到干扰,膜系统结构被破坏,有害物质积累,直接或间接地影响了叶绿素的含量[21].本研究表明,在盐胁迫条件下,颠茄叶绿素含量显著降低,抑制或加快了颠茄叶片中叶绿素a和叶绿素b的合成与分解,而施加外源ALA后,其叶绿素含量显著上升,表明ALA有助于保护叶绿体膜,保持其结构的完整性,维持颠茄叶片较高的叶绿素含量,从而对其光合作用起到一定的促进作用.这与Hotta等[22]提出的ALA可以调节叶绿素合成观点相一致.
植物体进行光合作用受到伤害的最初部位是与PSⅡ紧密联系的,而盐胁迫会导致叶绿体光合机构的破坏,降低PSⅡ原初光能转换效率、抑制PSⅡ潜在活性,导致PSⅡ功能下降[23].本实验结果显示,相比对照组CK1,盐胁迫使F0和NPQ升高,Fv/Fm和qP降低,说明盐胁迫使PSⅡ反应中心受到破坏,发生光抑制,降低了电子传递效率,从而导致PSⅡ功能下降.在低质量浓度ALA处理下,F0呈下降趋势,而Fv/Fm呈上升趋势,其中50 mg/L处理最为显著,这表明低质量浓度ALA可有效抵御盐胁迫对PSⅡ反应中心的伤害,使颠茄叶片PSⅡ天线色素吸收的能量更多地流向光化学部分,减少以荧光形式散失的能量,从而使颠茄叶片在盐胁迫条件下保持较高的光化学效率,有利于光合作用进行.在中低质量浓度ALA处理下,NPQ下降而qP上升,表明PSⅡ反应中心降低了热能形式的光能耗散,增加了光化学反应所引起的荧光猝灭,反映出在盐胁迫下ALA可以使颠茄PSⅡ反应中心开放程度增大及增强PSⅡ的电子传递活性,使之保持较高的光化学效率,同时这也说明外源ALA在盐胁迫条件下保护光合机构的原因不是通过增加光能热耗散的形式.
渗透调节是植物适应盐胁迫的基本特征之一,在盐胁迫下细胞通过积累脯氨酸、可溶性糖、无机离子等来调节细胞内的渗透势,维持水分失衡,保护细胞内代谢所需的酶活性[24],对细胞的生命物质及生物膜起到保护作用.可溶性糖和可溶性蛋白既是渗透调节剂,也是合成其他有机溶质的碳架和能量来源,还可在细胞内无机离子浓度高时起保护酶类的作用[25].本实验结果显示,在盐胁迫下颠茄叶片可溶性糖和游离脯氨酸含量相比对照有所上升,可溶性蛋白含量显著降低,这说明在盐胁迫处理下颠茄快速响应逆境,其本身调节可溶性糖和游离脯氨酸含量增加,来缓解逆境伤害导致的渗透压变化,而可溶性蛋白含量的降低表明,盐胁迫减弱了蛋白质的合成并加速其分解,不利于植株正常生长.在喷施不同质量浓度ALA溶液后,可溶性糖、可溶性蛋白和游离脯氨酸含量呈先升高后降低趋势,其中ALA质量浓度为50 mg/L和75 mg/L时效果最为显著,这说明外源性ALA可以维持颠茄细胞内较低的渗透势,提高细胞内溶质的浓度,有助于细胞从外界吸收水分,维持细胞正常生理活性,可有效缓解盐胁迫对颠茄造成的伤害.
超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)是植物体内保护酶系统的主要成员,特别是SOD和POD是防御活性氧及其他自由基对细胞膜系统伤害最重要的酶[26].丙二醛(MDA)是膜脂过氧化作用的主要产物之一,其量的高低和质膜透性的大小都是膜脂过氧化强弱和质膜破坏程度的重要指标[27].实验结果显示,在盐胁迫处理下MDA含量大幅上升,SOD和POD活性较正常水平略微升高,说明细胞质膜发生了过氧化作用,且其自身通过调控抗氧化酶活性,降低活性氧水平.通过喷施不同质量浓度ALA溶液,MDA含量开始显著降低并且大幅度提高了SOD和POD活性,这与刘鹏等[28]的研究结果相似,ALA可以缓解盐胁迫这一作用与能够调节植物细胞渗透调节能力、提高抗氧化酶活性和抑制质膜过氧化有关.
植物的次生代谢是植物体内一种重要的生理代谢,次级代谢产物的合成和积累与植物生长环境密切相关.有研究表明,有利于初生代谢的环境条件不利于次生代谢,不利于次生代谢的条件反而增加次生代谢,也就是初生代谢与次生代谢之间存在矛盾[29].然而本研究结果与之相反,实验结果显示,在盐胁迫条件下颠茄叶片中莨菪碱和东莨菪碱含量均显著降低,可能是由于盐胁迫抑制了TAs合成途径中某种或者几种酶的活性,也有可能是由于盐胁迫造成TAs的前提物质减少所致,经不同质量浓度ALA处理后,东莨菪碱含量略有提高,但是莨菪碱含量没有显著变化.本研究结果表明,ALA对颠茄光合作用与抗逆能力起到促进作用,有利于颠茄植株的初生代谢,可抵抗恶劣环境促进其快速生长,从而不利于次生代谢产物的积累.对于盐胁迫及ALA对颠茄次生代谢的影响机制,还有待进一步深入研究.
作为TAs药源植物的颠茄具有极高的应用价值,其良好的生长条件固然不可忽视,但是作为药用植物其活性成分的积累才更为重要.随着TAs需求量的日益提高,人工种植颠茄将是今后的首选.但是,如何在最优生长条件下保持较高的TAs积累水平,是将要解决的首要问题.



 下载:
下载: