-
异戊酸异戊酯为无色或微黄色透明液体,具有水果香味[1],可作为食品赋香剂用于调配苹果、香蕉和桃等果香型香精,同时在合成医药和溶剂等方面也有广泛的应用.在工业生产中,异戊酸异戊酯是由异戊醇和异戊酸通过酯化反应制得,该过程常以传统催化剂浓硫酸来催化,反应具有较好的收率,但是用浓硫酸催化反应时,对设备腐蚀严重,反应后大量废酸和废碱处理液会导致严重的环境污染.传统催化剂制备时存在的一些缺点可在一定程度上被Lewis酸、分子筛、固体超强酸、酶及离子液体等催化剂所克服,但复杂的制备过程、后处理麻烦、不易回收和价格高等缺点依然是这些催化剂所不能解决的[2-10].因此开发一种高效、绿色、环保、易分离的催化剂具有重要意义.
杂多酸是固体酸的典型代表,被公认为是环境友好型强酸性强氧化性催化剂.其阴离子体积大,对称性好,电荷密度低,具有可设计性,酸性强于传统的无机酸;另外,杂多阴离子之间的空隙使得反应过程中杂多酸伴随着类似于溶解现象的体积变化,发生“假液相”行为.这些典型的性质使杂多酸在均相催化领域得到广泛应用.但是,杂多酸的低表面积及其易溶于极性溶剂的性质使其催化反应后难以回收.针对这些不足,通常可以采用金属离子改性杂多酸[11-14]、有机物改性杂多酸[15-18]和大比表面积物质负载杂多酸[19-24]等方法对杂多酸进行改进.而以金属离子进行改性时不仅解决催化过程中催化剂流失的缺点,同时金属盐提供的Lewis酸位与磷钨酸提供Brønsted酸位间的协同效应进一步提高催化反应活性和选择性.从反应原料来看,磷钨酸具有较强的Brønsted酸,这更有利于酯化反应的进行,而对于另一反应原料氯化铜来说,其价格低廉,且铜原子本身具有较高的相对原子质量,使催化剂具较高的催化转换频率,综合比较,可大大降低实验成本;从催化剂制备过程来看,本实验催化剂采用一步合成法,制备流程简单,操作便捷,催化剂成品收率高,一定程度上可大规模生产.本实验以铜离子交换磷钨酸形成不同配比磷钨酸铜为催化剂催化制备异戊酸异戊酯,旨在探索高效环保型催化剂,为低成本、规模化合成异戊酸异戊酯提供基础基础,为其他金属改性杂多酸类催化剂的制备及应用提供一定的理论思路.
全文HTML
-
氯化铜(CuCl2·2H2O),国药集团化学试剂有限公司;磷钨酸(AR),昆山兴邦钨钼科技有限公司;异戊酸、异戊醇、环已烷和无水乙醚均为分析纯,上海强顺化学试剂有限公司.
-
准确称取磷钨酸2.88 g(0.001 mol)于100 mL三颈瓶中,同时加入40 mL去离子水搅拌至固体完全溶解,然后加入一定量的氯化铜,在机械搅拌条件下于90 ℃油浴锅中反应24 h.反应结束后减压除水,用无水乙醚洗涤数次,最后于75 ℃真空干燥,得粉末状固体催化剂,催化剂记为Cux/2H3-xPW12O40(x=1~3).
-
在100 mL三颈瓶中依次加入10.21 g(0.1 mol)异戊酸、10.12 g(0.115 mol)异戊醇、0.66 g(6.5%)磷钨酸铜以及8 mL带水剂环己烷,装置配有分水器、温度计和回流冷凝管,在此条件下加热搅拌反应2.5 h,此时反应体系已回流至不再有水生成.反应结束后通过过滤、无水乙醚洗涤以及真空干燥对催化剂进行重复利用.通过减压蒸除上述滤液中的异戊醇和环己烷,再用5% NaHCO3水溶液洗涤滤液,直至滤液偏碱性以去除异戊酸,最后再用热水洗至中性,减压蒸馏,即得产品异戊酸异戊酯.体系反应前后酸值按照国标GB/T 1668-1995来测定.酯化反应的酯化率计算公式为
1.1. 原料与试剂
1.2. 磷钨酸铜的制备
1.3. 磷钨酸铜催化合成异戊酸异戊酯
-
对于酯化反应来说,催化剂的酸性及酸量起着非常重要的作用.不同含量铜交换磷钨酸时,由于H+被Cu2+取代,Brønsted酸量适当降低,同时催化剂提供了更多Lewis酸性位,从而使得Cux/2H3-xPW12O40(x=1~3)催化剂具有不同的酸性,在催化酯化异戊酸异戊酯的过程中显示不同的催化活性,具体结果见表 1.由表 1可见,铜取代的磷钨酸都具有较好的催化活性,其中一定含量的Lewis酸的引入使得催化剂(Cu0.5H2PW12O40和CuHPW12O40)催化活性较磷钨酸催化时更高,而Cu1.5PW12O40催化剂较磷钨酸催化时活性降低.部分取代时由于存在Brønsted酸性位与Lewis酸性位间的协同作用,从而使催化剂显示高催化活性,而完全取代时,缺少Brønsted酸性位的催化作用,仅体现Lewis酸性位的催化作用,从而活性降低.催化剂中大体积杂多阴离子的存在也是Cux/2H3-xPW12O40(x=1~3)催化剂催化活性较高的原因所在[17].本实验以Cu0.5H2PW12O40为催化剂催化制备异戊酸异戊酯,在考察该酯化反应影响因素的基础上采用响应面分析法对异戊酸异戊酯的制备工艺进行优化.
-
利用响应面设计软件(Version 6.0.5,Stat-Ease. Inc.,USA),根据Box- Benhnken的中心组合实验设计原理,以Cu0.5H2PW12O40为催化剂,选择对异戊酸异戊酯合成有较大影响的醇酸物质的量比(A)、催化剂(B)用量(本文“催化剂用量”指催化剂质量与异戊酸质量的百分比)、带水剂量(C)、反应时间(D)作为参考因素,异戊酸异戊酯的产率为响应值,以上反应参数是在四因素三水平设计基础上进行优化. 表 2和表 3分别表示的是实验因素及编码水平设计、实验设计方案及结果.其中实验设计方案包括24组析因实验(1~24)和用于估计实验误差的5组重复中心实验(25~29).
-
表 4表示的是以异戊酸异戊酯产率为响应值,通过RSM软件对其反应条件进行优化的方差分析.由表 4可知,模型F=28.57>F0.01(14,14)=3.70,并且p值远远小于0.01,表明该二次回归模型极具有统计学意义;另外,本实验中二次回归模型失拟项不具有统计学意义,即模型拟合度高,误差小.变异系数同样也是评价模型合理性的一个重要参数,其值越小越好.本实验变异系数为1.08%,在可接受范围内,表明实验重复性较好.综上所述,该二次回归模型可用于预测异戊酸异戊酯的产率.本模型中相关系数R2和Adj R2分别为0.966 2和0.932 4,表明该二次回归模型可信度高,具有实际应用意义.
另一方面,由表 4可知,对异戊酸异戊酯产率极具有统计学意义的影响因素有以下几项:B,B2,C,C2,A2,D,BC,AD和BD,对异戊酸异戊酯产率具有统计学意义的影响因素有以下几项:AB和CD.其他变量(p>0.05)均对异戊酸异戊酯产率的影响不具有统计学意义.为了更加直观地表明不同反应参数对异戊酸异戊酯产率的影响大小,经RSM软件拟合得到的二次多项回归方程如下:
-
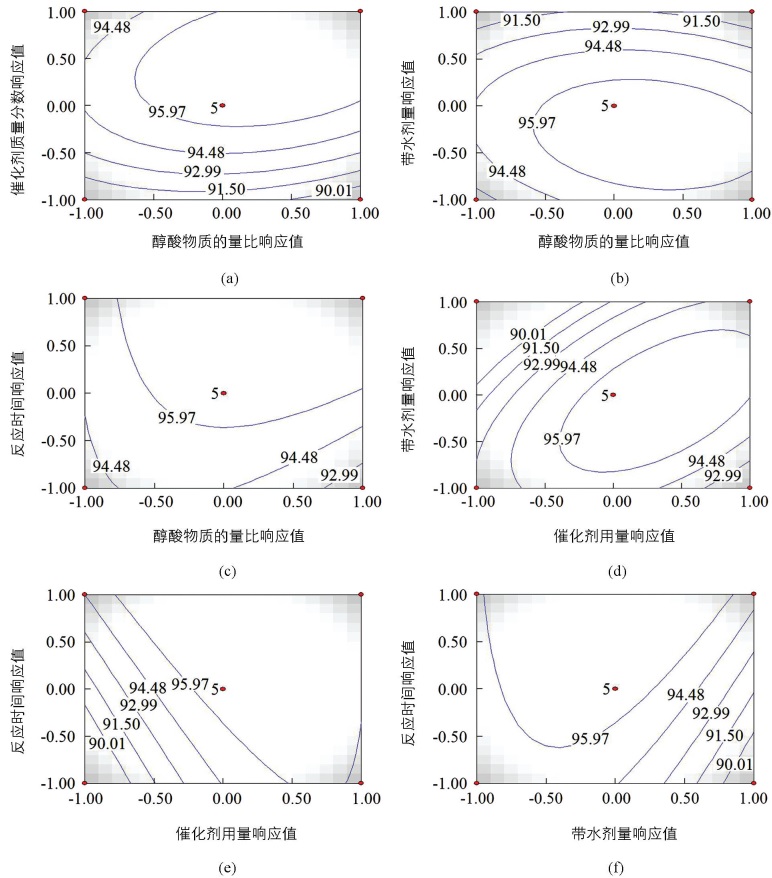
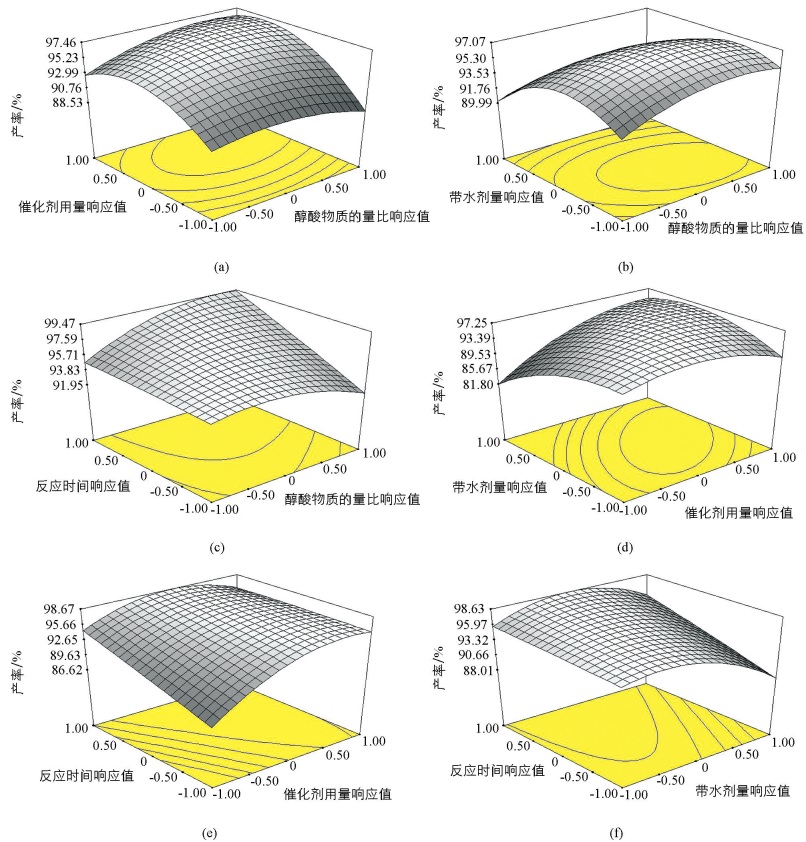
图 1和图 2是借助RSM软件绘制的不同因素之间相互作用的三维曲面图和二维等高线图.从二维等高线的形状可以直观反映出不同因素间交互作用的强弱,高线呈椭圆形表明两因素交互影响显著,而两因素交互作用不显著时等高线呈圆形或近似圆形[25].
图 2(a)表示醇酸物质的量比与催化剂用量交互作用对异戊酸异戊酯产率的影响,由椭圆形的二维图可以看出两因素相互作用显著,这与方差分析结果相一致.当醇酸物质的量比一定时,异戊酸异戊酯产率先随着催化剂用量的增加而缓慢地增加到最大值,随后产率基本保持不变;而当催化剂用量保持一定时,随着醇酸物质的量比的增加,异戊酸异戊酯产率先迅速增加到最大值后缓慢下降.同时由等高线的密集程度可以看出,催化剂用量方向上的等高线更为密集,即催化剂用量较醇酸物质的量比对异戊酸异戊酯产率的影响更为显著.醇酸物质的量比与带水剂量交互作用对异戊酸异戊酯产率的影响见图 2(b),虽然二维等高线呈椭圆状,但由方差分析可知两因素相互作用并不显著.当醇酸物质的量比保持在0.00(1.1:1)时,随着带水剂量的增加,异戊酸异戊酯产率先增加后基本保持不变;而当带水剂加入量保持在0.00(8 mL)时,异戊酸异戊酯产率随着醇酸物质的量比先缓慢增加后迅速下降,并且带水剂量对异戊酸异戊酯产率的影响更为显著.由图 2(c)可以看出醇酸物质的量比和反应时间的变化二者的交互作用显著,并且反应时间方向上的等高线更为密集,所以反应时间对酯产率影响更大.由图 2(d)可以看出,催化剂用量与带水剂量相互作用显著.当催化剂用量保持一定时,随着带水剂量的增加,异戊酸异戊酯产率先迅速增加后缓慢降低;而当带水剂量一定时,异戊酸异戊酯产率随着催化剂用量的增加先迅速升高后基本保持不变.由二维等高线图可知两因素交互作用显著,并且催化剂用量对异戊酸异戊酯产率的影响程度大于带水剂量.由图 2(e)结合方差分析可以看出催化剂的质量分数和反应时间的交互作用显著,并且异戊酸异戊酯产率受到催化剂用量的影响更为敏感. 图 2(f)表示带水剂量与反应时间交互作用对异戊酸异戊酯产率的影响,当反应时间保持一定时,异戊酸异戊酯产率随着带水剂量的增加先迅速增加后缓慢下降;而当带水剂量一定,随着反应时间的增加,酯产率先迅速的增加后基本保持不变.并且反应时间的变化对异戊酸异戊酯产率的影响更为显著.
综上可得,这4个反应参数对异戊酸异戊酯产率的影响大小顺序为:催化剂用量、反应时间、带水剂量、醇酸物质的量比.
-
由响应面分析结果可得,以Cu0.5H2PW12O40为催化剂,通过酯化反应制备异戊酸异戊酯最佳工艺条件为:醇酸物质的量比1.145:1,催化剂用量6.45%,带水剂量8.04 mL,反应时间2.45 h,异戊酸异戊酯的最大酯化率为98.8%.为检验模型预测的准确性,采用上述最佳反应条件做异戊酸与异戊醇酯化反应制备异戊酸异戊酯的实验.为了方便实验,将最佳反应条件修正为醇醛物质的量比1.15:1,催化剂用量6.5%,带水剂量8 mL,反应时间2.5 h,并在此条件下进行3次重复实验,结果分别为98.5%,97.8%,98.0%,平均产率为98.1%,与理论预测值基本相符,这说明该二次回归模型能够较准确地反映各因素对异戊酸异戊酯产率的影响.
-
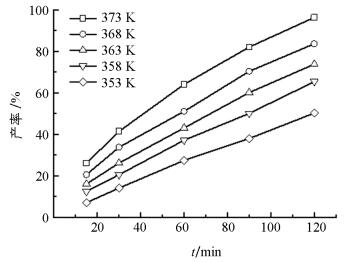
为建立Cu0.5H2PW12O40催化合成异戊酸异戊酯的动力学模型,实验分别在353,358,363,368和373 K温度条件下进行,控制其他反应条件为:醇酸物质的量比1.15:1,带水剂量8 mL,催化剂用量6.5%.每个温度下分别反应15,30,60,90和120 min对产物进行分析.不同温度下异戊酸异戊酯产率随时间的变化见图 3.
酯化反应作为可逆反应,并且在反应过程中会生成水,在本实验条件下,带水剂环己烷的加入可有效去除水成分,有利于反应向正方向进行.由于本反应中体系的体积变化可忽略,故可假定反应为恒容不可逆反应,相应动力学方程表示为:
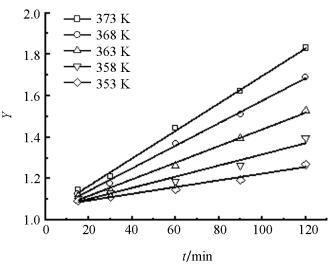
其中:r为异戊酸和异戊醇酯化反应的反应速率,k为正反应速率常数,CA和CB分别是异戊酸和异戊醇的瞬时浓度(mol/L),α和β分别是它们的反应级数.现假设α=β=1,对(1)式积分可得:
其中,CAO与CBO分别表示为异戊酸和异戊醇的初始浓度(mol/L).
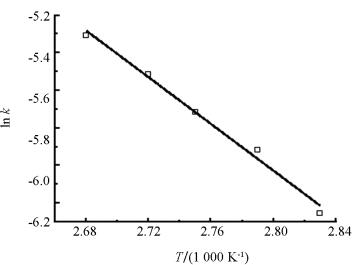
根据不同温度对Y和反应时间t作图(图 4),由此可获得不同温度下的速率常数k.结合Arrhenius公式ln k=-Ea/RT+ln k0作lnk与1/T图(图 5),得到直线方程ln k=-6.22/T+11.38,表明假设成立,说明该酯化反应为二级反应.求得该反应的表观活化能Ea=51.71 kJ/mol,指前因子k0=8.7×104 L/(mol·min),因此磷钨酸铜催化合成异戊酸异戊酯的动力学方程为:
$r = - \frac{{{\rm{d}}{C_A}}}{{{\rm{d}}t}} = 8.7 \times {10^4}{{\rm{e}}^{\left( { - \frac{{51.71}}{{RT}}} \right)}}{C_A}{C_B} $ .
2.1. 不同催化剂对酯化反应的影响
2.2. 响应面法优化异戊酸异戊酯的合成工艺
2.2.1. 分析因素的选取及分析方案
2.2.2. 数学模型的建立与显著性检验
2.2.3. 因素间的交互影响
2.3. 最佳工艺条件的确定
2.4. 异戊酸异戊酯合成反应动力学结果分析
-
1) Cux/2H3-xPW12O40(x=1~3)催化剂催化制备异戊酸异戊酯时具有较高催化活性,该高催化活性与催化剂中Brønsted酸性位与Lewis酸性位间的协同作用及催化反应时的“假液相”行为有关.
2) 以Cu0.5H2PW12O40为催化剂制备异戊酸异戊酯的最佳工艺条件为:n(异戊醇):n(异戊酸)=1.15:1,催化剂用量为6.5%,带水剂环己烷量8 mL,反应时间2.5 h,回流反应条件下异戊酸异戊酯的酯化率最高为98.1%.该优化条件下反应活化能Ea=51.71 kJ/mol,其动力学方程为:
$r = - \frac{{{\rm{d}}{C_A}}}{{{\rm{d}}t}} = 8.7 \times {10^4}{{\rm{e}}^{\left( { - \frac{{51.71}}{{RT}}} \right)}}{C_A}{C_B} $ .



 下载:
下载: