-
多花黄精(Polygonatum cyrtonema Hua)又名姜形黄精,为药食同源植物,以根茎入药[1]. 始载于《名医别录》,性平,味甘,归脾、肾、肺经,具有健脾润肺、补脾益气、滋肾填精的功效[2],根茎主要含有多糖、黄酮类、皂苷类、蒽醌类和挥发油类等化学成分,还含有氨基酸及Fe,Zn等微量元素[3]. 现代药理研究表明,多花黄精具有抗氧化、抗衰老、抗抑郁、抗炎、抗菌、抗肿瘤、抗病毒、降血糖、调节免疫力、改善记忆功能和防治老年痴呆等作用[3-4]. 多花黄精人工栽培研究多有报道[5-7],但有关多花黄精与微生物尤其是土壤真菌的研究未见报道. 随着多花黄精的大规模引种栽培,病害也在不断增加,给药农造成严重的经济损失. 而根腐病是由镰刀菌属引发的一种土传病害[8],是影响多花黄精产量与质量的主要病害. 近年来,作物健康与其根际土壤微生物之间的关系已成为研究热点. 诸多研究表明,植物病害、连作障碍与土壤微生物生态失衡有一定的关系[9-11]. 本研究采用高通量测序方法,分析未种植多花黄精土壤、种植3年生健康多花黄精与患根腐病多花黄精的根际土壤之间真菌群落多样性和组成的变化,从植物与微生物根际互作角度出发,以期明确多花黄精根际土壤的真菌群落组成及其与根腐病的关系,为多花黄精根腐病的防治提供参考.
全文HTML
-
所采集的土壤样品分别来自重庆市南川区槐坪多花黄精种植基地(东经107°13′18.33″,北纬29°08′15.07″),海拔781 m,年降水量为1 100 mm,年均气温为16 ℃. 土壤类型为砂壤土,随机采集3年生栽培5株多花黄精健株、病株根际土壤混合,5点法采集未种植土壤混匀,分别记为HJJ,HJB,未种植作物的荒地土壤为对照组(HJCK). 将土样分为2份,分别用于DNA提取和理化性质及土壤酶活性测定,前者保存于-80 ℃冰箱中,后者自然阴干后进行.
-
采用MP Fast@DNA试剂盒(MP Biomedicals,CA,USA),按照试剂盒使用说明书的操作流程,提取不同土壤样品的总DNA. 通过0.8%琼脂糖凝胶电泳(电泳仪,DYY-6C,北京六一)检测DNA提取质量,同时采用紫外分光光度计(1810D,北京普析)对DNA进行定量. PCR扩增所用引物为真菌ITS1引物(ITS1F:5′-CTTGGTCATTTAGAGGAAGTAA-3′和ITS2R:5′-GCTGCGTTCTTCATCGATGC-3′对ITS区真菌进行扩增,PCR扩增产物经2%琼脂糖凝胶电泳检测后,利用凝胶回收试剂盒对目标片段进行回收,将回收产物送至北京百迈克生物科技有限公司,利用Illumina Hiseq 2500平台进行高通量测序.
-
采用Excel 2010和DPS 7.05对土壤理化性质、酶活性等数据进行分析. 使用FLASH v 1.2.7软件,通过overlap对每个样品的reads进行拼接,得到拼接序列即原始Tags数据(Raw Tags);使用Trimmomatic v 0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据(Clean Tags);使用UCHIME v 4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags);使用QIIME(version 1.8.0)软件,对Tags在97%的相似度水平下进行聚类,获得OTU,并基于UNITE(真菌)分类学数据库对OTU进行分类学注释. 使用Mothur(version v.1.30) 软件,对3个土壤样品进行Alpha多样性指数评估. 使用QIIME软件进行Beta多样性分析,考察土样间群落结构的相似性.
1.1. 材料
1.2. 样品测定
1.2.1. 土壤理化性质
1.2.2. 酶活性测定
1.2.3. 土壤根际真菌的高通量测序
1.3. 数据分析
-
从多花黄精健株(HJJ)、病株(HJB)和对照(HJCK)根际土壤的理化性质变化(表 1)可以看出,土壤pH值变化趋势为HJCK>HJJ>HJB,病株根际土壤pH值显著低于健株和对照(p<0.05),表明经种植多花黄精和感病后土壤逐渐酸化,土壤质量下降. 有机质质量分数变化趋势为HJB>HJJ>HJCK,病株根际土壤有机质质量分数显著高于健株和对照(p<0.05),但健株与对照差异无统计学意义(p>0.05). 碱解氮质量分数变化趋势为HJJ>HJCK>HJB,三者之间差异有统计学意义(p<0.05). 速效磷质量分数变化趋势为HJCK>HJJ>HJB,对照速效磷质量分数高于健株和病株,三者之间差异有统计学意义(p<0.05). 速效钾质量分数变化趋势为HJCK>HJJ>HJB,对照速效钾质量分数高于健株和病株,三者之间差异有统计学意义(p<0.05). 可见,多花黄精感染根腐病后,可引起土样中pH值、有机质、碱解氮、速效磷、速效钾的质量分数发生明显改变.
-
土壤酶是土壤的重要成分之一[12],土壤酶活性的高低能反映土壤生物活性,也是预测植物病害发生的一个重要指标[15-16]. 多花黄精健株(HJJ)、病株(HJB)和对照(HJCK)土壤酶活性变化(表 2)结果表明:多花黄精病株土样中脲酶、蔗糖酶、过氧化氢酶、酸性磷酸酶、酸性蛋白酶活性均呈下降趋势. 土壤脲酶活性变化趋势为HJCK>HJJ>HJB,三者差异有统计学意义(p<0.05). 土壤蔗糖酶活性变化趋势为HJCK>HJJ>HJB,健株、对照与病株差异有统计学意义(p<0.05),但健株与对照差异无统计学意义(p>0.05). 土壤过氧化氢酶活性变化趋势为HJCK>HJJ>HJB,对照显著高于病株和健株,差异有统计学意义(p<0.05),但病株与健株差异无统计学意义(p>0.05). 酸性磷酸酶活性变化趋势为HJCK>HJJ>HJB,病株低于健株和对照,但三者之间差异无统计学意义(p>0.05). 酸性蛋白酶活性变化趋势为HJCK>HJJ>HJB,对照和健株显著高于病株,差异有统计学意义(p<0.05),但对照与健株差异无统计学意义(p>0.05). 由此可见,多花黄精感染根腐病后,土壤酶活性发生了不同变化,表明多花黄精根腐病的发生会导致土壤代谢过程的改变和紊乱.
-
3个土壤样品经测序共获得239 928对Reads(读长),双端Reads拼接、过滤后共产生215 191条Clean tags,平均产生71 730条Clean tags,最少产生70 527条Clean tags.
-
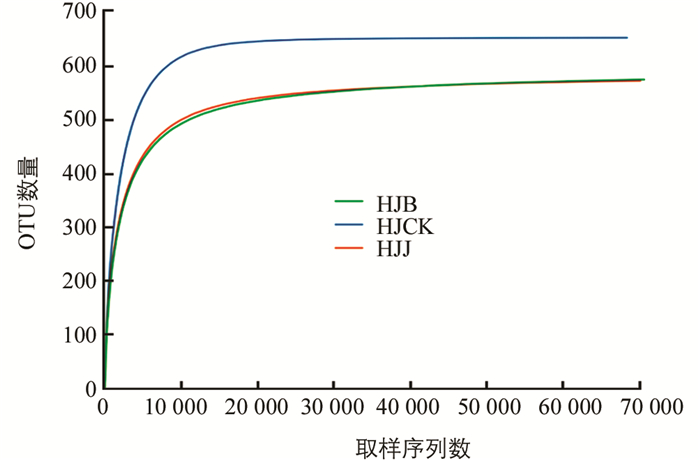
通过高通量测序,获得HJB,HJJ,HJCK 3个土壤样品真菌群落的优化序列及其属或种类数(OTUs)等信息. 分别随机抽取真菌测序样品的ITS1序列读数(Reads),以其属或种类数(OTUs)为纵坐标,ITS1序列读数(Reads)为横坐标,获得真菌的稀释曲线(图 1). 由图 1可知,真菌的ITS1序列读数超过40 000,即OTUs值达到650后,曲线逐渐趋于平缓,说明本次实验的测序量达到饱和,表明PCR扩增的序列基本能体现出土壤样品中真菌群落的组成.
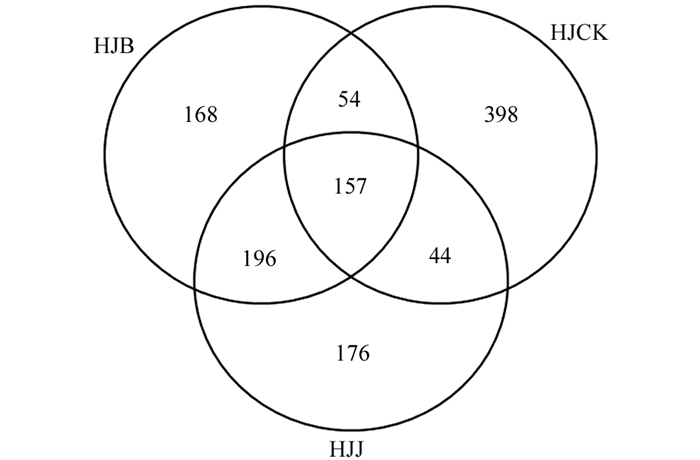
根据不同的相似度水平,使用Usearch软件[17]对Tags在97%的相似度水平下进行聚类、获得OTU,并基于UNITE(真菌)分类学数据库对OTU进行分类学注释. 从图 2中得出,共产生1 193个OTU,其中,HJCK组样品的OTU最多,为653个;其次为HJB组样品,为575个;HJJ组的最少,为573个,说明HJCK组真菌丰度最高,HJB和HJJ组真菌丰度较低,即种植多花黄精后土壤真菌种类均有所下降. HJCK和HJJ共同含有44个OTU,HJCK和HJB共同含有54个OTU,HJJ和HJB共同含有196个OTU,以上数据说明HJJ和HJB的真菌群落相似度较高,HJCK和HJJ的真菌群落相似度较低. HJJ,HJB和HJCK土壤样品共同含有157个OTU,占总OTU的13.16%,表明各个土壤样品拥有不同的OTU,这是多花黄精与土壤微生物相互作用的结果.
-
通过高通量测序及生物信息学分析(表 3),HJB,HJJ,HJCK土样中OTU数分别为575,573,653. ACE和Chao 1指数可估计土壤样品群落的丰度,其指数越大,表明群落丰度越大. HJB,HJJ,HJCK组中ACE指数分别为1 696.15,1 657.80,1 724.58,Chao 1指数分别为1 704.45,1 671.00,1 745.52. HJB,HJJ,HJCK组中辛普森指数分别为0.036 9,0.023 2和0.021 7,香浓指数分别为6.631 1,6.653 5和6.640 5. HJB,HJJ,HJCK土壤样品测序覆盖率分别为0.998 5%,0.998 6%,0.999 4%,说明土壤样品中被测到的序列概率较高,足以覆盖样品菌落组成,能较全面地反映土壤样品的真实情况.
-
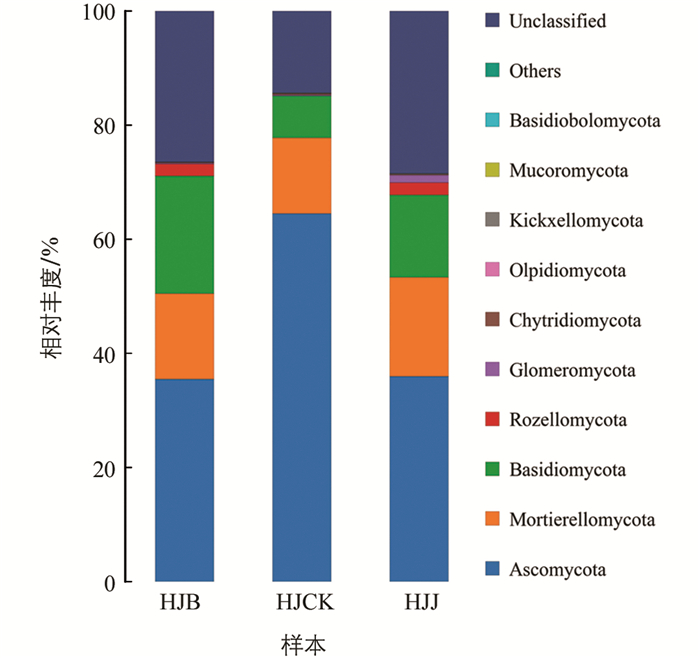
从门水平的分类看,HJB,HJJ和HJCK土壤样品真菌主要分布于11个门,且真菌群落丰度存在一定的差异. 从图 3可以看出,丰度前10的分别为Ascomycota(子囊菌门),Mortierellomycota(丝抱菌门),Basidiomycota(担子菌门),Rozellomycota(隐真菌门),Glomeromycota(球囊菌门),Chytridiomycota(壶菌门),Olpidiomycota(油壶菌门),Kickxellomycota(梳霉门),Mucoromycota(毛霉门)和Basidiobolomycota(蛙粪霉门)等. 其中,Ascomycota在所有土样中的平均丰度为45.36%,是最具有优势的物种,且在HJCK中的丰度比在HJB和HJJ中的高,HJB和HJJ的丰度分别为36.02%和35.52%;而第三大门担子菌门(Basidiomycota)平均丰度分别为14.17%,病株的丰度约为健株的1.43倍. 可见,种植多花黄精后根际土壤真菌多样性降低,根腐病发生后根际土壤真菌群落多样性有所增加,这说明担子菌门与多花黄精根腐病有一定的相关性. 健株和病株土样都有隐真菌门(Rozellomycota),而对照土样中没有;油壶菌门(Olpidiomycota)为健根土样特有门,病株和对照土壤都没有. 另外HJB,HJJ,HJCK还有相对丰度约为26.42%,28.45%和14.33%的待定真菌(Fungi_unclassified)等类群在Gen Bank中没有被明确分类.
从纲水平的分类看,3种多花黄精土壤样品中共获得28纲,其中病株真菌主要分布于21个纲,健株真菌主要分布于19个纲,对照真菌主要分布于23个纲. 主要有Sordariomycetes(子囊菌纲),Mortierellomycetes(被孢霉纲),Agaricomycetes(蘑菇纲),Tremellomycetes(银耳纲),Dothideomycetes(座囊菌纲),Eurotiomycetes(散囊菌纲),Leotiomycetes(锤舌菌纲),Rozellomycotina_cls_Incertae_sedis(无中文名),Laboulbeniomycetes(虫囊菌纲),Pezizomycetes(盘菌纲)等,其中Sordariomycetes是最具有优势的物种,HJCK,HJB和HJJ组的丰度分别为31.10%,19.95%和23.69%. Mortierellomycetes,Agaricomycetes,Tremellomycetes,Dothideomycetes,Eurotiomycetes,Leotiomycetes,Rozellomycotina_cls_Incertae_sedis,Laboulbeniomycetes,Pezizomycetes平均丰度分别为15.15%,9.15%,4.88%,4.58%,2.98%,2.67%,1.41%,1.06%,1.03%. 另外HJB,HJJ,HJCK还有相对丰度约为29.84%,32.26%和17.56%的待定真菌(Fungi_unclassified)等类群在Gen Bank中没有被明确分类.
从目水平的分类看,3种多花黄精土壤样品中共获得62目,其中病株真菌主要分布于51个目,健株真菌主要分布于46个目,对照真菌主要分布于50个目. 多花黄精根际真菌主要分布的10个目分别为Hypocreales(肉座菌目),Mortierellales(被孢霉目),Agaricales(伞菌目),Sordariales(粪壳菌目),Tremellales(银耳目),Pleosporales(假球壳目),Helotiales(柔膜菌目),Eurotiales(散子囊菌目),Dothideomycetes_ord_Incertae_sedis(无中文名),GS08(无中文名)等,其中Hypocreales是最具有优势的物种,HJCK,HJB和HJJ组的相对丰度分别为19.46%,13.41%和13.45%. Mortierellales,Agaricales,Sordariales,Tremellales,Pleosporales,Helotiales,Eurotiales,Dothideomycetes_ord_Incertae_sedis,GS08平均丰度分别为15.15%,7.93%,5.97%,2.75%,2.47%,2.41%,2.10%,1.50%,1.38%. 另外HJB,HJJ,HJCK还有相对丰度约为28.84%,30.22%和15.71%的待定真菌(Fungi_unclassified)等类群在Gen Bank中没有被明确分类.
从科水平的分类看,3种多花黄精土壤样品中共获得125科,其中病株真菌主要分布于81个科,健株真菌主要分布于78个科,对照真菌主要分布于103个科. 多花黄精根际真菌主要分布的10个科分别为Mortierellaceae(被孢霉科),Nectriaceae(丛赤壳科),Pleurotaceae(侧耳科),Chaetomiaceae(毛壳菌科),Trimorphomycetaceae(无中文名),Aspergillaceae(曲霉菌科),Eremomycetaceae(沙漠壳菌科),Hypocreaceae(肉座菌科),Bolbitiaceae(粪锈伞科),Lasiosphaeriaceae(毛球壳科)等,其中Mortierellaceae是最具有优势的物种,HJJ,HJB和HJCK组的丰度为17.26%,14.94%和13.22%. Nectriaceae,Pleurotaceae,Chaetomiaceae,Trimorphomycetaceae,Aspergillaceae,Eremomycetaceae,Hypocreaceae,Bolbitiaceae,Lasiosphaeriaceae平均丰度分别为13.48%,5.86%,4.08%,2.65%,1.77%,1.50%,1.45%,1.30%,1.20%. 另外HJB,HJJ,HJCK还有相对丰度约为39.63%,40.41%和21.60%的待定真菌(Fungi_unclassified)等类群在Gen Bank中没有被明确分类.
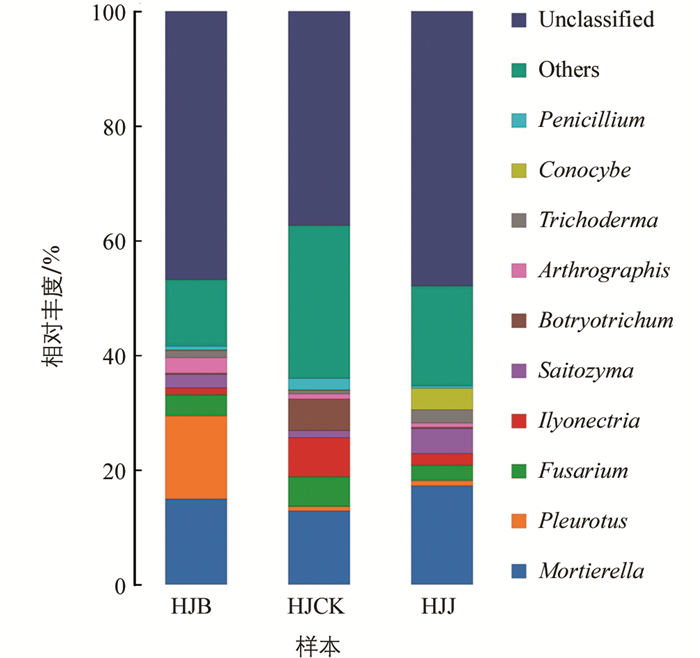
从属水平的分类看,前10位真菌见图 4. 3种多花黄精土壤样品共获得197属,其中病株土样中所含真菌为114属,主要有Pleurotus(侧耳属,15.13%),Mortierella(被孢霉属,14.94%),Fusarium(镰刀霉属,3.02%),Arthrographis(节改菌属,2.65%),Saitozyma(无中文名,2.37%),Trichoderma(木霉属,1.32%),Ilyonectria(土赤壳属,1.23%),Botryotrichum(毛葡孢属,0.20%). HJJ土样中所含真菌为102属,主要有Mortierella(17.27%),Saitozyma(4.36%),Conocybe(锥盖伞属,3.75%),Fusarium(2.68%),Trichoderma(2.30%),Ilyonectria(2.02%),Pleurotus(0.91%). HJCK土样中所含真菌为154属,主要有Mortierella(12.86%),Ilyonectria(6.80%),Botryotrichum(5.48%),Fusarium(5.20%),Penicillium(青霉属,2.07%),Saitozyma(沙蜥属,1.22%),Arthrographis(0.92%),Pleurotus(0.79%). 另外HJB,HJJ,HJCK还有相对丰度约为46.77%,47.91%和37.38%的待定真菌(Fungi_unclassified)等类群在Gen Bank中没有被明确分类.
-
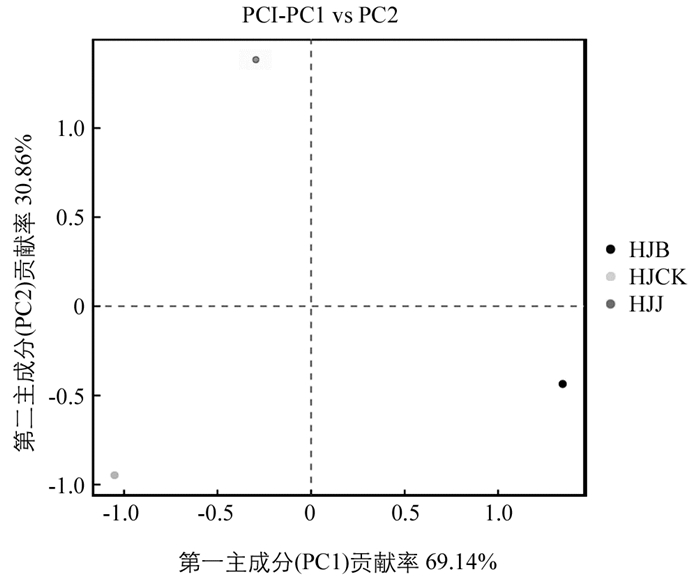
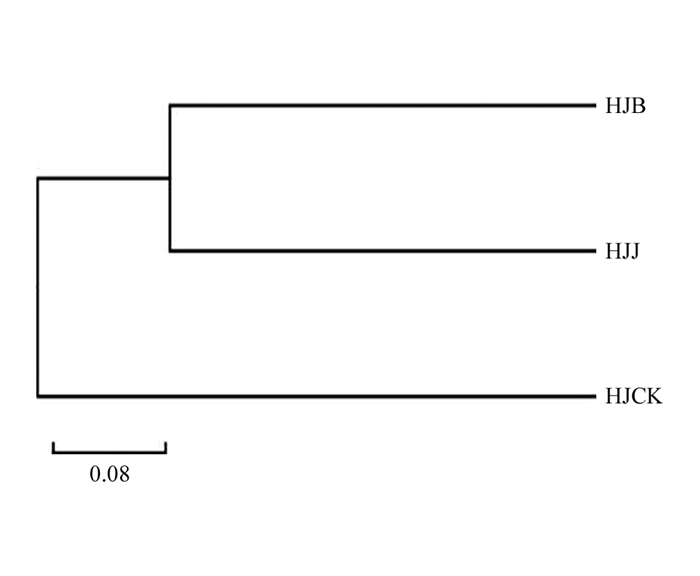
在属水平对不同根际土壤群落组成结构进行PCA主成分分析,与健根相比,多花黄精感病后,根际土壤真菌群落的主成分发生了变异,坐标轴中样本对应的主成分变异度分别为69.14%,30.86%(图 5). HJB位于Y轴右侧的X轴下方,HJJ位于Y轴左侧的X轴上方,HJCK位于Y轴左侧的X轴下方. 从3个土样UPGMA聚类结果(图 6)可以看出,HJB和HJJ土样距离较近,表明它们两者真菌群落结构相似度较高;HJB,HJJ与HJCK间距离相对较远,表明HJCK与HJB,HJJ真菌群落结构均具有明显差异.
-
为了更好地了解土壤理化性质与多花黄精根腐病的关系,对多花黄精根际土壤理化性质与镰刀菌属的相关性进行了分析,从表 4可以看出,镰刀菌属与pH值、速效磷呈极显著正相关(p<0.01);镰刀菌属与速效钾呈显著正相关(p<0.05);镰刀菌属与有机质、碱解氮无显著相关性. 由此表明土壤的理化指标能够影响多花黄精根际土壤中的真菌,特别是镰刀菌属的种类和数量等.
2.1. 土壤理化性质
2.2. 土壤酶活性分析
2.3. 土壤微生物群落结构
2.3.1. 序列长度分布
2.3.2. 不同土壤样品真菌ITS1序列的稀释曲线和OTUs Venn图
2.3.3. ITS1序列的测序质量及多样性统计分析
2.3.4. 真菌群落的组成
2.3.5. 根际真菌群落的beta多样性分析
2.3.6. 根际土壤理化性质与镰刀菌属相关性分析
-
植物与其根际土壤关系最为密切,根际土壤中的微生物是根际微生态的重要组成部分,对植物生长发育起着至关重要的作用[17]. 研究表明,作物病害和土壤理化性质之间相互作用并存在一定的关系,如土壤pH值,含水量,N,P,K元素质量分数等直接或间接影响植物的抗病性[18]. 本实验结果表明,与健株相比,多花黄精病株根际土壤pH值、碱解氮、速效磷及速效钾质量分数等非生物因子均呈下降趋势,尤其是碱解氮质量分数下降明显,而有机质质量分数则相反,呈上升趋势. 这与陈杰等[19]对马铃薯健、病株根际土壤中有机质、pH值、速效磷、速效钾的研究结果一致. 相关性分析发现,土壤pH值与土壤真菌(镰刀菌属)呈极显著正相关,这说明土壤pH值的改变是产生多花黄精根腐病的原因之一,在多花黄精大田生产中,可以根据土壤pH值的变化特征,通过调节土壤pH值,如施用腐殖酸类有机肥加以改善,以防治根腐病的发生.
土壤酶活性是衡量土壤质量变化的指标之一,其中蔗糖酶、磷酸酶、脲酶等水解酶的总体活性对评价土壤肥力水平具有重要意义[20]. 本实验发现,与健根相比,病根根际土壤中的脲酶、蔗糖酶、过氧化氢酶、酸性磷酸酶和酸性蛋白酶活性均有不同程度的降低,这与游春梅等[15]、寻路路等[21]在不同作物的研究中结论相似,说明脲酶、蔗糖酶、过氧化氢酶、酸性磷酸酶和酸性蛋白酶等与植物病害的发生有关,在不同植物上都有类似现象. 多花黄精根腐病不同发病程度的酶活性变化趋势还有待进一步研究.
真菌是土壤微生物的重要组成部分,多数作物病害的发生与真菌群落结构、多样性等密切相关[22]. 本实验通过分析比较多花黄精根腐病植株和健康植株根际土壤真菌群落结构及多样性差异,发现病株根际土壤真菌丰度及多样性都高于健株根际土,说明土壤真菌群落的变化受生长植株的影响,还与土壤因子、生态扰动有关[23-24]. 3种土样中为Ascomycota,Mortierellomycota,Basidiomycota为优势种群门,Pleurotus,Mortierella,Fusarium为优势种群属,这与杨珍等[25]报道的子囊菌门、镰刀菌属等是多种植物根际真菌优势类群的研究结论基本一致. 镰刀菌属中的尖孢镰刀菌(Fusarium oxysporum)和腐皮镰刀菌(F. solani)被认为是造成多花黄精根腐病的两种致病菌[8]. 研究发现,病株中镰刀菌属相对丰度高于健株根际土壤,这与于慧瑛等[9]研究根腐人参根际土壤中的真菌结果相似. 与多花黄精健根根际土壤中木霉属相比,病根较健株降低了42.61%. 由此表明病株根际土壤真菌群落结构失衡,有益菌减少,导致病原菌大量滋生和繁殖. 木霉属已被证实对植物生长具有明显的促进作用,在多花黄精生产中,充分利用这一有益菌有助于减少农药化肥的使用,促进生长和防控病害的发生.
多花黄精感染根腐病后,根际土壤中理化性质、酶活性、真菌群落组成及多样性都发生了改变,病原菌相对丰度增加而有益真菌相对丰度降低,导致土壤微生态环境的恶化、微生物群落结构失衡,从而造成根际微生物种类明显不同,影响多花黄精的生长. 另外,多花黄精根际土壤中存在木霉属等生防真菌,因此,应进一步筛选根际微生物对病原菌有抑制作用的微生物,为有效利用植物微生态调控措施防止多花黄精根腐病提供理论依据.



 下载:
下载: