-
开放科学(资源服务)标识码(OSID):

白及[Bletilla striata (Thunb.) Rchb. f.],又名白给、地螺丝,是兰科白及属多年生草本植物,也是我国传统的药用植物. 白及具有收敛止血、消肿生肌和美容的功效,首次记载于汉代的《神农本草经》,已被《中国药典》收录[1]. 白及提取液可用于血管栓塞剂、代血浆等医用材料,白及多糖胶可作为食品保鲜剂[2]. 白及因药用功能的挖掘而不断扩大其应用范围和市场需求,其价格也从10元/kg增至800~1 000元/kg[3]. 近年来,随着白及组培技术的建立和成熟[4],人工种植业开始兴起,多集中在我国西南、华中以及长江流域等地区,然而伴随的白及病害也逐渐增加,严重时造成白及大幅度减产,影响了白及产业的发展.
目前对白及的研究多集中于药用价值及种植方面,对白及病害的研究较少. 已报道的真菌病害有:Fusarium oxysporum可引起白及根腐病[5],F. fujikuroi可引起白及黑斑病[6],Epicoccum sorghinum可引起白及叶斑病[7]. 炭疽病是由刺盘孢属(Colletotrichum spp.)真菌引起的植物病害的总称,危害植物叶片、茎和果实. 本研究在对广西桂林市白及种植基地病害调查中发现叶片上有疑似炭疽病,且病害严重. 通过采集白及发病叶片组织,利用组织分离法与单孢纯化法分离病原,结合显微形态与多基因系统发育分析鉴定该病害病原,明确桂林市白及种植基地炭疽病病原菌的分类地位,并通过室内毒力测定进一步筛选出防治白及炭疽病的有效杀菌剂,以期为白及炭疽病病原真菌的科学诊断与病害防治提供理论基础.
全文HTML
-
供试病害植株与健康植株均从广西桂林市白及种植基地采集. 炭疽病病症植株放入无菌袋中保存并编号,带入实验室分离. 采集健康白及块茎放入温室培养.
-
材料有Taq DNA聚合酶,10× EasyTaq Buffer,dNTP,氯仿,异丙醇,1% CTAB. 供试杀菌剂共8种,分别为多菌灵(Carbendazim,50%可湿性粉剂,四川国光农化股份有限公司);代森锰锌(Mancozeb,70%可湿性粉剂,四川国光农化股份有限公司);代森锌(Zineb,70%可湿性粉剂,四川国光农化股份有限公司);苯菌灵(Benomyl,l0%可湿性粉剂,蓝丰生物化工有限公司);丙森锌(Propineb,70%可湿性粉剂,德国拜耳作物科学公司);苯醚甲环唑(Difenoconazole,10%水分散粒剂,瑞德丰生物科技);肟菌戊唑醇(Nativo,75%水分散粒剂,德国拜耳作物科学公司);敌磺钠(Fenaminosulf,70%可湿性粉剂,山东天威农药有限公司).
所用培养基共3种,分别为马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂20 g,水1 L;燕麦培养基(OA):燕麦片30 g,琼脂20 g,水1 L;麦芽汁培养基(MEA):麦芽浸提物34 g,琼脂20 g,水1 L.
-
莱卡生物显微镜(DM2000 LED),德国徕卡;超净工作台(S.SW-CJ-2F型),恒宇公司;电热恒温培养箱(HPS-250型),哈尔滨市东明医疗仪器厂;台式微量离心机(D3024型),大龙兴创实验仪器(北京)股份有限公司;全自动立式高压灭菌器(GI54DP型),厦门致微仪器有限公司;PCR仪(PDC0200型),BOD-RAD;电泳仪(JY600PJ型),北京君意东方电泳设备有限公司;相机(2013DJ6792型),佳能有限公司.
1.1. 供试植物材料
1.2. 供试材料及培养基
1.3. 主要设备仪器
-
2019年5月至7月,在广西桂林市白及种植基地发现疑似炭疽病病症的白及叶片,拍照记录田间发病样苗病灶,采集发病样苗带回实验室.
-
对患病叶片观察、拍照并标号,采取组织分离法[8]分离病原菌. 将叶片洗净后取多个病健交界处叶块(5 mm×5 mm),表面消毒晾干后置于PDA平板上,于25 ℃恒温培养箱中黑暗培养. 待组织长出菌落后,在新鲜的PDA平板上收集分生孢子,制备悬浮液(106个/mL),利用平板稀释画线法纯化病原菌[9],纯培养物用PDA斜面保存于4 ℃冰箱中.
-
将纯培养物接种到含氯霉素(25 μg/mL)的PDA上,25 ℃黑暗培养5 d,用打孔器获取直径5 mm菌饼待用,将健康白及叶片消毒,用牙签在叶片上间隔5 cm制造伤口,在伤口处接种菌饼,刺伤的白及叶片作为空白对照,定期观察叶片发病情况并记录,重复3次.
-
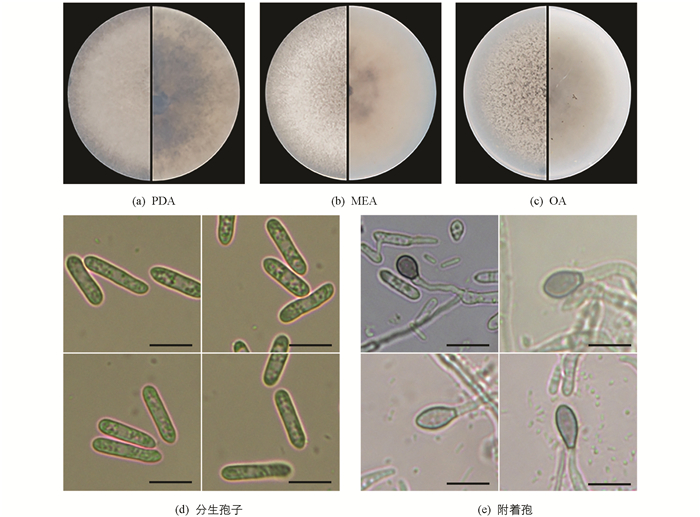
将纯化物接种于马铃薯葡萄糖琼脂培养基(PDA)、燕麦培养基(OA)、麦芽汁培养基(MEA),7 d后拍照记录菌落形态. 接种菌饼(直径为5 mm)于PDA平板中央,间隔24 h测量菌落半径,培养5 d,采用十字交叉法测量菌株生长速度(v):
式中,r为菌落半径实际平均值,d为培养天数. 制备分生孢子悬浮液,滴在载玻片上观察分生孢子并拍照,孢子悬浮液保湿培养12 h,40倍镜下观察到分生孢子附着孢,利用ImageJ软件[10]测量50个分生孢子及附着孢大小.
-
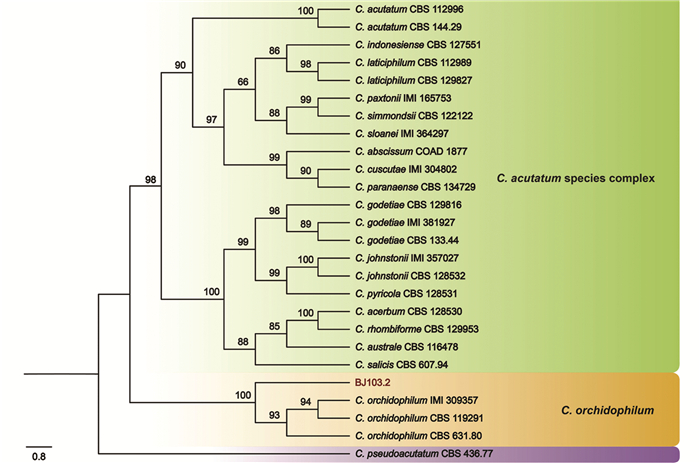
接种培养物于PDA中,待菌丝长满后,使用CTAB法[11]提取DNA. 用引物(表 1)分别扩增ITS,ACT,TUB2,CHS-1,GAPDH,HIS3,引物均由武汉奥科鼎盛生物科技有限公司合成. 扩增体系(25 μL):无菌去离子水20.9 μL,10×EasyTaq Buffer 2.5 μL,上下游引物(10 μmol/L)各0.5 μL,EasyTaq 0.1 μL,DNA模板1 μL. 扩增程序:94 ℃预变性3 min,94 ℃变性45 s,55 ℃退火30 s,72 ℃延伸45 s,循环35次,72 ℃延伸10 min,4 ℃保温. 扩增完成后,1%琼脂糖凝胶电泳检测,将符合预期大小的PCR产物送武汉奥科鼎盛生物科技有限公司测序,使用Vector NTI软件[12]对测序结果进行检查校准,将序列上传NCBI数据库获得序列登录号. 依据Damm等[13]以及Marin-Felix等[14]的报告获得参考序列登录号(表 2),利用TBtools[15]下载参考序列,通过PhyloSuite1.22软件[16]进行序列比对和拼接,并采用ML(最大似然法)构建系统发育树,设置自检值为20 000,选择C. pseudoactatum作为外类群.
-
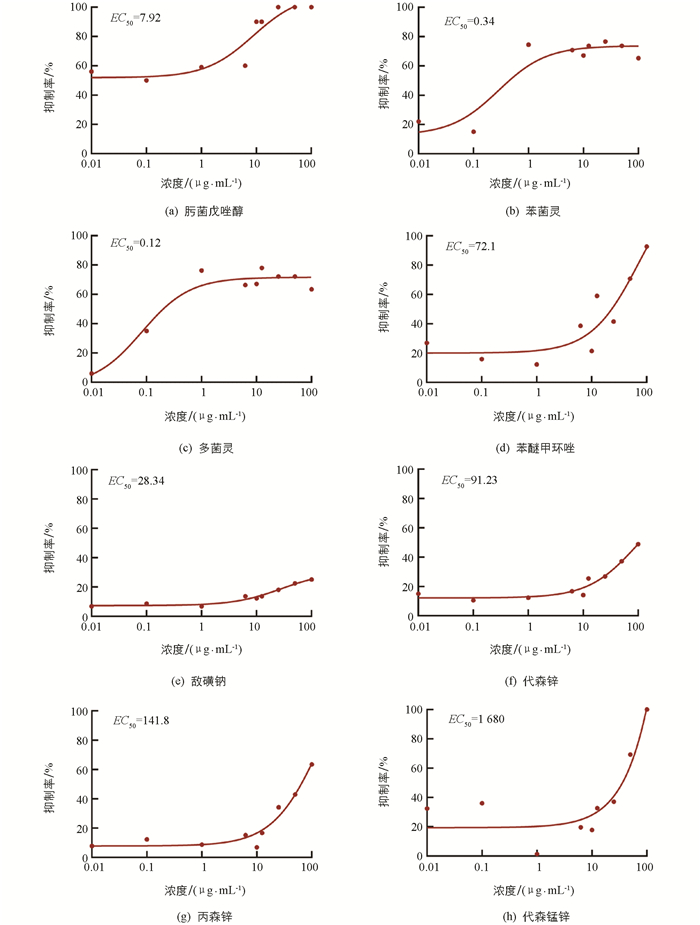
采用菌丝生长速率法测定杀菌剂对白及炭疽病菌的室内毒力,供试杀菌剂浓度依次设置为0.01,0.1,1,6.25,10,12.5,25,50,100 μg/mL[24],以无菌水作为空白对照,每处理重复2次,96 h后采用十字交叉法测得不同处理的菌落直径,通过Excel 2010计算不同浓度杀菌剂对病原菌生长的抑制率. 选取浓度为0.01,0.1,1,10,100 μg/mL处理组展示药剂抑制效果.
式中,I为抑制率(%),dc为空白对照菌落纯生长量,dt为实验组菌落纯生长量,菌落纯生长量通过实验组菌落平均直径减去接种菌饼直径测得.
采用GraphPad Prism 8.0以杀菌剂浓度为横坐标,抑制率为纵坐标制作杀菌剂抑制作用曲线图,并计算半数有效浓度(EC50),判断不同杀菌剂的药效.
2.1. 田间病害观察与样品采集
2.2. 病原菌的分离、纯化及保存
2.3. 致病性测定
2.4. 形态学观察
2.5. 分子生物学鉴定
2.6. 不同杀菌剂对病原室内毒力测定
-
病害初期表现为叶片上出现深褐色的不规则状斑点,单个叶片出现多个病斑,病健交界处明显,后期病斑扩大,融合形成不规则的深褐色大病斑,继而整个叶片枯萎(图 1). 该病害为白及种植基地多发病害,造成白及叶片脱落,植株死亡.
-
接种分离病原菌典型菌株BJ103.2,叶片3 d后出现黄褐色病斑,6 d后病斑扩大为椭圆形,接种部位有菌丝出现,9 d后,病斑蔓延到整个叶片,叶片枯萎;对照组(CK)不发病(图 2),该症状与田间症状相似. 再次从该发病叶片病健交界处分离病原菌,与所接种病原菌一致. 依据柯赫氏法则,分离菌株BJ103.2为白及炭疽病的致病菌.
-
在PDA平板上,恒温培养箱内25 ℃黑暗培养病原菌,2 d后菌丝直径为1.2 cm,7 d后长成完整的圆形菌落,平均生长速度为0.43 cm/d. 表面为淡绿色毯状的气生菌丝,整体凸起. 菌落背面中心为墨绿色,外圈为绿色. 接种于MEA平板,培养条件一致,菌落呈圆形,表面扁平,毯状菌丝,菌落背面中心为黄褐色,外圈为淡黄色. 接种于OA平板,培养条件一致,菌落呈圆形,表面扁平,束状菌丝,菌落背面中心为灰褐色,外圈为白色(图 3a-3c). 显微镜下,无分生孢子堆和刚毛,分生孢子簇生于孢子梗,分生孢子呈棒状形,两端微钝或一端稍尖,单胞,接近无色,大小为(8.6~19.4)μm×(1.6~4.2)μm(图 3d). 孢子梗无色,有隔;分生孢子萌发可以从一端或两端同时长出牙管,并在一端形成分生孢子附着孢,呈椭圆形或灯泡形,边缘平滑,浅灰色,大小为(3.4~9.5)μm×(2.9~6.6)μm(图 3e). 依据Damm等[13]形态学特征的报告,初步判断该病原菌为炭疽病属真菌.
-
以代表菌株BJ103.2的基因组DNA为模板进行PCR扩增,测序后将序列上传NCBI数据库,获得序列登录号,ITS(MZ268251),GAPDH(MZ889101),CHS-1 (MZ267729),HIS3 (MZ267730),ACT(MZ267728)以及TUB2 (MZ267731). ITS,ACT,CHS-1,HIS3,GAPDH,TUB2序列BLAST结果显示,菌株BJ103.2与CBS 631.80相应序列一致度高于97%. 以ITS进行比对,BJ103.2与C. orchidophilum(登录号:JQ948152)序列一致度为99.26%(533/537,存在2个Gap);以ACT进行比对,与C. orchidophilum(登录号:JQ949473)序列一致度为98.78%(243/246,无Gap);以CHS-1进行比对,与C. orchidophilum(登录号:JQ948813)序列一致度为98.23%(277/282,无Gap);以HIS3进行比对,与C. orchidophilum(登录号:JQ949143)序列一致度为97.64%(373/382,无Gap);以GAPDH进行比对,与C. orchidophilum(登录号:JQ948482)序列一致度为97.06%(198/204,存在2个Gap);以TUB2进行比对,与C. orchidophilum(登录号:JQ949803)序列一致度为99.18%(486/490,存在1个Gap). 构建系统发育树,结果显示,BJ103.2与炭疽病属C. orchidophilum聚为同一支,其自举值大于90(图 4). 结合形态特征,鉴定该病原菌为C. orchidophilum.
-
结果表明,8种药剂对病原菌生长均有抑制作用,但不同杀菌剂对病原菌生长的抑制作用不同. 肟菌戊唑醇、多菌灵、苯菌灵、代森锰锌、苯醚甲环唑的抑制作用明显,在浓度分别为8.5,5.8,32.8,48.8,55.2 μg/mL时,抑制率大于60%,但多菌灵并不能完全抑制病原菌的生长. 此外,在浓度分别为71.7 μg/mL和98.2 μg/mL时,肟菌戊唑醇与代森锰锌抑制率达到100%,但白及炭疽病对肟菌戊唑醇比较敏感,其EC50为7.92 μg/mL,代森锰锌EC50为1 680 μg/mL,表明病原菌对其不敏感. 敌磺钠与代森锌抑制效果较差,在炭疽病防治中不具有指导意义. 综上所述,肟菌戊唑醇可作为防治白及炭疽病的有效杀菌剂.
3.1. 白及炭疽病田间症状
3.2. 病原菌致病性测定
3.3. 病原菌形态学特征
3.4. 系统发育学分析
3.5. 不同杀菌剂对病原室内毒力测定
-
炭疽病菌的寄主广泛,传播途径多,其孢子在土壤中越冬,通过雨水或人工浇水在农田中广泛传播,也可通过病虫与栽培人员进行传播. 其侵染能力强,危害程度大,对我国农业发展有严重的影响,如C. fioriniae能导致四川肉桂炭疽病[25],C. fructicola能引起樱桃炭疽病[26],C. acutatum能引起西班牙扁桃炭疽病[27]. C. orchidophilum主要在兰科植物上引起炭疽病,1902年正式命名,2011年在我国南方的多种兰科植物上发现该种病原菌[28]. 本研究通过致病实验,结合形态学和分子生物学证据,明确该种白及炭疽病病原菌为C. orchidophilum,在广西省内首次报道. 该病原在自然状态下致病力极强,有待于进一步开展致病机理和科学防控研究.
在本研究中,通过生长抑制实验,发现肟菌戊唑醇能有效抑制C. orchidophilum在PDA上的生长. 肟菌戊唑醇水分散粒剂是肟菌酯和戊唑醇混合而成的杀菌剂,其中肟菌酯是一种呼吸抑制剂,通过抑制呼吸作用达到抑菌效果,而戊唑醇可抑制病原真菌体内甾醇脱甲基化,阻碍菌丝生长. 肟菌戊唑醇对水稻稻曲病、香蕉黑星病、黄瓜白粉病、炭疽病、白菜炭疽病和番茄早疫病有良好的防治效果[29]. 研究表明,在PDA上,8种不同杀菌剂对典型菌株BJ103.2菌丝生长的抑制作用不同,其中肟菌戊唑醇对C. orchidophilum的抑制作用最强,EC50为7.92 μg/mL,暗示在种植基地喷洒肟菌戊唑醇防治该种白及炭疽病可取得较好的效果. 本研究中的药敏实验是在室内进行的,由于田间环境与实验室环境存在一定差异,所以在实际应用之前,有必要开展后续田间药效实验.




 下载:
下载: