-
开放科学(资源服务)标识码(OSID):

-
造成柑橘产业重大经济损失的柑橘衰退病是由柑橘衰退病毒(citrus tristeza virus,CTV)引起的[1-2]. CTV编码的RNA沉默抑制子包括p23,p20和p25,其中p20蛋白聚集在无定形的包涵体中,细胞内和细胞间沉默的发生也能被p20蛋白同时抑制[3-4]. CTV编码的这3个VSR对柑橘的抗性有显著影响,其中p20的甲基化与CTV的致病机制可能有关联[5]. CTV也会强烈影响柑橘体内激素代谢的途径,有研究表明柑橘受到CTV的侵染后,GA调节通路的有些相关基因表达会被显著诱导[6]. 因此研究CTV强弱分离株中p20的表达特征,分析对SA通路关键基因表达的影响,对于解析CTV致病机理及柑橘衰退病的预防有重要理论和实践意义.
CTV在柑橘中主要引起速衰型(QD)、茎陷点型(SP)和苗黄型(SY)3种类型的症状,不同的CTV分离株,致病力强弱有所差异[7-8]. CTV属于长线形病毒属(Closterovirus),是正单链RNA病毒,约是19.3 kb,含有12个开放阅读框,能够编码19种以上分子量不同的蛋白产物[1, 9]. RNA沉默(VSR)的病毒抑制因子在病毒成功入侵植物中起着重要作用,作为一种反防御策略,大多数植物病毒已经进化出RNA沉默(VSR)的病毒抑制因子及靶向植物抗病毒沉默反应的路径[10-11]. 通过干扰miRNA途径、siRNA的积累或miRNA*的特异性积累等方式RNA沉默抑制因子可抑制寄主的基因沉默,进而影响病毒在植株中的复制及病毒致病性[12-13]. p20转基因沉默植株增强了寄主对CTV的抗病性,表明p20与CTV的致病性密切相关[14-15]. 王亚飞等[16]发现CTV甜橙p20的种群结构很复杂,种群变异水平更高;而基因沉默抑制子的关键氨基酸位点变异对病害症状有一定影响,茉莉H病毒(jasmine virus H,JaVH)的CP蛋白的13个氨基酸位点(Trp 28,Arg 40,Arg 58,Gly 75,Ile 83,Thr84,Val 108,Phe 111,Ser 115,Lys 123,Tyr 124,Arg 132和Lys 200)主要影响该蛋白的VSR功能[17]. 甘蔗黄叶病毒(sugarcane yellow leaf virus,SCYLV)的RNA沉默抑制子P0蛋白的保守区域(N端15个氨基酸和C端102个氨基酸)是P0发挥沉默抑制子功能所必需的,这些氨基酸位点正向突变会影响病毒的致病性[18]. CTV p23几个氨基酸位点变异会影响基因沉默活性[19].
越来越多的研究表明,SA通路PR蛋白在植物对病原体感染的反应中起着关键作用,它们可以在植物中被激活以响应病原体的攻击,PR1基因转录本的表达水平是许多植物病原体系统中植物防御反应的最佳表征指标之一[20-22]. NPR1是SA信号通路的主要调节因子,控制包括SAR在内的多种免疫反应,在SA信号转导中,SAR相关基因的上调表达导致植物抗病性增加[23]. 当CTV侵染时水杨酸(SA)介导的信号转导网络会激活寄主植物对入侵病原体的防御反应,途径上相关基因的转录水平也会发生相应的变化. 黄瓜花叶病毒(cucumber mosaic virus,CMV)侵染改变了寄主的SA代谢途径[24],花椰菜花叶病毒(cauliflower mosaic virus,CaMV)沉默抑制子P6烟草中瞬时表达及转基因植物改变了该病毒诱导的SA信号通路关键基因PR-1的转录水平[25].
p20蛋白是CTV编码的3个RNA沉默抑制子之一,对致病性具有重要的作用. 明确强弱毒分离株中沉默抑制子p20的表达特性,通过在烟草中瞬时表达p20基因,分析p20沉默抑制子活性及其对SA信号通路关键基因PR1,PR1a和NPR1的影响表达水平,旨在为深入开展柑橘衰退病的预防研究提供依据.
全文HTML
-
试验于2021-2023年在西南大学柑桔研究所脱毒中心实验室完成.
-
本研究所用的主要试验材料为西南大学柑桔研究所脱毒中心接毒1年以上的柑橘衰退病毒源植株强毒株CT14A和弱毒株CT11A,CT16-2及CTLJ;其次是用于p20变异分析的从NCBI中选用已确定强弱的9个CTV分离株. 具体信息见表 1. 另外,还有用于遗传转化的T-CT14A p20载体及本实验室保存的16c烟草(转GFP基因本氏烟16c株系)和本氏烟(Nicotiana benthamiana).
-
RNAios Plus试剂、2×PrimeSTAR© Max DNA Polymerase、DL2000 DNA Marker购自TaKaRa公司,NovoScript© Plus All-in-one 1st Strand cDNA Synthesis SuperMix反转录酶试剂盒购自Novoprotein公司,PGEM-T Easy Vector SystemⅠ购自Promega公司,EasyPure Quick Gel Extraction Kit试剂盒购自全式金公司,All-in-One 5xRT MasterMix (G592)、BlasTaqTM 2xqPCR MasterMix (G891)购于镇江爱必梦(ABM)生物科技有限公司,质粒小提试剂盒购自Tiangen公司,植物蛋白提取试剂盒购自Solarbio Life Sciences公司,anti-GFP购自Proteintech,PGEM-T Easy Vector SystemⅠ购自Promega公司,大肠杆菌(Escherichia coli)DH5α和农杆菌GV3101感受态细胞购自上海唯地生物技术有限公司. 所用引物由北京擎科生物科技有限公司合成.
-
称取0.1 g左右的柑桔叶片主脉及附近叶肉,经液氮速冻后用冷冻磨样机充分研磨后加入1 mL RNAios Plus提取液,充分振荡混匀. 后续步骤按照RNAios Plus说明书进行.
-
本试验中克隆、测序了CT16-2和CTLJ 2个分离株的p20基因. 以毒源CT16-2和CTLJ柑橘叶片的总RNA为模板,采用反转录试剂盒(Novoprotein公司)合成cDNA,随即用特异性引物kz CT14Ap20-TF(5'aagcggatccagattccttc-3')和kz CT14Ap20-TR(5'-gtttgtccgctagtatcg-3')进行PCR扩增. 反应条件:98 ℃预变性3 min;然后98 ℃变性30 s,56 ℃退火30 s,72 ℃延伸40 s,34个循环;最后72 ℃延伸10 min. 为了确保PCR的准确性,反应体系中应用了2×PrimeSTAR© Max DNA Polymerase(TaKaRa公司). PCR产物经1.2%琼脂糖凝胶电泳检测,按全式金胶回收试剂盒说明书纯化回收目的片段.
-
将纯化回收的目的DNA片段通过pGEM-T Easy Vector(Promega公司)连接,转化E. coli DH5α,菌液PCR筛选阳性克隆T-CT16-2 p20和T-CTLJ p20,随机挑选4个阳性克隆送北京擎科生物技术有限公司测序. 将测序正确的CT16-2 p20和CTLJ p20氨基酸序列与从NCBI上下载已确定强弱CTV分离株的p20氨基酸序列通过DNASMAN和MEGA7软件进行序列比对分析和构建系统发育树.
-
用Sal I和Kpn I双酶切T-CTLJ p20和T-CT14A p20,回收目的片段,与双元表达载体pCHF3用双酶切法连接,转化大肠杆菌DH5α并筛选阳性克隆. 测序验证重组植物表达载体pCHF3-CT14A p20和pCHF3-CTLJ p20携带的p20基因序列正确后,再用热激法转化农杆菌GV3101.
-
pCHF3空载体为对照,将携带pCHF3-CT14A p20和pCHF3-CTLJ p20植物表达载体的农杆菌GV3101浸润于本氏烟中. 将农杆菌在LB液体培养基中28 ℃振荡培养至OD600为0.6~0.8,离心收集菌体,重悬至OD600为1.0. 室温下黑暗静置2 h后,使用无针头的注射器将重悬液注射到4~6叶龄的本氏烟叶背.
-
以TBSV的P19为阳性对照,pCHF3为阴性对照. 将不同构建体组合转化的农杆菌和携带GFP基因的农杆菌等比例混合,分区共浸润本氏烟和16c烟草中,浸润4 d后,在暗室用手持紫外灯对侵染烟草叶片的GFP荧光表达情况进行观察.
利用植物总蛋白提取试剂盒(Solarbio LifeSciences)提取了瞬时表达的本氏烟叶片的总蛋白,用anti-GFP(Proteintech)进行Western blot,β-Actin蛋白作为内参基因. 用Image J软件测量各蛋白条带的灰度值,试验重复3次.
-
应用TCA-丙酮沉淀法提取其总蛋白. 经SDS-PAGE电泳,转PVDF膜,用实验室保存的CTV p20蛋白多克隆抗体进行Western blot,用Image J软件测量各蛋白条带的灰度值. 用β-Actin蛋白作为内参基因,以p20蛋白条带灰度值/β-Actin蛋白条带灰度值作为相对表达量,试验重复3次.
1.1. 材料
1.1.1. 试验材料
1.1.2. 试剂、克隆载体及菌株
1.2. 方法
1.2.1. 柑桔叶片总RNA的提取
1.2.2. p20基因扩增及纯化
1.2.3. p20克隆与氨基酸序列分析
1.2.4. 植物表达载体的构建及农杆菌转化
1.2.5. 本氏烟瞬时表达p20
1.2.6. 沉默抑制子活性鉴定
1.2.7. Western blot检测p20表达特性
-
CTV p20的549个核苷酸编码182个氨基酸,11个分离株共有25个变异位点. 弱毒株CTLJ有9个位点发生变异,是11个分离株中变异位点最多的. 第12和122位氨基酸发生的变异为S→T,第19位氨基酸发生的变异为A→S,第29位氨基酸发生的变异为V→I,第94和138位氨基酸发生的变异为D→E,第105和110位氨基酸发生的变异为M→V,第142位氨基酸发生的变异为A→T. 其中第19和142位氨基酸极性也发生了变化,并且第12和29位变异位点是CTLJ特有的,其余7个位点氨基酸在其他分离株也发生了变异. 强毒株CT14A p20的氨基酸序列只有3个变异位点,第87位氨基酸发生的变异为V→I,第118位氨基酸发生的变异为T→I,第165位氨基酸发生的变异为A→S,并且CTV14A毒株p20的氨基酸变异位点与CTLJ毒株p20的氨基酸变异位点均不相同(图 1).
-
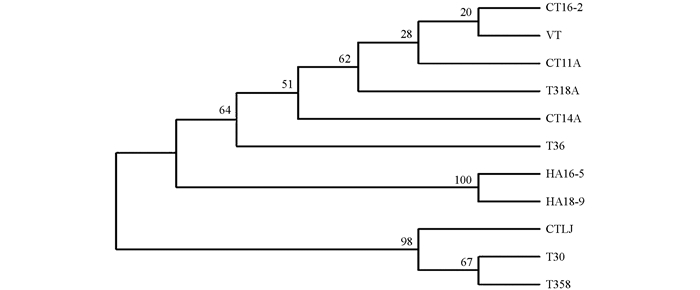
将从NCBI上选用已确定CTV强弱株系的9个分离株与中国的强毒株CTA14及弱毒株CT11A,CT16-2和CTLJ分离株p20的氨基酸序列一起通过软件MEGA7进行分析. 系统进化树分析表明,弱毒株CTLJ与弱毒分离株T30,T385聚为一簇,亲缘关系最近,同源性达到98.35%. 中国其他3个分离株(CTA14,CT11A,CT16-2)与VT和T318A聚为一簇. CTLJ与其他8个株系间的同源性为91.76%~94.51%,是差异较大的一个株系(图 2).
-
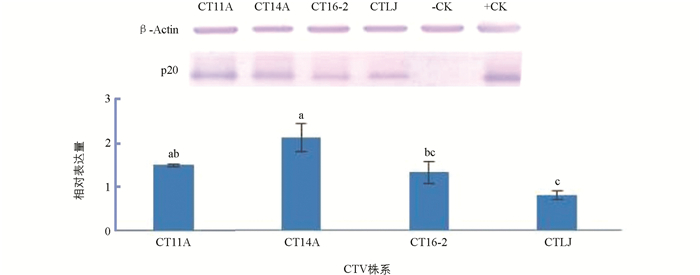
Western blot分析了感染中国CTV强毒株CT14A和弱毒株CT11A,CT16-2,CTLJ的甜橙嫩皮中p20表达差异. 强毒分离株CT14A侵染甜橙中的相对表达量均显著高于CT16-2和CTLJ,虽然比弱毒株CT11A的表达量高,但二者差异不显著,同时发现CT14A和CTLJ之间p20蛋白表达量的差异是最大的(图 3).
-
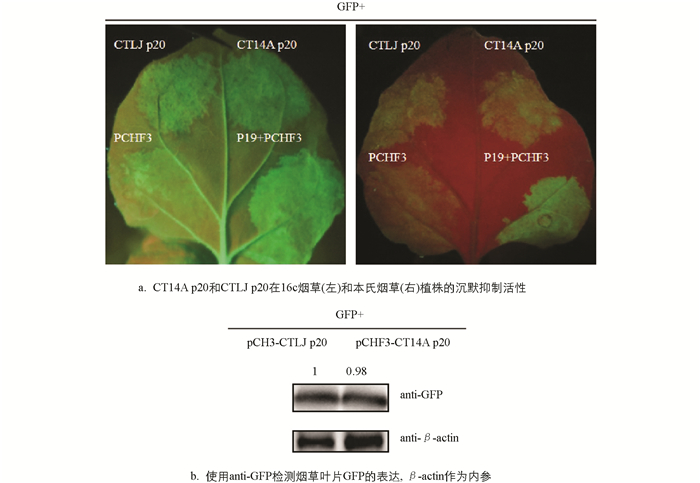
前面试验发现CT14A和CTLJ两种毒株的p20蛋白在甜橙嫩皮中的表达差异较大,因此接下来探究了两种强弱毒株间p20的沉默抑制能力是否有差异,构建强毒分离株CT14A和弱毒分离株CTLJ p20表达载体,将GFP分别与pCHF3-CT14A p20,pCHF3-CTLJ p20,P19/pCHF3(阳性对照),pCHF3(阴性对照)的农杆菌液等体积混合,注射16c和本氏烟,4 dpi后,在共渗表达GFP+CT14A p20/CTLJ p20和阳性对照(GFP+P19)的16c叶片中观察到GFP荧光,而共渗表达GFP+pCHF3在4 dpi后只有微弱GFP荧光,并且在本氏烟及16c烟草中CT14A p20和CTLJ p20浸润区域的GFP荧光信号均没有明显差异(图 4a). 使用anti-GFP抗体进行Western blot检测(图 4b),结果表明CT14A p20和CTLJ p20表达时对应的GFP蛋白的表达量没有明显差异,这与荧光观察的结果一致. 这一结果再次证明了p20具有沉默抑制能力,但在强毒株CT14A和弱毒株CTLJ间其沉默抑制活性没有明显差异.
-
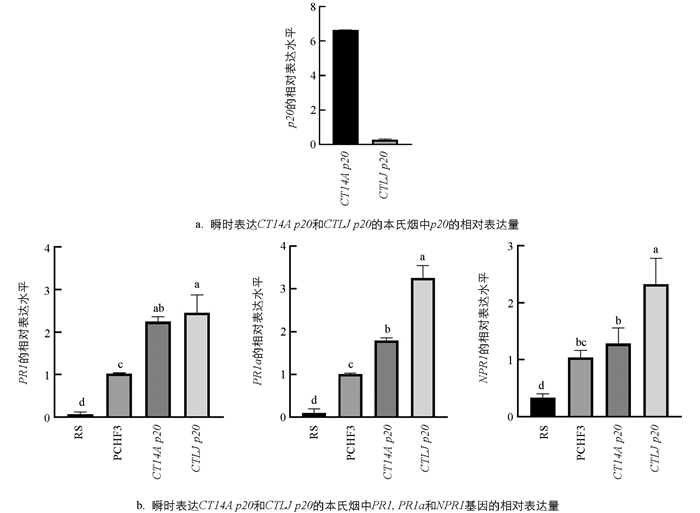
通过表达载体pCHF3将CT14A p20和CTLJ p20在本氏烟中瞬时表达. 农杆菌浸润72 h后,检测了p20的表达水平以及SA信号通路关键基因PR1,PR1a和NPR1的转录水平,结果表明在瞬时表达弱毒分离株p20烟草中PR1,PR1a和NPR1的表达水平均显著上升. 然而,弱毒分离株CTLJ p20诱导的PR1a和NPR1的转录水平显著高于强毒株CT14A p20,暗示了植物对弱毒株病毒p20蛋白的响应强于强毒株(图 5).
2.1. p20氨基酸在强弱毒分离株间的变异位点分析
2.2. p20氨基酸序列同源性分析
2.3. p20在强弱毒分离株间的表达差异分析
2.4. 强弱毒分离株间的p20沉默抑制活性比较
2.5. p20改变SA信号途径基因的表达水平
-
防御病毒攻击可以通过植物拥有的RNA沉默机制来实现[26],为了抵消宿主先天免疫反应,病毒可以通过表达RNA沉默抑制子(VRS)来破解宿主RNA沉默,从而加强自身对宿主的侵染能力[27]. 沉默抑制子中的某些氨基酸序列位点对其沉默活性及病毒致病力有着重要影响,烟草曲茎病毒(tobacco curly shoot virus,TbCSV)V2蛋白中保守的碱性氨基酸和环结构氨基酸是其抑制活性的关键,其中1~92位氨基酸序列是局部RNA沉默抑制所必需的[28]. Pazhouhandeh等[29]研究证明甜菜西方黄化病毒(beet western yellows virus,BWYV)P0蛋白含有最小F-box基序,定点突变F-box基序内的某个氨基酸能够导致病毒致病力降低和P0沉默抑制子功能减弱. CTV沉默抑制子p23的第93,143及144位的变异会降低基因沉默活性,而第175位和第182位氨基酸变异不影响沉默抑制活性[19]. 本研究发现中国弱毒分离株CTLJ与其他分离株p20氨基酸序列差异较大,有9个氨基酸位点发生变异,其中2个变异位点是CTLJ特有的,并发现CTLJ和中国强毒分离株CT14A的p20沉默活性没有明显差异,初步表明CTLJ沉默抑制子p20的第12位和第29位氨基酸变异位点不影响沉默抑制活性,这与前人研究出CTV沉默抑制子p23的第175位和第182位氨基酸变异不影响p23的沉默抑制活性结果类似,说明第12位和第29位氨基酸基酸位点可能不是发挥p20沉默抑制功能的关键位点.
-
有些氨基酸位点对蛋白的稳定性和表达水平有重要影响,木尔坦棉花曲叶病毒(cotton leaf curl multan virus,CLCuMuV)编码的沉默抑制子V2蛋白在N端第4位脯氨酸对蛋白功能影响很大[30],CTV p23中氨基酸E95V96和M99L100的变异改变了蛋白稳定性和转录水平[19]. 印度番茄曲叶病毒(tomato leaf curl India virus,ToLCINV)和新竹番茄曲叶病毒(tomato leaf curl Hsinchu virus,ToLCHsV) AV2蛋白氨基酸突变(前者C84S、C86S,后者C89S)后可通过降低病毒积累量从而减弱病毒症状[31-32]. 本研究发现强毒分离株CT14A与弱毒分离株CTLJ的氨基酸变异位点有所不同,CT14A的p20在第118和165位发生变异,而中国弱毒分离株在这些位点没有变异. p20蛋白在强毒分离株CT14A感染的植株中相对表达量显著高于弱毒株CT11A,CT16-2和CTLJ,暗示了p20表达水平与CTV分离株的致病能力有关,推测CTV p20蛋白不同株系间的变异位点也可能会影响p20蛋白的表达水平进而影响病毒的积累量. 对于植物病毒的侵染除了RNA沉默,许多植物病毒还刺激宿主的其他基本防御反应,如水杨酸(SA)防御反应等,SA信号途径中NPR1的激活可以诱导病程相关(PR)蛋白的积累,用以抵抗病毒的入侵[33]. 番茄斑萎病毒(tomato spotted wilt virus,TSWV)侵染提高了植物体内SA含量,诱导了SA调控基因的表达[34];一些基因沉默抑制子参与了病毒对SA通路的影响,黄瓜花叶病毒(CMV)沉默抑制子2b在病毒诱导SA合成中发挥重要作用,促进了PR-1转录水平,这意味着RNA沉默与SA和JA之间可能存在联系[24, 35];烟草脉带花叶病毒(tobacco vein banding mosaic virus,TVBMV)的沉默抑制子HC-Pro激活了寄主的SA信号通路[36]. 本研究中瞬时表达p20显著提高了强弱毒分离株中SA信号通路关键基因PR1,PR1a和NPR1表达水平,并且弱毒分离株CTLJ的p20的SA信号途径基因PR1a和NPR1表达水平显著高于强毒分离株CT14A,表明CTV沉默抑制子p20会激活SA途径,并诱导相关的防御基因表达. 这些研究为解析CTV致病机理及柑橘衰退病的预防奠定了良好基础.
中国弱毒分离株CTLJ氨基酸序列中有9个位点发生变异,其中2个氨基酸位点是该分离株所特有的;CTV沉默抑制子p20在强弱毒分离株侵染的甜橙中表达水平存在显著差异,强毒分离株的表达水平显著高于弱毒分离株,p20不仅改变了寄主中SA信号通路关键基因PR1,PR1a和NPR1的转录水平,而且弱毒分离株CTLJ中的SA信号途径基因PR1a和NPR1表达水平显著高于强毒分离株CT14A,暗示了弱毒分离株对SA响应可能强于强毒分离株. 本研究为解析CTV致病机理及柑橘衰退病的预防奠定了良好基础.




 下载:
下载: