-
开放科学(资源服务)标识码(OSID):

-
土壤胶体由有机、无机以及有机-无机复合胶体颗粒共同组成,由于土壤环境的不断变化,土壤胶体颗粒间的相互作用发生频率高且自发进行着[1]。土壤胶体颗粒也是土壤中化学活性最高的组分,其数量和组成对土壤的结构、性质及功能均有重要影响。已有研究表明,土壤中的有机、无机以及微生物胶体颗粒相互作用与土壤的微观过程、宏观表现以及土壤功能密切相关[2]。比如,Takács等[3]通过研究发现,聚苯乙烯微塑料与土壤中阴离子黏土矿物(层状双氢氧化物)在不同电解质中会发生同质及异质凝聚,凝聚强度取决于相互作用胶体颗粒的质量比及电解质溶液离子组成。而Li等[4]研究强调了胶体和纳米颗粒与土壤中有毒金属(如Cu、Cd和Pb)的结合对土壤—水系统中的流动性有着重要贡献。土壤胶体颗粒间相互作用力会影响土壤孔隙状况以及团聚体结构特征,宏观上的土壤侵蚀很大原因就是由于土体结构被破坏而引发;颗粒间相互作用对水分运移的影响也可能会使土壤中重金属等污染物发生迁移。因此,土壤胶体颗粒间相互作用及土壤胶体稳定性(凝聚或分散)一直以来都是备受关注的研究课题,深入研究土壤胶体对于理解和描述土壤的肥力特性及其环境效应亦有着重要的意义。
土壤胶体颗粒间相互作用通常基于DLVO(Derjaguin-Landau-Verwey-Overbee) 理论进行描述[5]。基于DLVO理论,悬液中胶体颗粒的稳定性由长程范德华引力和静电斥力共同决定,二者的相对大小决定着胶体悬液的凝聚或分散。若范德华引力大于静电斥力,会促进胶体颗粒凝聚及团聚体形成;反之,当静电斥力占优势,则土壤胶体保持稳定、胶体颗粒分散。胶体颗粒间相互作用受到多种因素的影响,这些因素主要分为两种:一种与自身性质有关,如颗粒大小、矿物组成等[6];另一种与环境条件有关,如溶液pH值、离子类型和强度、温度及外源有机物质添加等[1, 7]。比如,pH值变化会影响胶体颗粒的表面电荷密度,从而影响胶体颗粒的凝聚过程;当pH值降低,H+活度上升,胶体颗粒表面双电层被压缩,颗粒间静电排斥力降低,加快胶体凝聚[8-9]。胶体悬液中加入电解质也会导致胶体颗粒表面双电层被压缩,使得静电斥力降低,胶体体系发生凝聚。电解质浓度越高,对静电斥力的降低越显著,胶体凝聚越快速。电解质离子价态对胶体的凝聚也有显著影响。对于带负电荷的土壤胶体体系,溶液中阳离子化合价越高,其降低胶体颗粒间静电斥力的能力就越强,引发胶体凝聚的能力就越显著[10]。
除了有机土外,大多数土壤的固相骨架由矿物颗粒组成;熔岩冷却后所形成的原始矿物(如石英、长石和云母)在成分上很少发生变化,都是土壤颗粒的主要组成部分[1];伊利石则是土壤颗粒中常见的2∶1型黏土矿物之一。生物炭(Biochar,BCHA)是一种稳定的多孔富碳材料,由于其独特的理化性质,被广泛用于农业生产中[11-12]。研究表明,BCHA能够提升土壤有机质及养分含量,进而改良土壤理化性状及肥力[13-16]。BCHA施入土壤后会经历物理、化学风化,以细粉或胶体颗粒的形式在土壤中运移。当向柱试验中的砂壤土层中混入不同质量分数的椰壳纳米BCHA后,土体的累积入渗量随纳米BCHA施用量的升高而降低(降幅为3.75%~13.75%),这可归因于土壤分形维数、土壤孔隙度和团聚体稳定性等参数随纳米BCHA施用而发生了改变[17]。考虑到土壤团聚体稳定性及孔隙度等与土壤胶体凝聚动力学关系密切,因此,本研究基于动态光散射研究,测定了离子界面反应及BCHA添加影响下伊利石胶体凝聚动力学过程,基于凝聚体大小、平均凝聚速率、临界聚沉浓度(CCC)和凝聚活化能等参数的定量表征,结合对体系zeta电位的影响,阐明二者耦合作用下土壤胶体颗粒的相互作用对凝聚过程的影响机制,旨在为促进BCHA的合理利用以及明晰BCHA添加对土壤结构及性质的影响提供依据。
全文HTML
-
试验用热液成因伊利石(2∶1型黏土矿物)为土壤中原生矿物,购自湖南省古丈县山麟石语矿产品有限公司。伊利石胶体的制备采用超声分散—静水沉降虹吸法:称取50 g伊利石样品于500 mL烧杯中,加入0.5 mol/L KOH溶液10 mL,再加入超纯水至500 mL刻度,搅拌均匀后用探针型细胞破碎仪(Scientz-IID,宁波新芝生物科技有限公司,30 kHz)超声分散15 min;随后将悬液转移入5 L烧杯中,并加超纯水至5 L刻度线处;用多孔圆盘上下搅拌至悬液均匀。根据Stokes定律,计算<200 nm胶体颗粒沉降10 cm所需时间,在计时结束后用虹吸管提取胶体悬液。提取出的胶体悬液先加入0.05 mol/L HCl溶液浓缩,静置分层后弃去上清液,用超纯水反复清洗至近中性;再用0.1 mol/L KOH调节体系pH值至7.5±0.2(pHS-3C酸度计),将其置于容量瓶中室温保存。用烘干法测得胶体悬液的颗粒密度为0.750 g/L。
试验用BCHA为玉米秸秆BCHA(热解温度为300 ℃),购自南京三聚生物质新材料科技有限公司。BCHA胶体的制备方法为:在300 mL烧杯中加入4 g BCHA粉末,随后加入200 mL超纯水(保持质量比为1∶50),用玻璃棒搅拌5 min后,置于槽式超声清洗器(KQ-7200DE,昆山洁力美超声仪器有限公司,40kHz)中分散30 min;待体系冷却至室温后,用探针型细胞破碎仪在30 kHz下超声分散30 min(分3次进行),静置24 h后倒出上清液,采用离心法(10 000 r/min,15 min,TGL-16G系列高速离心机)收集<200 nm胶体颗粒。部分胶体冻干收集以备性质表征,另一部分转移至棕色广口瓶中于5 ℃冰箱保存。上机前测得BCHA胶体悬液的颗粒密度为0.66 g/L,pH值为8.30。
-
伊利石胶体凝聚过程用BI-200SM广角度动态/静态激光光散射仪(DLS,美国Brookhaven公司)测定,数字相关器为BI-9000AT。试验中,激光器功率为15 mW,入射光波长为532 nm,狭缝为100 nm,散射角度为90°,测试温度为298±0.5 K,数据收集时间间隔为30 s,每组测试时间30 min。
配置2 mol/L的NaCl溶液和0.5 mol/L的CaCl2溶液,试验用电解质溶液在配置后需过0.45 μm微孔滤膜后用于胶体凝聚试验。测定离子界面反应对伊利石胶体凝聚的影响时,电解质及其浓度梯度设置为:NaCl 0.3、0.4、0.5、0.6、1.1、1.2、1.5、8和10 mmol/L;CaCl2 0.01、0.015、0.02、0.04、0.07、0.09和1 mmol/L。胶体凝聚过程测定中,样品加入散射瓶的顺序依次为电解质溶液、超纯水、胶体。上机时,待测悬液总体积为10 mL,颗粒密度保持在70 mg/L。
伊利石胶体与BCHA胶体的混合体系中BCHA按照质量比0.5%、1%添加,具体操作为:通过测得的BCHA和伊利石胶体的颗粒密度去计算0.5%以及1%比例下所需BCHA胶体颗粒的质量,并将两个胶体体系分别命名为0.5% BCHA、1% BCHA。在上机前按照伊利石胶体、水、生物炭胶体、电解质的顺序进行添加。
基于DLS测得的凝聚体大小(即有效粒径)随时间的变化,计算单位时间内给定体系中胶体凝聚的总体平均凝聚速率(Total Average Aggregation Rate,TAA Rate)[18],
式中,ṽT(f0)为从t=0到任意时刻t=t0时间段内的总体平均凝聚速率(nm/min),ṽ(t,f0)是t=0到任意t时刻的平均凝聚速率(nm/min),f0为电解质的浓度(mmol/L);D(t)为t时刻的胶体颗粒大小(nm),D0为颗粒的初始大小(nm)。
基于Li等[19]的研究,胶体凝聚过程中的活化能计算公式为,
式中,Δw(f0)(kJ/mol)为颗粒凝聚的活化能,ṽT(CCC)(nm/min)为f0=CCC时的ṽT(f0)值,R为气体常数,T为绝对温度。
-
伊利石胶体和BCHA胶体的表面化学性质采用傅里叶红外光谱分析(SpectrumII PE,美国Perkinelmer)测定样品谱图,光谱测定在4 000~400 cm-1范围内;样品表面形貌采用场发射扫描电子显微镜(Sigma 500,德国卡尔蔡司)观察。
采用高灵敏zeta电位分析仪(NanoBrook Omni,Brookhaven,美国)测定胶体颗粒表面的zeta电位。用于测定zeta电位的悬液样品制备与DLS试验一致。取配置好的2 mL胶体悬液于聚乙烯的比色皿中,插入电极;检查电极周围无气泡后,将样品管链接至仪器,设置Measure=10,Cycle=2,开始测定,重复3次。
-
采用Microsoft Office Excel 2016进行数据处理,采用Origin 2021软件进行绘图。
1.1. 伊利石、生物炭胶体的制备
1.2. 胶体凝聚动力学的表征
1.3. 伊利石胶体与生物炭胶体的基础理化性质及体系zeta电位表征
1.4. 数据处理
-
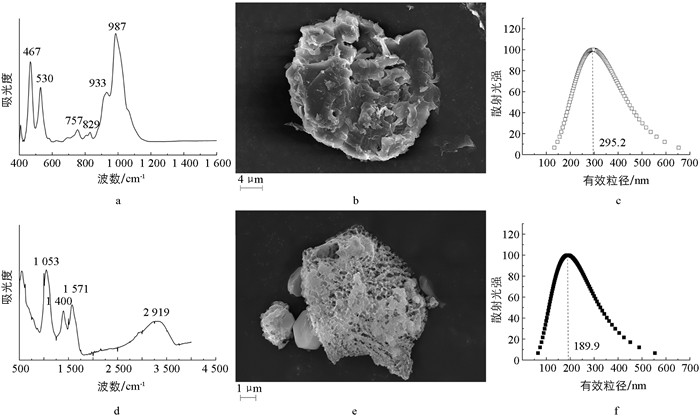
伊利石与BCHA胶体的基础性质表征如图 1所示。
图 1a是伊利石的红外光谱图,分析光谱图得出伊利石红外光谱的主要吸收峰归属如下:987和467、933和829以及757和530 cm-1分别为Si—O的伸缩振动和弯曲振动、Al—Al—OH和Al—Mg—OH的弯曲振动以及Al—O—Si的面外和面内弯曲振动。铝和氢氧根离子之间以氢键或离子键相互作用,因此会存在弯曲振动模式。图 1d是BCHA胶体的红外光谱图,可以看出,BCHA胶体表面具有较为丰富的官能团,1 053 cm-1附近有—OH官能团,1 400、1 571 cm-1附近出现有—COO-的对称收缩与反对称伸缩振动,2 917 cm-1附近为脂肪基团CH2的不对称峰。图 1b和1e分别为伊利石与BCHA的表面形貌图,可以看出伊利石胶体颗粒表面为较疏松的片状结构,而BCHA胶体颗粒表面呈现疏松多孔的构造,这种构造使得BCHA比表面积大大增加。伊利石、BCHA胶体悬液的有效粒径以及胶体颗粒的粒径分布情况分别如图 1c、1f所示。伊利石胶体颗粒的有效粒径在100到650 nm的范围内,并集中分布于260~320 nm,平均有效粒径为295.2 nm,其多分散度为0.157;BCHA胶体颗粒分布在50~550 nm范围内,集中分布在160~240 nm区间,平均有效粒径为189.8 nm,多分散度为0.110。
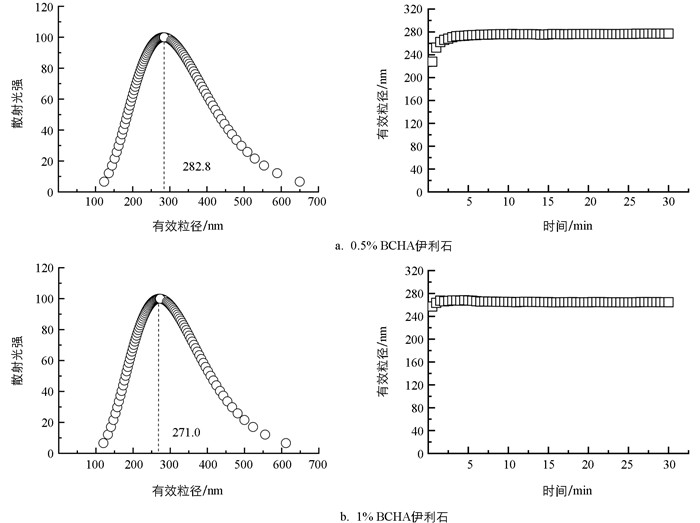
图 2为添加不同比例BCHA后伊利石胶体悬液中颗粒的有效粒径分布及稳定性随时间变化图。如图所示,添加0.5% BCHA、1% BCHA后伊利石胶体颗粒的有效粒径在100~650 nm的范围内,并集中分布于260~300 nm,前者平均有效粒径为282.8 nm、后者平均有效粒径为271.0 nm。两种BCHA添加比例下的伊利石胶体均是多分散体系,其多分散度分别为0.136、0.130。
-
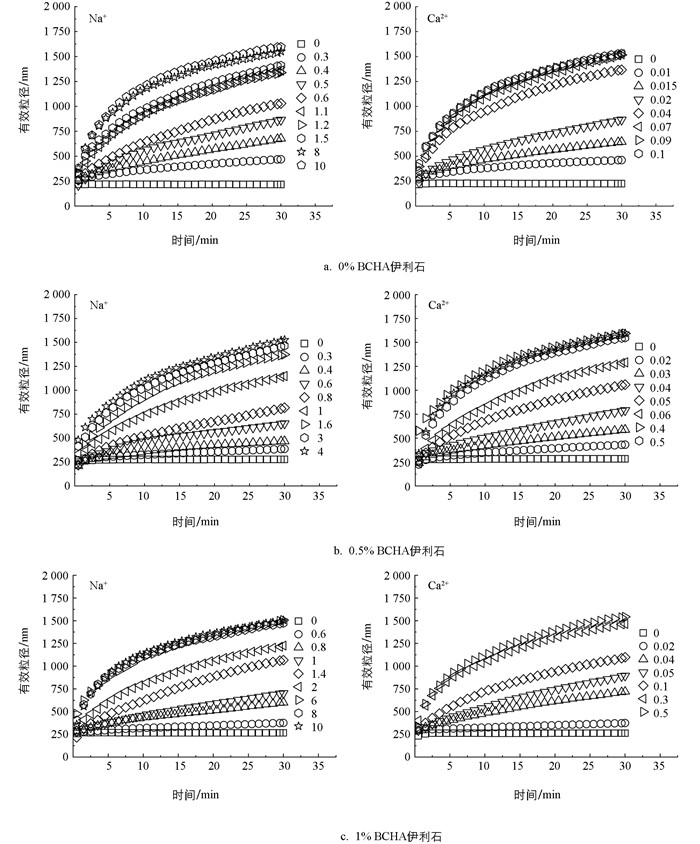
图 3为不同离子界面反应(Na+、Ca2+)及BCHA胶体添加影响下伊利石胶体凝聚动力学过程图。从图 3a中可以看出,加入电解质溶液(Na+、Ca2+)后,伊利石凝聚体的有效粒径大小均表现出随时间增加而增大的趋势,并且Na+、Ca2+不同的离子界面反应作用下伊利石凝聚体大小(有效粒径)表现出了显著的差异。例如,当凝聚体的有效粒径为1 200 nm、凝聚时间为30 min时,伊利石体系需要Na+、Ca2+电解质的浓度分别为1 mmol/L和0.035 mmol/L,这表明给定相同凝聚时间时,两种电解质作用下对其凝聚体粒径增长大小趋势的影响Na+小于Ca2+,因此两种阳离子对胶体凝聚的影响能力为Na+小于Ca2+。同样,BCHA胶体的添加也对伊利石凝聚动力学过程有显著影响。从图 3b、3c可以看出,0.5%、1%质量比BCHA胶体的添加显著降低了凝聚体粒径增长速率。例如,当凝聚时间为30 min、Na+电解质浓度为0.6 mmol/L时,3种体系中凝聚体粒径大小分别为1 050 nm、648 nm、380 nm,说明BCHA的添加能够抑制伊利石胶体的凝聚过程;当凝聚时间为30 min、Ca2+电解质浓度为0.04 mmol/L时,3种体系中凝聚体粒径大小分别为1 460 nm、894 nm、790 nm。
-
研究表明,低电解质浓度条件下,凝聚体的有效粒径随时间的变化呈现出线性增长,这意味着胶体凝聚为慢速的反应控制团簇凝聚(Reaction Limited Cluster Aggregation,RLCA)机制,当电解质浓度增大到一定值后,凝聚体的有效粒径随时间的变化呈现出幂函数增长,胶体凝聚表现为快速的扩散控制团簇凝聚(Diffusion Limited Cluster Aggregation,DLCA)机制[20]。不同电解质溶液中添加不同浓度的BCHA胶体后伊利石胶体的总体平均凝聚速率(TAA Rate)如图 4所示。
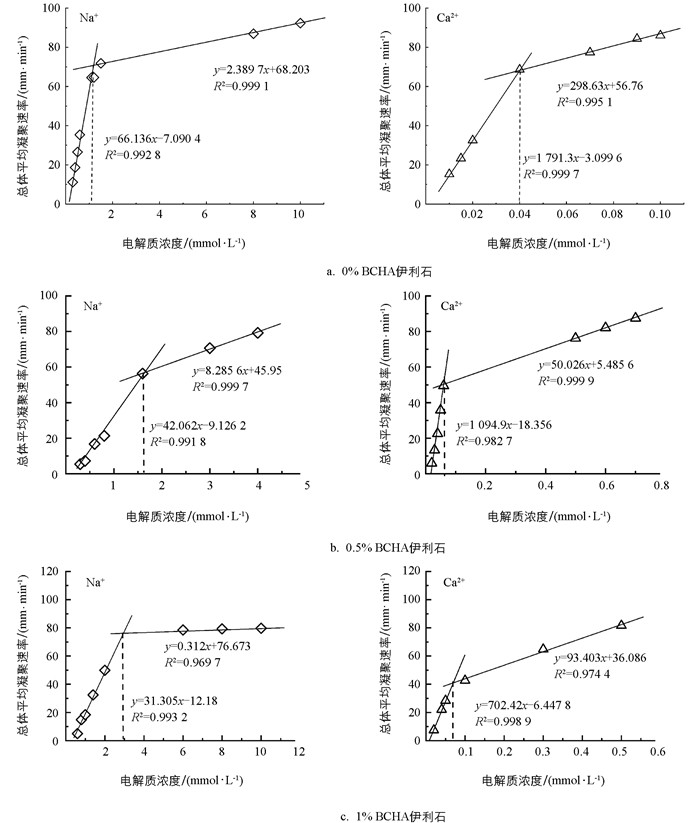
在同一胶体体系中,不同浓度的Na+与Ca2+作用下,伊利石胶体TAA Rate有明显差异。在图 4a中,伊利石在加入电解质溶液(Na+、Ca2+)后,胶体体系TAA Rate的斜率分别为66.136、1 791.3;3种伊利石胶体体系的凝聚均呈现出Na+小于Ca2+的趋势。从图 4b、4c中可以看出,当电解质类型相同时,胶体凝聚过程中TAA Rate的大小随着BCHA胶体的添加呈现下降的趋势。在Na+电解质作用下,3种体系胶体凝聚过程中TAA Rate的斜率分别为66.14、42.06、31.31;在Ca2+电解质作用下,3种BCHA添加体系的胶体凝聚过程中,TAA Rate的斜率分别为1 791.3、1 094.9、702.42。以上结果表明,2∶1型电解质对总平均凝聚速率大小的影响远大于1∶1型电解质,具体表现为Ca2+大于Na+;随着BCHA添加量的增加,伊利石胶体凝聚过程中TAA Rate的增长速率趋于缓慢。
不同电解质浓度下的TAA Rate可拟合为两条斜率不同的直线,这两条直线的交叉点所对应的电解质浓度即为临界聚沉浓度(Critical Coagulation Concentration,CCC)。CCC值是判定胶体稳定性的重要参数,表示在一定时间内使一定量的分散胶体产生聚沉所需的最小电解质浓度,可用来定量表征胶体体系的稳定性[21]。图 5所示为添加不同比例BCHA的伊利石胶体体系在Na+、Ca2+作用下凝聚的CCC值。可以看到,未添加BCHA的伊利石胶体凝聚CCC值最小,说明此时悬液的稳定性最差,凝聚效果最强烈;不同离子界面反应下,添加BCHA后的伊利石胶体悬液凝聚的CCC值均随着BCHA添加量的增加均逐渐增大,悬液的稳定性升高,更难以凝聚。例如,在Na+体系中,0.5% BCHA添加使伊利石胶体的CCC值从1.18 mmol/L升至1.63 mmol/L,1% BCHA添加使伊利石胶体的CCC值达到2.87 mmol/L,Ca2+体系中伊利石胶体凝聚的CCC值变化呈现相同趋势。Na+和Ca2+体系下,0.5% BCHA添加其胶体凝聚的CCC值分别为1.63、0.064 mmol/L;1%比例的BCHA添加其胶体凝聚的CCC值分别为2.87、0.069 mmol/L。
-
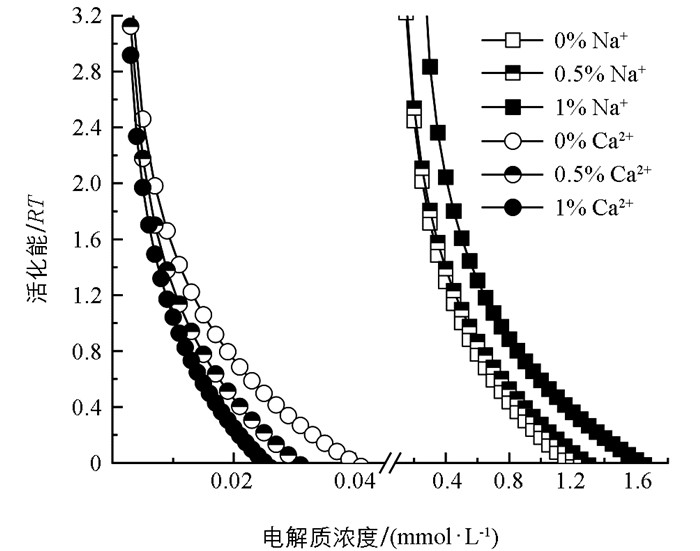
活化能是胶体凝聚过程中所需的最小能量,它反映了胶体颗粒间相互作用所需的能量阈值[8, 19]。通过总平均凝聚速率和公式2计算出两种电解质(Na+、Ca2+)作用下,伊利石、0.5% BCHA、1% BCHA胶体在凝聚过程中的活化能,得到结果如图 6所示。从图中可以明显看出,一定电解质浓度下,离子界面反应对两种伊利石胶体在凝聚过程中的活化能具有强烈影响。例如,当Na+电解质浓度为0.5 mmol/L时,伊利石胶体凝聚的活化能分别为1 RT、1.1 RT、1.6 RT;当Ca2+电解质浓度为0.01 mmol/L时,伊利石胶体凝聚的活化能分别为1.4 RT、1.14 RT、1.04 RT。上述结果可以看出,添加BCHA后,伊利石胶体的活化能也随之降低,该变化趋势与凝聚速率、临界聚沉浓度值的变化相同。
伊利石胶体在凝聚过程中活化能随电解质浓度的变化呈现出不同的变化趋势。当电解质浓度处于较低水平时,活化能呈现出明显的下降趋势;而随着电解质浓度升高,活化能的下降趋势变得较为平缓。值得注意的是,电解质浓度越高,伊利石胶体凝聚过程中的活化能也相应越低。这一现象揭示了电解质浓度对伊利石胶体凝聚过程中活化能的显著影响。电解质的价态对伊利石胶体体系的活化能也具有显著的影响,不同阳离子类型电解质促使伊利石胶体发生凝聚的活化能遵循一价离子(Na+)大于二价离子(Ca2+),其顺序与CCC值一致,均为Na+大于Ca2+。通常情况下,胶体颗粒表面电场的强弱程度由表面的电荷密度大小直接决定,从而产生对胶体的双电层结构的强烈影响[19];作为一系列物理、化学及生物性质的基础,离子界面反应以及状态的改变将直接反映在这些性质的变化上。
胶体的凝聚与分散过程中两种力占主导地位,分别为颗粒间静电斥力和长程范德华引力[5]。电位被认为能表征颗粒间静电排斥力的强度,zeta电位的变化能够间接反映胶体颗粒间静电斥力的相对大小。在众多研究结果中发现,胶体颗粒的表面电位会随电解质的加入而下降,静电排斥力随之减小,从而影响胶体颗粒间的稳定性[20, 22]。体系的稳定性与zeta电位的绝对值紧密相关,zeta电位的绝对值越大,胶体越分散,体系更稳定;而zeta电位绝对值越低,胶体越倾向于凝聚,也就是说此时的斥力低于引力。表面电荷类型决定了胶体表面zeta电位的大小,BCHA和伊利石胶体表面均带负电荷,在Na+和Ca2+作用下,添加不同浓度BCHA胶体对伊利石胶体的zeta电位影响如图 7所示。在0.8 mmol/L Na+电解质中,伊利石胶体表面zeta电位随BCHA的添加从0% BCHA的-17.8 mV到0.5% BCHA的-18.5 mV再到1% BCHA的-24.9 mV;在Ca2+作用下也有相同的趋势,当Ca2+电解质浓度为0.04 mmol/L时,胶体表面zeta电位随BCHA的添加从0% BCHA的-9.6 mV,到0.5% BCHA的-10.5 mV,再到1% BCHA的-15.9 mV。两种电解质条件下,胶体表面zeta电位绝对值均随BCHA添加量增加而上升,胶体体系稳定性随之增加。
在两种电解质中,伊利石胶体凝聚过程中的zeta电位均随电解质浓度的变化而变化,且变化趋势相同,电解质浓度越高,zeta电位的绝对值越低。例如,当Na+浓度从8 mmol/L增至40 mmol/L,其zeta电位从-36.02 mV变为-20.41 mV,Ca2+浓度从0.2 mmol/L增至1.2 mmol/L,其zeta电位从-12.45变为-6.96 mV。从上述结果可知,一价离子促使伊利石胶体发生同质以及BCHA添加后伊利石胶体凝聚的zeta电位大小为Na+大于二价离子Ca2+。这一结果与CCC值和活化能的顺序相同。
2.1. 伊利石、生物炭胶体基础性质及体系稳定性
2.2. 离子界面反应及生物炭添加对伊利石胶体凝聚动力学过程的影响
2.3. 离子界面反应及生物炭添加对伊利石胶体凝聚速率和临界聚沉值的影响
2.4. 离子界面反应及生物炭添加对伊利石胶体凝聚活化能及体系zeta电位的影响
-
近些年关于胶体凝聚与分散的研究已有许多,其中多数是基于经典DLVO和双电层理论进行的探讨,也就是范德华引力和扩散双电层斥力的合力决定胶体的凝聚与分散[20, 22]。已有大量试验表明,胶体悬液中离子浓度、价态、电性以及悬液pH值等均会显著影响到双电层排斥力,进而影响到胶体悬液的稳定性(凝聚或者分散)。研究表明,纳米二氧化钛(nTiO2)在MgCl2溶液中的zeta电位值普遍高于在相同pH值的NaCl溶液中的zeta电位值,这是由于Mg2+的价态较高,导致nTiO2在MgCl2溶液中的吸附量较高,屏蔽作用较强[21]。Sun等[10]研究了高岭石胶体的稳定性,观察其随溶液pH值、离子强度和腐殖酸浓度的变化规律,结果表明,高岭石胶体在碱性和极酸性条件下均有利于分散,在pH值≈3.2时,由于表面电化学性质的转变,高岭石胶体随pH值变化的凝聚趋势发生了逆转。价态和矿物亲和力较高的阳离子对诱导胶体凝聚的贡献较大,基本符合Schulze-Hardy规则和Hofmeister效应。黏土矿物作为土壤中重要的组成部分,对其进行与离子界面反应相关的研究同样得到重视[23-24]。高岭石胶体在NaCl、CsCl、MgCl2、SrCl2和EuCl3溶液中凝聚的CCC值分别为10.0 mmol/L、8.0 mmol/L、0.7 mmol/L、0.6 mmol/L和0.1 mmol/L[25]。高岭石胶体悬液中,各类阳离子使胶体产生的聚集能力从高到低依次为Eu3+、Sr2+、Mg2+、Cs+、Na+,这一趋势符合离子界面中的Hofmeister效应。阳离子的价态对胶体的凝聚起着重要的作用,三价阳离子体系中胶体的平均流体动力学直径比二价和一价阳离子体系中的更大。德拜长度(1/k)与离子价态成反比,静电斥力随德拜长度的减小呈指数下降。因此,高价态的离子对德拜长度的影响更显著,其排斥势能减小,胶体凝聚过程的阻力下降[10]。蒙脱石中同样有离子特异性效应的存在,随着Li+、Na+、K+离子半径的增加,中心原子对核外电子云的束缚能力依次减弱,其电子云构型发生偏转的大小表现出从小到大依次为Li+、Na+、K+的序列[26]。对于单一的伊利石胶体体系,阳离子的半径越大代表其非经典极化率也越高,这意味着离子在颗粒表面的吸附力会增强,从而增强了其屏蔽电场的能力[27]。BCHA添加后胶体体系活化能的变化与单一体系不一致,推测可能是由于BCHA胶体在悬液中吸附于伊利石胶体表面,对胶体体系中颗粒大小以及表面电场强度的影响随电解质的不同而出现差异;因为静电吸附作用会使金属阳离子(Na+、Ca2+)出现在胶体颗粒表面附近的扩散层中并影响扩散层的厚度,而厚度的变化会导致静电排斥能的改变,此时表面负电荷密度也随BCHA胶体的添加产生了改变[28]。两种电解质中,离子半径的大小关系为Na+远小于Ca2+。由于颗粒表面存在强电场,在其作用下阳离子的核外电子云会发生形态上的改变,导致离子极化现象的产生,这进一步促成了胶体凝聚过程中离子界面反应的差异。
本研究中,离子界面反应(Na+和Ca2+)对2∶1型矿物(伊利石)胶体凝聚和添加BCHA后凝聚过程中的凝聚体大小、TAA Rate、CCC值及活化能均有显著影响,zeta电位也反映了BCHA添加后,伊利石矿物的表面电荷差异。李琪瑞等[29]研究表明,在伊利石悬液的pH值为8.5时,当BCHA浓度达到5 mg/L时,其对胶体体系稳定性的削弱作用完全消失,反而增强了体系的稳定性。这是因为在BCHA颗粒浓度较低时,凝聚体的粒径会大于BCHA纳米颗粒的粒径,导致颗粒间静电斥力较小,从而使胶体稳定性减弱;随着BCHA胶体颗粒在悬液中浓度的增大,静电斥力和空间排斥力也相应增加,反而增强了新形成凝聚体的稳定性。
在强电场作用下,Na+、Ca2+的核外电子云构型发生改变,外层电子层数越多(半径越大),原子核对电子云的束缚越小,越容易出现电子云的改变或偏转,进而导致不同离子体系伊利石胶体颗粒的凝聚出现Hofmeister效应。Gao等[30]揭示了蒙脱石颗粒在Cu2+、Ca2+、Mg2+阳离子体系凝聚过程中强离子特异性效应。研究表明,CCC和TAA Rate的差异是由于阳离子与黏土矿物表面产生的非静电相互作用力的差异,这些力会产生额外的能量,分别是Cu2+、Ca2+或Mg2+静电能的1.18,0.69或0.19倍;金属阳离子和蒙脱石表面之间的非静电相互作用力不是来自阳离子体积、水合体积或分散力,而是来自蒙脱石表面附近强电场中的非经典阳离子极化作用,以及强极化阳离子(特别是具有d型电子构型的Cu2+)与强极化表面氧原子之间的量子力学相互作用,即极化诱导或电场增强的配位键产生的作用。本研究中,随着Na+和Ca2+离子半径的增加,原子核对核外电子云的束缚能力依次减弱,电子云构型发生偏转的大小表现为Na+小于Ca2+,这很好地解释了本研究的试验结果,伊利胶体凝聚过程中Hofmeister效应增加同样表现为Na+小于Ca2+。
-
复杂的环境变化使得生物炭(BCHA)胶体在土壤中的释放增加,且与土壤胶体的相互作用变得频繁。伊利石是组成土壤的黏土矿物之一,BCHA这类外源有机质的添加会使矿物表面性质发生改变。本研究通过DLS试验、zeta电位测定等研究了伊利石同质以及添加不同比例BCHA胶体后的异质凝聚,发现在伊利石胶体中添加BCHA胶体后,BCHA胶体的添加比例能够显著影响胶体凝聚动力学过程。随着BCHA添加量的增加,凝聚体的有效粒径增长速度逐渐减缓,凝聚的CCC值也相应增大,说明BCHA的添加能显著提高胶体稳定性。此外,与Na+相比,Ca2+对胶体凝聚的影响更为显著;BCHA添加后,伊利石胶体的凝聚CCC值呈现的离子特异性效应序列与单一伊利石胶体凝聚相同,具体表现为Na+小于Ca2+。BCHA添加后伊利石胶体颗粒表面带有更多的负电荷,胶体颗粒表面zeta电位绝对值随电解质浓度增加表现出明显减小的趋势,且其离子特异性效应序列均为Na+大于Ca2+,表明此时胶体颗粒间静电斥力表现为Na+远大于Ca2+。生物炭与伊利石胶体间的相互作用通过影响表面电荷来影响颗粒间的静电斥力和空间排斥力,使悬液稳定性增强,较低生物炭添加量对黏土矿物胶体的稳定性仍有增强作用,选用合适的生物炭田间用量有助于生物炭更好地应用于土壤改良中。



 下载:
下载: