-
开放科学(资源服务)标识码(OSID):

-
砷(As)是一种类金属元素, 位于元素周期表第Ⅳ周期第Ⅴ主族。自然界中的砷主要来自含砷矿物的风化释放, 可引起周围水体和土壤砷污染[1-3]。人体长期接触过量的砷会使皮肤[4]、肺[5]和肾[6]等发生病变, 给健康带来一系列影响。1998年世界卫生组织将饮用水中的砷标准设定为10 mg/L[7]。自然水体中的砷质量浓度范围为0.1~20 000 μg/L, 主要以砷酸盐(AsO43-)和亚砷酸盐(AsO33-)形式存在, 溶解态砷及有机砷形态质量浓度很低[8]。溶解砷的形态取决于酸碱度、氧化还原电位、其他水化学参数以及生物活性等[9-10]。
砷对藻类有刺激和毒性影响。相对于淡水藻, 更多的研究集中在海洋藻。海洋藻体内存在有机砷形态, 如砷糖及甲基化砷[11]。淡水藻对砷的吸收和累积与营养盐质量浓度和藻种有关。小球藻(Chlorella vulgaris)在初始质量浓度为10 000 mg/L的砷溶液中能够累积高达50 mg/g的砷[12]。不同淡水藻对砷的累积因子范围为240~2 800[13]。砷在藻体内的转化主要有砷酸根和亚砷酸根之间氧化还原转化、砷还原及甲基化作用、有机砷化合物的生物合成(如砷糖、砷脂)3种方式[14]。水体富营养化常会使藻类累积较高质量浓度的亚砷酸盐和二甲基砷[15-16]。硅藻可以将毒性较强的砷(Ⅲ)氧化为毒性较低的砷(Ⅴ), 也可将砷(Ⅲ)甲基化为二甲基砷[17]。砷(Ⅲ)胁迫下, 刚毛藻细胞内叶绿体结构会发生改变, 进而影响光合作用[18]。氮的引入可以增加鱼腥藻对砷(Ⅲ)的耐受性, 并加快砷(Ⅲ)的氧化[19]。
水绵(Spirogyra sp.)是一种广泛存在于淡水和土壤中的丝状藻类。我国湖南石门雄黄矿区高砷溪流中, 水绵的昼夜活动对水体中砷形态变化具有显著影响[20]。水绵藻粉对砷(Ⅴ)的最大吸附量为207 mg/g, 远高于常见活性炭对砷的吸附(20 mg/g)[21-22]。最近, 研究发现活体水绵的存在能够提高雄黄矿物(ɑ-As4S4)的溶解速率, 其丰富的溶解氧(0.4~20.0 mg/L)使得水体主要砷形态由亚砷酸根转变为砷酸根[23]。相比于其他砷修复剂来说, 藻类由于其光合作用效率高、生长速度快、比表面积大且成本低廉, 在低质量浓度和高质量浓度的污染环境都具有较大的利用潜力[24-25]。相比于其他微藻体, 水绵作为长丝状藻体, 更好过滤, 更易回收[26]。
以上研究表明水绵具有较高的水体和土壤砷污染修复应用前景, 但目前缺乏关于不同砷形态体系下活体水绵对其去除速率及相应的体内转化研究。本研究通过分离培养活体水绵, 探究不同水体温度(10、25、40 ℃), 避光环境及氮添加(0.5、1、2 g/L)对砷(Ⅲ)和砷(Ⅴ)去除速率的影响, 并调查短期和长期条件下水绵体内砷形态转化情况, 以期为活体藻修复砷污染提供相关数据和理论支持。
全文HTML
-
试验所用水绵藻种取自罗唐惠子等[20]报道的湖南石门雄黄矿区高砷溪流。分离鉴定后, 采用BG11培养基, 置于30 L有机玻璃容器中, 自然光照下培养, 增加空气泵, 以提供足够的CO2, 培养2周作为储备藻, 用于后续微宇宙试验, 通过显微镜观察培养过程有无杂藻出现。
-
试验采用80 mL玻璃瓶作为容器, 置于控温交换板上。将控温交换板放置于不锈钢水浴槽中, 外联循环冷却器(Pharmacia Biotech Multi Temp Ⅲ, 德国)进行精确控温(10、25、40 ℃)。采用630 W陶瓷金属钠灯作为生长光源(iPower, 中国), 整个装置置于反光聚酯薄膜种植棚(60 cm×60 cm×120 cm)中(图 1)。
为定量各容器中添加的活体水绵藻量, 先开展活体藻量、叶绿素值和干藻粉之间的定量关系试验。从1.1培养容器中收获足量水绵藻体, 置于50 mL康宁离心管中, 在10 000 r/min转速下离心20 min(Eppendorf Centrifuge 5810), 称取不同质量(0.05~1.8 g)的离心后的活体水绵(Y), 每个质量称取2份。一份用30%的乙醇定容至200 mL, 采用超声波细胞粉碎仪(宁波新芝JY-II)超声15 min后, 使用叶绿素荧光计(Aquafluor, 美国)测定叶绿素值(X)。另一份使用烘箱(电热恒温鼓风干燥箱DHG-9240A, 上海齐放科学仪器有限公司)干燥一昼夜, 获得藻粉质量(Y′), 每组重复3次。三者能够获得较好的线性关系:Y′=0.03 Y-1.53, Y′=1.27 X-3.04, 相关系数分别为0.99和0.98。
基于上述水绵藻定量工作, 分多次开展活体水绵对砷(Ⅲ)和砷(Ⅴ)去除的动力学试验。将定量的水绵(Y=2.5 g)置于80 mL玻璃瓶中, 加入0.5 mL 1 g/L砷(Ⅲ)或砷(Ⅴ)标准溶液, 用新鲜BG11培养基定容至50 mL。每次开展4组试验, 其中3组为平行试验, 另外1组用于其他3组液体周期性取样溶液损失的补充(图 1)。短期光照试验的照射时间设定为10 h, 每隔1 h用移液枪取1 mL溶液, 过0.45 μm滤膜, 用于后续砷形态分析。
-
避光条件:采用锡箔纸包裹玻璃瓶, 并对种植棚严格避光, 其他操作同上。氮添加条件:鉴于氮为水体常见元素, 本试验以氯化铵(NH4Cl)作为氮源, 设定低(NH4-N:0.5 g/L)、中(NH4-N:1.0 g/L)和高(NH4-N:2.0 g/L)3个质量浓度, 其他操作同上。长期试验设定为21 d, 在上述光照条件下, 昼夜交替, 定期用新鲜BG11培养基补充蒸发量, 使其体积恒定。试验结束后, 在10 000 r/min转速下离心20 min收集藻体, 采用1 mmol/L Na2HPO3清洗3次, 以去除藻体表面可能残留的砷(Ⅲ)和砷(Ⅴ), 105 ℃干燥24 h, 并使用玛瑙研钵粉碎。取0.02 g样品装入比色管, 水浴酸消解, 重复3次。将得到的上清液混合均匀, 通过0.45 μm滤膜过滤, 用于后续砷形态分析。所有试验均开展3组平行试验, 结果以平均值和标准差表示。
-
采用高效液相色谱结合氢化物原子荧光光谱法(SAP-50, AFS-8230, 北京吉天仪器有限公司), 色谱柱(CNWSep AX HPLC Column, 250 mm×4.0 mm, 10 μm, 100A, 上海安谱试验科技股份有限公司)。砷质量浓度测定的流动相为1.96 g/L的磷酸氢二铵溶液((NH4)2HPO4), 还原剂为以氢氧化钾(KOH)作为稳定剂的20 g/L的硼氢化钾溶液(KBH4), 载流液为7%的硝酸溶液(HNO3), 载气为高纯氩气, 所用试剂均为优纯级。采用由国家标准物质研究中心提供的1 007 μg/mL的砷(Ⅲ)和1 001 μg/mL的砷(Ⅴ)标准溶液分别配制质量浓度梯度为10、20、40、80、100 μg/mL的溶液, 25.1 μg/mL的一甲基砷标准溶液和52.9 μg/mL的二甲基砷标准溶液分别配制质量浓度梯度为5、10、20、40、50 μg/mL的溶液, 样品进样量为100 μL, 砷(Ⅲ)、一甲基砷(Methylarsinic Acid, MMA)、二甲基砷(Dimethylarsinic Aicd, DMA)、砷(Ⅴ)的出峰时间分别为2.8、4.0、6.0、13.5 min, 以质量浓度为横坐标, 峰面积为纵坐标绘制标准曲线。样品测定方法与标准曲线样品测定方法一致, 根据标准曲线计算样品质量浓度。测试20个样品后, 回测一个标准样品或空白样品以检查仪器的稳定性, 保证试验数据的可靠性。
1.1. 水绵培养
1.2. 水绵藻体砷(Ⅲ和Ⅴ)去除动力学试验
1.3. 影响因素分析
1.4. 砷(Ⅲ)、砷(Ⅴ)、一甲基砷及二甲基砷质量浓度分析
-
假设水体中初始砷质量浓度为C0, 在时间t时的砷质量浓度为Ct, 砷质量浓度的减少来源于藻体表面的吸附和藻体内部吸收。在短时间内, 两个过程的速率均为常数, 分别用去除速率K1(表面吸附)和去除速率K2(内部吸收)表示, 那么Δt恒定体积中砷的质量浓度变化, 应该等于藻体表面和内部的累积量, 即:
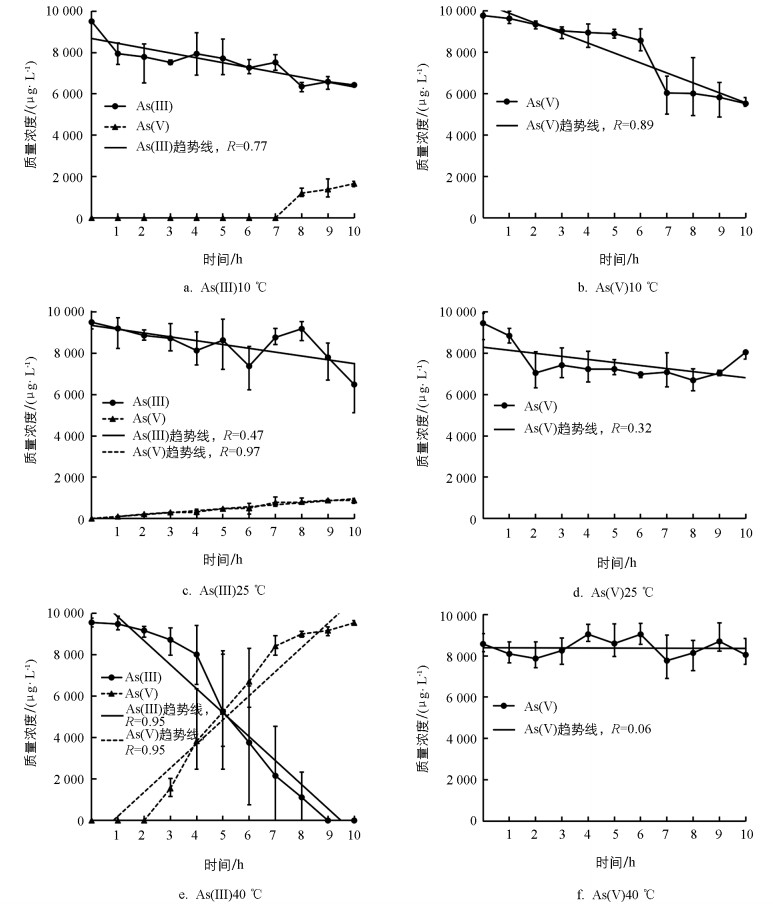
考虑活体水绵在短时间内(10 h)生长量缓慢, 藻体质量(M)可视为常数, 定义K=K1+K2, 根据公式(1)处理即:C=Kt+b, 可以认为砷质量浓度在该体系下的变化存在线性减弱。在相同时间尺度(t为X轴)和同样初始质量浓度(C为Y轴)下, 对试验数据进行拟合, 其斜率|K|的大小能够进行横向对比, |K|值越大, 说明去除速率越大, 反之亦然。因此在相同的初始砷浓度下, |K|的大小能够体现去除速率的快慢。采用该方法对10、25、40 ℃试验条件下获得的数据进行拟合, 结果如图 2所示。10 ℃光照条件下, 由于水绵藻体的吸附和吸收作用, 砷(Ⅲ)从初始质量浓度降低至10 h的6 429 μg/L, 线性拟合方程为:C=-234×t+8 677。处理7 h后, 水绵藻体的光合作用使得体系中有明显的砷(Ⅴ)形成, 其质量浓度从8 h的1 198 μg/L增加到10 h的1 658 μg/L。当温度增加到40 ℃时, 砷(Ⅲ)体系去除速率系数|K|值相应地从10 ℃时的234提高至40 ℃时的1 158, 去除速率增加了3.9倍。由此可知, 温度的升高明显加快了砷(Ⅲ)的去除速率。同时温度的升高也提高了砷(Ⅴ)生成质量浓度, 25 ℃从初始的0 μg/L增加到10 h的880 μg/L, 40 ℃从初始的0 μg/L增加到10 h的9 548 μg/L。与砷(Ⅲ)体系不同, 在砷(Ⅴ)体系中未发现砷(Ⅲ)。其10、25、40 ℃条件下的去除速率逐渐降低, |K|值分别为480、147、39。因此, 光照条件下水绵藻体对砷(Ⅲ)和砷(Ⅴ)去除存在显著差异, 砷(Ⅲ)去除效果优于砷(Ⅴ)。
-
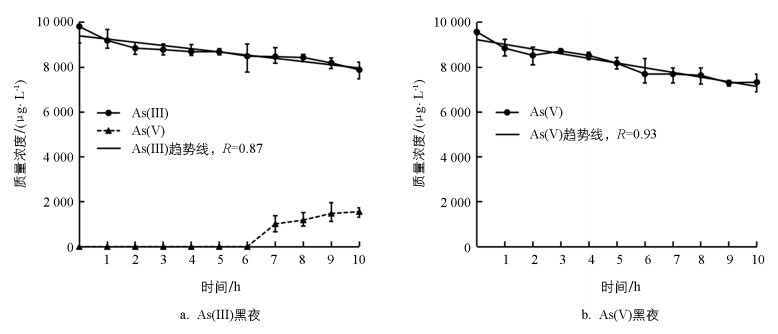
40 ℃条件下,研究避光时砷(Ⅲ)和砷(Ⅴ)的去除速率。在40 ℃避光条件下, 砷(Ⅲ)质量浓度由0 h的9 818 μg/L降低到10 h的7 888 μg/L。仍沿用前述去除方程进行试验数据拟合, 结果如图 3所示, 避光条件下砷(Ⅲ)组对应的去除速率系数|K|值为143, 远低于40 ℃光照条件下的1 158, 砷(Ⅲ)的去除速率白天40 ℃时为夜晚的8.1倍。在避光条件下, 砷(Ⅲ)体系也存在砷(Ⅴ)的氧化生成现象, 在第7 h的检测质量浓度为1 016 μg/L(图 3a), 相比40 ℃时光照3 h的检测质量浓度1 551 μg/L(图 2e), 其氧化速率显著降低。主要原因是藻体光合作用能够带来更多的溶解氧, 进而将更多的砷(Ⅲ)氧化为砷(Ⅴ)。同时, 避光条件下砷(Ⅴ)去除速率系数|K|值为209, 高于砷(Ⅲ)避光条件。
-
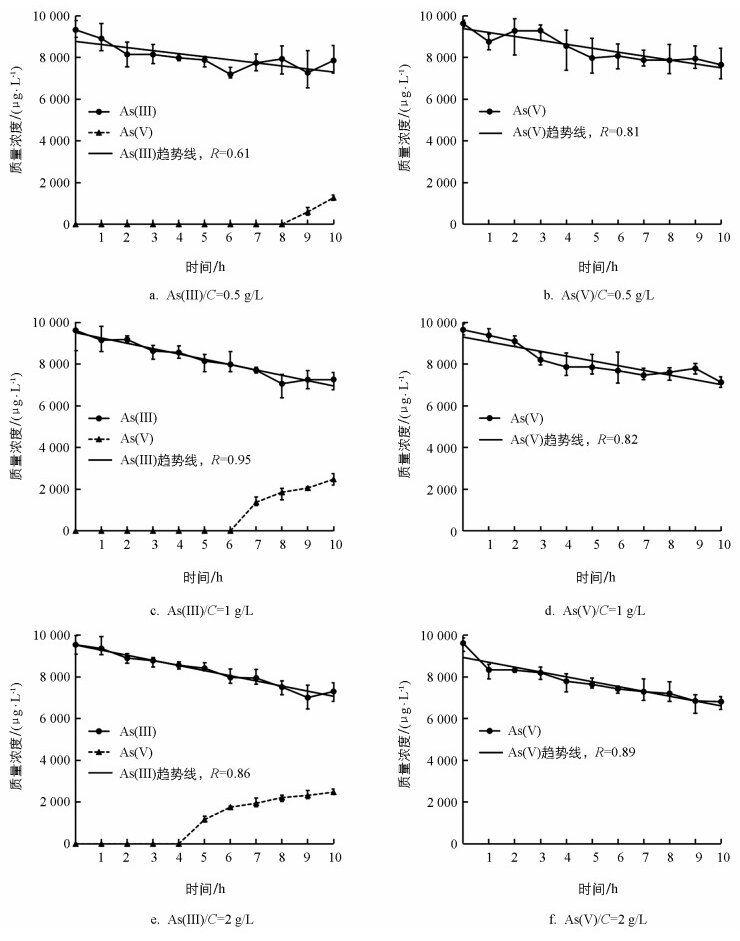
40 ℃光照条件下研究氮添加对砷(Ⅲ)和砷(Ⅴ)的去除速率。结果如图 4所示, 低氮条件下(0.5 g/L), 砷(Ⅲ)从初始质量浓度降低到10 h的7 859 μg/L。沿用前述模拟方程拟合|K|值为147。中氮条件下(1 g/L)|K|值为256, 高氮条件下(2 g/L)|K|值为222。相比于无氮条件(|K|值=1 158), 氮添加条件下砷(Ⅲ)去除速率均显著降低, 为无氮条件时的12.7%~22.1%。其原因可能是铵根的氧化消耗部分光合作用产生的氧气[27], 即:
砷(Ⅲ)体系在氮添加条件下的砷(Ⅲ)氧化具有明显规律, 低氮条件下在第8 h开始出现砷(Ⅴ), 其质量浓度在第10 h达到1 274 μg/L;中氮条件下在第6 h出现砷(Ⅴ), 其质量浓度在第10 h达到2 478 μg/L;高氮条件下在第4 h开始出现砷(Ⅴ), 其质量浓度在第10 h达到2 568 μg/L。由此可知, 氮质量浓度增加能够促进砷(Ⅲ)的氧化过程。其可能涉及的主要化学反应为:
在砷(Ⅴ)体系中, 其去除速率|K|值在低、中、高氮条件下分别为188、228、232, 相比与无氮条件(|K|值=39), 其去除砷速率分别为无氮条件的4.8、5.8、5.9倍, 因此氮的存在加速了水绵藻体砷(Ⅴ)的去除速率。
-
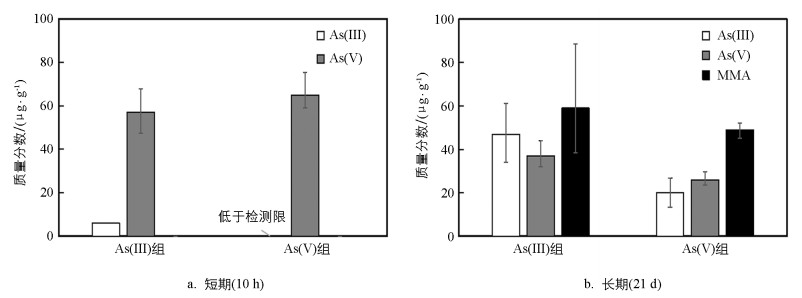
采用前述试验条件, 开展25 ℃、光照条件下短期(10 h)和长期(21 d)藻体内砷形态分析工作, 结果如图 5所示。在砷(Ⅲ)条件下生长10 h, 其藻体内含有6 μg/g的砷(Ⅲ)和57 μg/g的砷(Ⅴ);在砷(Ⅴ)条件下生长10 h,其藻体中含有65 μg/g的砷(Ⅴ), 未发现砷(Ⅲ)(图 5a)。两组短期条件试验, 均未发现有一甲基砷和二甲基砷成分。在长期(21 d)生长条件下, 其砷(Ⅲ)条件下, 其体内含有47 μg/g的砷(Ⅲ)、59 μg/g的一甲基砷和37 μg/g的砷(Ⅴ);相比于砷(Ⅲ)条件, 在砷(Ⅴ)条件下, 水绵藻体普遍含有较低质量分数的3种砷形态, 其砷(Ⅲ)、一甲基砷和砷(Ⅴ)质量分数分别为20、49、26 μg/g(图 5b)。这些数据与前面相同条件去除速率砷(Ⅲ)优于砷(Ⅴ)相符合。两组条件均未发现二甲基砷形态的存在。将无机砷转化为毒性较低的甲基化衍生物是藻类抵御砷胁迫的重要机制之一, 研究表明高砷质量分数环境或较长时间接触砷的藻体会诱导无机砷转化为甲基化砷[28-29]。
-
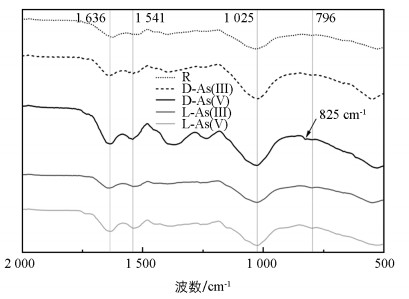
相比于无砷水绵藻体样品, 砷(Ⅲ)条件下生长的水绵藻红外光谱图中D-As(Ⅲ)样品在796 cm-1波数出现AsO33-分子有关v1的振动(图 6), 这与前人关于亚砷酸盐矿物的红外光谱报道相一致[30-31]。砷(Ⅴ)条件下, 样品D-As(Ⅴ)中在825 cm-1出现AsO43-的v1振动(图 6)。藻体样品中在1 636 cm-1和1 541 cm-1存在明显的振动带, 它们对应于羧基(C=O)拉伸振动, 而在1 025 cm-1处的吸收带是由醇类和羧酸(C-O)的振动引起。陈双双等[32]研究指出, 藻体表面胞外聚合物中的—NH、C=C、—OH和C=O等官能团参与藻细胞对砷的吸附。相比于样品L-As(Ⅲ)和L-As(Ⅴ), D-As(Ⅲ)和D-As(Ⅴ)样品在1 636、1 541、1 025 cm-1波数处的吸收带更明显, 说明光照条件能够增加水绵藻体表面基团量, 进而提高藻体对砷的吸附能力。
2.1. 不同温度影响下活体水绵对砷(Ⅲ)和砷(Ⅴ)的去除速率
2.2. 避光条件下活体水绵对砷(Ⅲ)和砷(Ⅴ)的去除速率
2.3. 氮添加条件下活体水绵对砷(Ⅲ)和砷(Ⅴ)的去除速率
2.4. 短期和长期条件下活体水绵对砷(Ⅲ)和砷(Ⅴ)的转化
2.5. 水绵藻体的傅里叶红光谱
-
通过探究活体水绵对水溶液中砷(Ⅲ)和砷(Ⅴ)的去除速率及体内转化情况, 得出以下结论:
1) 在10、25、40 ℃光照条件下, 砷(Ⅲ)组去除速率系数|K|值由10 ℃的234增加至40 ℃的1 158, 增加了3.9倍, 同时砷(Ⅲ)氧化为砷(Ⅴ)现象随温度增强。砷(Ⅴ)组去除效率系数|K|值分别为480、147、39, 去除速率温度升高而降低。因此, 光照条件下活体水绵对砷(Ⅲ)去除效果优于砷(Ⅴ)。
2) 避光条件下, 砷(Ⅲ)组40 ℃时的去除速率系数|K|值为143, 远低于光照条件的1 158, 光照组的去除速率是避光组的8.1倍;且在光照条件下, 由于藻体光合作用产生了更多的溶解氧, 有更多砷(Ⅲ)氧化成砷(Ⅴ)。
3) 低、中和高质量浓度氮添加条件下, 砷(Ⅲ)组对应的去除速率系数|K|值分别为147、256、222, 仅为无氮条件(|K|值=1 158)的12.7%~22.1%, 原因可能是NH4+氧化为NO2-和NO3-, 消耗了光合作用产生的氧气。而随着氮质量浓度的增加, NO3-的生成也增加, 进而将溶液中更多的AsO33-氧化为AsO43-;砷(Ⅴ)的去除速率系数|K|值分别为88、228、232, 与无氮条件(|K|值=39)相比, 氮添加条件下分别为无氮条件的4.8、5.8、5.9倍。
4) 短期生长试验结果显示, 砷(Ⅲ)组藻体内含有6 μg/g的砷(Ⅲ)和57 μg/g的砷(Ⅴ), 砷(Ⅴ)组藻体内含有65 μg/g的砷(Ⅴ);长期结果显示, 砷(Ⅲ)组藻体内含有砷(Ⅲ)、MMA和砷(Ⅴ)的量分别为47、59、37 μg/g, 砷(Ⅴ)组分别为20、49、26 μg/g, 水绵藻体对砷(Ⅲ)的去除效果优于砷(Ⅴ)。
5) 傅里叶红外光谱显示, 796 cm-1波数处出现AsO33-的v1振动, 825 cm-1处出现AsO43-的v1振动。



 下载:
下载: