-
开放科学(资源服务)标识码(OSID):

-
基于RNA干扰(RNA Interference,RNAi)技术开发的外源双链RNA(Double-stranded RNA,dsRNA),能够精确诱发植物病原菌内特定基因的沉默,进而引起靶标生物的非正常生长或致病力降低,从而达到防治农作物病害的目的,也被称为RNA生物农药[1]。dsRNA杀菌剂采用传统的喷洒方式,在不干扰植物遗传表达的情况下,仅抑制有害生物靶标基因的正常表达,其作用机制独特、选择性强且安全性高。然而,dsRNA的不稳定性及病原菌对dsRNA的吸收效率低等问题,仍是其广泛应用的重要限制因素。纳米载体对dsRNA的保护和递送,为RNA生物农药的发展提供了新的思路。以纳米材料为载体的新型dsRNA杀菌剂具有靶标特异性高、可天然降解、普适性强等优点,被认为是“农药史上第三次革命”的核心产品[2]。
全文HTML
-
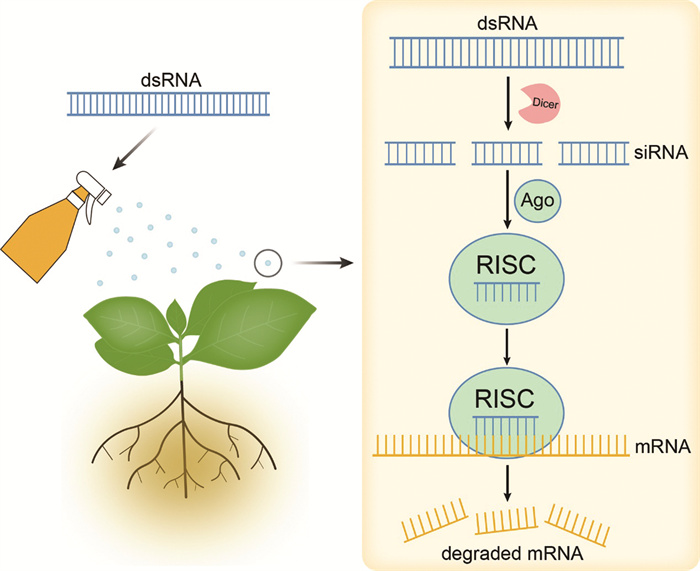
RNA干扰现象广泛存在于植物、动物、真菌和病毒中,是高度保守的基因表达调控工具[3-6]。1998年,Fire等[7]在秀丽隐杆线虫中首次发现外源或内源的dsRNA插入可以促进其同源性较高的mRNA降解,进而特异性抑制基因活性,自此将该现象称为RNA干扰。其具体机制是,生物体能够利用自身体内的多种Dicer-like(DCL)酶将长的dsRNA切割成21~24 nt的siRNA,随后这些siRNA的其中一条链与动植物体内的核酸外切酶、解旋酶、核酸内切酶以及Argonaute(AGO)蛋白等物质结合,形成RNA诱导沉默复合体(RNA-Induced Silencing Complex,RISC)。该复合体被激活后,以siRNA的其中一条链为指导,特异性的降解与其同源的mRNA,使该基因丧失表达活性,从而达到沉默相关基因的目的[8]。在siRNA与靶标mRNA结合后,生物体会利用RNA依赖的RNA聚合酶(RNA-dependent RNA Polymerase,RdRP),以靶标基因mRNA为模板,再次形成新的dsRNA[9]。由于RdRP的存在,使得少量的dsRNA便能够引发明显的基因沉默现象。
RNAi技术是研究基因功能的重要工具之一,在RNAi研究基础上首先发展而来的是寄主诱导的基因沉默(Host-Induced Gene Silencing,HIGS)[10]。国内学者利用HIGS技术在棉花中表达大丽轮枝菌疏水蛋白基因hygrophobins1(VdH1),接种后阻碍了病原菌微菌核的形成,构建了棉花黄萎病抗病体系,田间试验表明棉花抗病效果良好[11]。但HIGS技术也有不足之处,其仅适用于具备遗传转化体系的作物,并且受到培育周期长及伦理道德等问题的影响,导致该技术在植物病害防控领域的应用进展缓慢。喷雾诱导基因沉默(Spray-Induced Gene Silencing,SIGS)是在HIGS研究基础上发展而来的非转基因RNA干扰策略,该策略通过对植物外源喷施靶向病原菌生长或致病关键基因的dsRNA,触发病原体或植物内的RNA干扰途径,抑制特定基因的表达,从而杀灭病原体或提升作物抗病能力[12]。如图 1所示,SIGS技术采用传统的施药方式,避免了转基因技术带来的生态安全不确定性,同时利用RNAi原理实现了植物病害的有效防控。这种喷洒型dsRNA杀菌剂能够特异性作用于有害生物的关键生长相关基因或致病基因,代表了新一代环境友好型绿色农药。
-
利用dsRNA杀菌剂进行植物真菌病害防治被认为是具有巨大潜力的防控策略。例如,由镰刀菌引起的植物病害中,多个靶标基因已被证明具有良好的防控效果。用体外合成靶向镰刀菌麦角甾醇生物合成基因的dsRNA(CYP3-dsRNA)直接喷洒大麦,可以有效抑制系统叶片组织中镰刀菌的发育,实现病害防控[13];喷施靶向镰刀菌生长关键蛋白β2-tubulin的dsRNA,赋予植物对多种植物病原体的抗性,表现出较强的基因沉默效率[14];喷施体外合成的尖孢镰刀菌RNAi组分RDR1(FolRDR1)基因的dsRNA,可有效防控番茄枯萎病的发生并抑制FolRDR1基因的表达[15]。靶向真菌RNAi机制组分DCL和AGO基因的dsRNA,可以保护大麦叶片免受镰刀菌侵染[16]。dsRNA杀菌剂除了在防控镰刀菌研究较多外,对其他真菌病害也有相关报道,例如,由葡萄孢菌侵染引起的灰霉病,该病严重降低作物的产量和品质,分别在水果、蔬菜和花卉表面喷施靶向葡萄孢菌RNAi关键组分DCL1和DCL2基因的dsRNA,能够有效抑制病灶大小[17];由真菌Magnaporthe oryzae引起的稻瘟病是水稻第一大病害,外源喷施dsRNA可降低宿主防御,抑制致病基因MoDES1的表达,赋予了水稻对稻瘟病的抗性[18];大豆锈病的爆发给大豆带来严重的产量损失,将体外合成编码大豆锈病病原菌乙酰辅酶A酰基转移酶(ATC)、40S核糖体蛋白S16(RP_S16)和甘氨酸切割系统H蛋白(GCS_H)3个基因的dsRNA喷洒在离体大豆叶片上,与对照组相比,大豆叶片上的脓疱数量平均减少了73%以上,真菌积累量减少了75%以上[19];喷施靶向Phakopsora pachyrhizi的效应因子PpAE1、PpAE2、PpAE3的dsRNA,通过抑制植物免疫应答从而降低大豆锈病的发病程度[20]。此外,SIGS技术还被应用于防治其他病原真菌,包括Austropuccinia psidii[21]、Rhizoctonia solani[22-23]、Sclerotinia sclerotiorum[24]、Verticillium dahliae[25]和Venturia inaequalis[26]等。
针对卵菌病害一直缺乏特异性强的农药,利用dsRNA杀菌剂进行防治可能会带来巨大突破。疫霉菌是对多种作物造成重大影响的病原菌,喷施对靶向疫霉侵染至关重要的吸器膜蛋白(PiHmp1)的dsRNA,可显著提高马铃薯对晚疫病的抗性[27];外源喷施靶向致病疫霉热休克蛋白90(Hsp-90)、翻译延伸因子1α(EF-1α)和山梨醇脱氢酶(SDH)的dsRNA,可显著减轻马铃薯晚疫病的症状[28];喷施针对疫霉中2个必需基因纤维素合酶(Ces3)和氧化固醇结合蛋白(OSBP-2)的dsRNA,可显著降低辣椒疫霉的感染和繁殖能力[29]。
SIGS技术在植物病毒病防控中的应用比较早,且对多种病毒病均具有较好的防控效果。例如,研究者们使用大肠杆菌菌株HT115(DE3)来表达辣椒轻斑驳病毒(Pepper Mild Mottle Virus,PMMoV)的复制酶基因(IR54)和李痘病毒(Porcine Parvovirus,PPV)helper component(HC)基因的dsRNA,将这些dsRNA喷洒在烟草植株上后,可以系统性地防治对应病毒病的发生[30],这一发现为后续开发利用RNAi农药防治植物病毒病害奠定了基础;喷施dsRNA使豆类常见花叶病毒(Bean Common Mosaic Virus,BCMV)的CP基因沉默,显著降低了病毒对植物的侵染程度[31];以马铃薯Y病毒(Potato Virus Y,PVY)的CP基因作为RNAi的作用靶标,显示出较高的病害防控效率[32];体外合成高效影响烟草花叶病毒(Tobacco Mosaic Virus,TMV)CP基因和RNA依赖的RNA聚合酶(RdRP)基因表达的dsRNA,喷施在烟草叶片后,不仅减轻了病害的发生程度,还显著降低了种子带毒率[33-34],喷施dsRNA防控病原菌的靶标基因及作用效果见表 1。
-
1) dsRNA杀菌剂高效靶标基因的筛选。靶标特异性高是dsRNA杀菌剂的优势之一,因此获得有害生物高效的RNAi靶标基因是研制dsRNA杀菌剂的关键。在有害生物的防治研究中,目前面临可选择的高效靶标基因相对较少的问题。由于不同物种中有害生物中的RNAi作用机制存在差异,使得同一靶标基因在不同物种中作用机制和功能发挥并不完全一致,这增加了靶标基因筛选的难度。同时,在选择针对目标病原菌特异性基因时,需要考虑其基因同源性和相似性,避免对非靶标生物产生不利影响。因此,有害生物靶标基因选择的过程必须综合考虑多种因素。
2) dsRNA的稳定性。核心成分的稳定性对于商品化农药的货架期至关重要。dsRNA本质上是核酸分子,在递送至靶标生物的过程中,容易受到自然界中酶、pH值、雨水冲刷等因素的影响而发生降解。病原微生物内部的核酸酶和pH值也会影响dsRNA的稳定性,进而影响RNAi效率。经检测发现,dsRNA在植物叶片表面停留时间仅为7 d左右[15],降解速度较快成为限制其应用的关键因素之一。
3) 病原菌对dsRNA的吸收效率。dsRNA成功递送至病原菌胞内是RNAi发挥作用的前提。不同种类的病原菌对dsRNA的敏感性和吸收机制不同,导致其对dsRNA的吸收能力存在差异。研究发现,灰霉病菌(Botrytis cinerea)、核盘菌(Sclerotinia sclerotiorum)、立枯丝核菌(Rhizoctonia solani)、黑曲霉菌(Aspergillus niger)和大丽轮枝菌(Verticillium dahliae)能够以较高的效率吸收dsRNA,而胶孢炭疽菌(Colletotrichum gloeosporioides)则不能够吸收dsRNA。卵菌致病疫霉(Phytophthora infestans)对dsRNA的吸收能力随着细胞类型和发育阶段的差异而变化[25]。因此,提高dsRNA的递送效率或突破病原菌对dsRNA的吸收屏障,是提升dsRNA杀菌剂利用效率的重要途经。
1.1. RNAi的发现及SIGS原理
1.2. dsRNA杀菌剂在植物病害防控领域的应用
1.2.1. 喷施dsRNA防控植物病害
1.2.2. 限制dsRNA杀菌剂应用发展的技术瓶颈
-
国际标准化组织(International Organization for Standardization,ISO)将任何在外部尺度、内部结构或表面结构上处于纳米尺度(1~100 nm)的材料定义为纳米材料[35]。纳米农药是将纳米材料应用于农药研发中,创造出具有良好药效的新型农药。纳米材料与传统农药的结合展现出了广阔的应用前景,为解决植物保护问题提供了新的思路。纳米材料具备尺寸小、比表面积大和吸附能力强等诸多优异的理化性能。常见纳米材料包括聚己内酯、羧甲基壳聚糖、阳离子星状聚合物、纳米TiO2和壳聚糖等,作为高效载体装载农药[36-41],能够有效改善农药的水分散性、增加农药在叶表面的接触面积、减少施药次数并降低使用剂量,从而提高农药的有效利用率。纳米材料被应用于dsRNA递送系统,推动了dsRNA杀菌剂的应用。dsRNA杀菌剂的纳米递送载体主要分为以下几类:①天然聚合物类纳米载体,例如,壳聚糖、脂质体、木质素和多肽等;②合成聚合物类纳米载体,例如,阳离子星状聚合物、聚乙烯亚胺、聚乙二醇等;③无机非金属类纳米载体,例如,介孔二氧化硅、纳米粘土和碳纳米材料等[42]。纳米材料通过吸附、偶联、包裹和镶嵌等方式装载dsRNA,有效提升核酸的利用效率,为植物病害防控提供了一种变革性的方法(表 2)。
-
在土壤和有水的环境中,dsRNA可能会在48 h内完全降解。核酸酶、雨水、紫外线以及微生物等环境因素都直接影响dsRNA的稳定性[49]。例如,ZmFd3-dsRNA被阳离子/阴离子脂质体(CLPs和ALPs)包裹后,能够有效促进dsRNA在玉米植株中的传递。在外源核酸酶处理下,脂质体有效保护了dsRNA不被降解,并且能够减缓由玉米褪绿斑驳病毒(Maize Chlorotic Mottle Virus,MCMV)与甘蔗花叶病毒(Sugarcane Mosaic Virus,SCMV)共同侵染引起的玉米致死性坏死[44]。此外,一种新型的纳米递送系统采用了细胞穿梭肽(CPP)修饰的自组装形成的四面体DNA框架结构(TDN)作为核心,外壳由聚多巴胺杂化介孔二氧化硅纳米颗粒(PDA-MSN)构成。该系统能够延缓siRNA的降解,并且在酸性条件下智能响应药物释放,从而显著提高siRNA的利用效率[50]。同时,功能化碳量子点(CDs)被证明能够有效保护siRNA免受核酸酶的降解。在与RNase-Ⅲ孵育1 h后,siRNA的降解程度最小[51]。
-
真菌细胞膜具有选择通透性,通常情况下,长链的dsRNA分子较大,不易通过真菌的细胞膜进入细胞内部。因此,病原菌对dsRNA的吸收效率成为RNAi技术有效性的关键限制因素之一,直接影响该技术的应用效果。为解决dsRNA的递送瓶颈,可采用多种纳米材料来提升病原菌的吸收效率。例如,星形多聚阳离子聚合物(SPc)与dsRNA络合后施用,显著提高了Phytophthora infestans对dsRNA的吸收效率,进而增强了dsRNA对马铃薯晚疫病的防控效率[27]。此外,功能化碳量子点(CDs)通过静电相互作用与筛选的dsRNA络合,显著提高了Phytophthora infestans和Phytophthora sojae对dsRNA的吸收能力,从而提升了dsRNA对疫霉病的防治效果[29]。另外,采用冻融法制备的仿生纳米囊泡(ECNs),通过从番茄叶细胞膜和阳离子固醇体组装而成,展现了对dsRNA的高负载能力和保护性能,成功克服了致病疫霉对dsRNA的吸收屏障[48]。
-
纳米材料可以有效隔绝外界环境对dsRNA的影响,特别是采用包裹方式获得的纳米载体核酸杀菌剂。在植物体内,sRNAs可能通过胞间连丝从一个细胞转移到另一个细胞,并通过脉管系统运输[52]。Cai等[53]发现拟南芥细胞会分泌外泌体样细胞外囊泡,将sRNAs传递到真菌病原体葡萄孢菌中。这些含有sRNA的囊泡积聚在感染部位,并被真菌细胞吸收,转移的宿主sRNAs诱导真菌致病性关键基因的沉默。为了提高dsRNA的利用效率,该团队在此研究的基础上,采用了DOTAP + PEG、DOTAP和DODMA 3种不同的阳离子脂质配方合成人工纳米囊泡,用于包封dsRNA。这种包封方式有效防止了核酸酶和雨水冲刷对dsRNA的影响,并且无论是在果实收获前还是收获后使用纳米囊泡,都能够显著延长dsRNA的作用时间[46]。此外,将低成本的星形阳离子(SPc)纳米载体与dsRNA络合后,形成的复合物在植物叶片上停留时间可长达12 d,进而显著提高了植物的抗病性[27]。
-
在保证对农作物防效的前提下,减少传统化学杀菌剂的使用,一直是农业研究的热点问题。将聚乙二醇二胺(PEGDA)功能化的碳量子点纳米颗粒(CDs)通过静电相互作用与靶向疫霉菌保守的羧酸酰胺类(CAAs)杀菌剂靶标蛋白—纤维素合酶3(CesA3)和氟噻唑吡乙酮的靶标氧化固醇结合蛋白1(OSBP1)的dsRNA络合,dsRNA-CDs显著增强了dsRNA对辣椒疫霉菌的防治效果;与化学杀菌剂联合使用时,即便将化学杀菌剂使用量减少90%,依然能达到相同防治效果;该结果表明,dsRNA-CDs纳米载体不仅在作物疫病防治方面表现出色,同时对于化学农药的减量增效具有重要意义[29]。此外,施用方法上还可以选择dsRNA杀菌剂和化学农药共同使用。这种组合不仅能保证防控效果,还能显著减少化学农药的使用量,从而更好地解决农业生产中的实际问题[54]。相关研究表明,基于纳米载体的dsRNA杀菌剂在病害防治中的防效与市售化学农药效果相当,甚至在某些情况下,效果更为优越[27]。
2.1. 增强对dsRNA的保护作用
2.2. 提高dsRNA递送效率
2.3. 延长dsRNA对作物的保护时间
2.4. 减少化学杀菌剂的使用
-
全球首款喷洒型RNA生物农药Ledprona(商品名Calantha)于2023年在美国获得批准,这标志着世界上首个允许商业使用的可喷雾dsRNA农药正式投入市场,目前已获美国国家环境保护署批准登记,这对RNA农药的行业发展具有重要意义。我国在推动农业可持续发展方面也积极布局,已明确提出要优先发展RNA生物农药,表明对该技术的高度重视。2024年4月,中国农药工业协会发布了全球首个RNA农药标准——《烟草花叶病毒衣壳蛋白核酸干扰素母药》团体标准,为行业提供了科学、规范的研发与生产标准。这些进展不仅加速了dsRNA杀菌剂研究成果的转化、商业化和产业化,还为我国在RNA农药领域实现技术突破与产业领先创造了重要契机。
靶标基因的选择是dsRNA杀菌剂有效性的关键。对于RNA生物农药靶标基因选择,可以将已知病原菌的关键生长、发育或致病基因作为靶标进行筛选;同时,还可以利用大数据技术建立有害生物RNAi靶标基因的智能化筛选系统。开发广谱性农药的同时,避免对非靶标生物的伤害一直是研究的目标。人们希望通过使用单一农药实现对多种有害生物的防控。未来,dsRNA生物农药将朝着广谱防治的方向发展,即能够针对多个靶点进行设计,而不再局限于单一有害生物,从而提升农药的应用效果。dsRNA杀菌剂具有较强的靶标基因替代性,可以有效解决有害生物抗药性的问题。
基于纳米载体的递送系统已被证实能有效提高dsRNA的递送效率,并为其提供保护屏障。纳米材料作为递送载体的生物安全性问题一直备受关注,主要涉及纳米材料的降解、在环境中的扩散风险以及对非靶标生物的毒性等。开发与dsRNA生物相容性高的纳米载体,既能提高核酸的稳定性,又能确保其顺利递送至有害生物体内,这是实现有效防控的关键。因此,低成本、绿色环保且多功能的纳米载体具有广阔应用前景。
植物叶片表面有蜡质层、绒毛等结构,展现出一定的疏水性,因此,农药液滴在植物叶片上的低接触角和高滞留是提高其利用效率的关键[55]。dsRNA杀菌剂的助剂开发具有较高挑战性。如果在纳米材料表面引入羧基、氨基等基团进行修饰,或通过改变纳米材料表面电位、利用静电吸附作用等方式增强dsRNA杀菌剂在叶片上的附着力和接触面积,就能进一步提高核酸的利用效率。使纳米材料兼具递送和助剂功能,不仅有助于降低成本,还有助于提高效果。
商业化dsRNA合成试剂盒的成本较高,但随着合成生物学技术的飞速发展,通过改造工程菌株,在保证活性成分的同时实现了dsRNA的量产,从而显著降低了RNA生物农药的生产成本[56-57]。随着研究的不断深入,基于纳米载体的dsRNA杀菌剂的生产工艺将更加成熟,核酸的低成本规模化生产和纯化工艺将得到进一步完善,相关的生产标准和质量控制体系也将逐步建立,评估和监管体系将更为健全。随着法律法规的不断完善和公众意识的提升,基于纳米载体的dsRNA杀菌剂将在全球市场获得更广泛的接受度,将成为未来农业中一种重要的植物病害防治手段。因此,这种基于纳米载体的dsRNA杀菌剂凭借其在农业病害防控、食品安全保障和农业绿色可持续发展方面展出多重优势,将成为最具产业化前景的新型生物防治技术之一。



 下载:
下载: