-
有机氯废气(Chlorinated Volatile Organic Compounds,Cl-VOCs)属于美国环境保护署优先控制的污染物[1]. Cl-VOCs种类多,应用广,此类污染物具有高挥发性、外源性和持久性,在环境中非常稳定,难降解[2]. 大多数Cl-VOCs对人体具有致癌性,排入大气中易形成雾霾、臭氧空洞、光化学烟雾和温室效应等环境问题[3]. 过去几十年,人们在生产和使用过程中将Cl-VOCs泄露到环境,再加上不合适的末端处理方法,使其在世界环境范围内广泛分布[4]. Cl-VOCs已经被划分为有害有机污染物,很多国家将其作为高度有害化学物质并列入减排的工作目标中[3]. 因此,开发Cl-VOCs高效、绿色治理技术已引起全世界的极大重视.
应用生物技术处理有机废气,具有操作简单、经济、安全和无二次污染物等优点[5]. 其中生物滴滤器(Biotrickling filter,BTF)被广泛应用于废气治理领域,具有结构简单、寿命长、压降低、耐酸的优势[6]. 然而,该技术在处理工业Cl-VOCs却受到一定限制,原因为:Cl-VOCs疏水性差,气液传质弱;另外其生物可利用性差;多数Cl-VOCs还具有生物毒性,导致微生物活性降低. 这些因素都是造成生物滴滤器应用效果差的原因[7].
近年研究发现,真菌由于独特的生长环境和个体特性,对难降解的有机物具有独特的优势,可应用于降解多环芳烃、染料等[8]. 真菌对恶劣环境具有更好的适应力和忍耐力,能在低湿度、低pH值的环境中生存,比细菌对污染物具有更好的降解能力. 另外,菌丝作为多数真菌营养生长的主要模式,具有巨大比表面积,增加了对污染物的吸收和传质,进而提高降解能力[9].
磁技术在多个领域被广泛应用,如工农医、石油和水处理等领域,具有经济、环保、易操作等优点[10]. 近年来,有报道称在废水生化处理中,一定强度磁场可以提高废水的处理能力[11]. 生物体均会受到外磁场、环境磁场和体内磁场的影响,磁性为物质的基本属性[12]. 尤其是对于生物的生长,弱磁场对其具有积极作用. 除此之外,不同种类生物对相同的磁场强度反应也不同[13].
三氯乙烯(Trichloroethylene,TCE)属于典型的Cl-VOCs,溶解力强,被广泛使用. 微溶水或以非水溶相游离于水中,引起水环境问题. 另外,挥发进入大气,形成温室效应、光化学烟雾、臭氧层空洞、雾霾等大气污染[14]. TCE具有持久性、难降解性,无法被微生物直接降解,原因为无法直接提供微生物生长的物质和能量,但是可以被共代谢降解,在共代谢基质所诱导出的酶和辅因子的作用下被降解[15].
鉴于此,本研究首次将磁场、真菌和生物滴滤器进行耦合,以提高对废气的去除效果. 以TCE为目标废气,培养驯化降解TCE的混合真菌,接种在以木片为填料的BTF中,研究不同磁场强度下BTF对不同质量浓度TCE的去除性能,并应用高通量测序技术首次对磁场与真菌群落结构和功能之间的关系进行了分析,以期为磁场、真菌和BTF耦合技术应用于疏水性VOCs的去除提供有效借鉴.
全文HTML
-
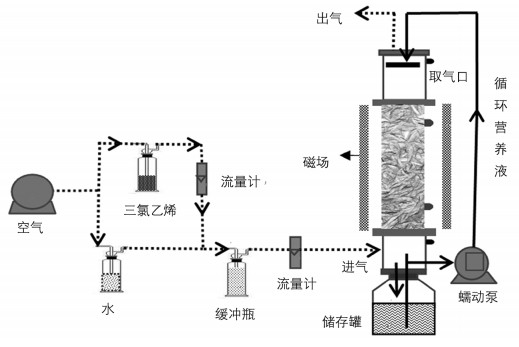
反应流程见图 1,内部填料为8~10 mm粒径的木片,MFI分别为0,20.0,60.0,80.0 mT,接种菌液为已驯化好的真菌,气体流量为0.4 L/min,空床停留时间(EBRT)为405 s. TCE的质量浓度1~15 d,为24.6~204.6 mg/m3;16~157 d,为370~1 000 mg/m3.营养液为改良后的马丁氏营养液,生物滴滤器及启动具体方法见已发表文献[6].
-
取3.0 g腐烂木头,无菌操作环境下,于1L的锥形瓶中,添加改良后的马丁氏营养液至500.0 mL,同时加入一定质量浓度的TCE,密封后放于25 ℃,80 r/min振荡器中驯化培养. 每4 d离心分离菌液,重复上述操作,并逐次加大TCE质量浓度,持续40 d结束.
-
改良的马丁氏营养液:2.0 g/L乙酸钠,1.0 g/L蛋白胨,1.0 g/L KH2PO3,0.5 g/L MgSO4,0.5 g/L微量元素,3.0 mL的1%链霉素,3.3 mL的1%孟加拉红溶液,加灭菌水定容至1 000.0 mL,调节pH值为7.0 ± 0.2.
-
TCE质量浓度由岛津气相色谱(GC-2010)测定,FID和Rtx-1701 (30 m×0.25 mm×0.25 μm)分别为检测器和色谱柱,保留时间为2.59 min,具体分析方法见已发表文献[6].
-
为分析不同磁场强度下真菌群落结构,取0.300 0 g生物膜样品放入2.0 mL灭菌离心管中. 取自反应器底部取样口,取样时间为27 d (MFI 0 mT),69 d (MFI 20.0 mT),103 d (MFI 60.0 mT),137 d (MFI 80.0 mT). 根据说明书提取DNA(OMEGA试剂盒E. Z. N. ATM Mag-Bind Soil DNA Kit的试剂盒),使用-80 ℃冰箱保存提取后的DNA.
-
提取后的DNA委托生工生物工程(上海)股份有限公司进行高通量测序. 其中扩增DNA分两轮完成,第一轮扩增:基因组DNA精确定量选用Qubit3.0 DNA检测试剂盒. PCR所用的引物已融合了Miseq测序平台的ITS1-2通用引物;ITS1引物:CCCTACACGACGCTCTTCCGATCTN(barcode)CTTGGTCATTTAGAGGAAGTAA;ITS2-Rev引物:GTGACTGGAGTTCCTTGGCACCCGAGAATTCCAGCTGCGTTCTTCATCGATGC. 第二轮扩增引入Illumina桥式PCR兼容引物. 扩增产物再进行DNA纯化回收.
-
回收的DNA使用Qubit3.0 DNA检测试剂盒进行精确定量,按照1∶1等量混合,等量混合后的DNA样品量为10 ng,物质的量为20 pmol. Illumina Miseq 2× 300 bp为上机测序平台,原始数据上传至NCBI数据库,SRA:126692.
1.1. 生物滴滤器的构建与启动
1.2. 真菌的培养与驯化
1.3. 培养液
1.4. 分析方法
1.5. 真菌群落结构分析
1.5.1. 基因组DNA提取
1.5.2. PCR扩增
1.5.3. 高通量测序
-
启动阶段,TCE的进气质量浓度控制在24.6~204.6 mg/m3,EBRT为405 s,MFI 0 mT,乙酸钠为共代谢底物,每天提供4.5 L营养液,系统运行温度25 ℃.
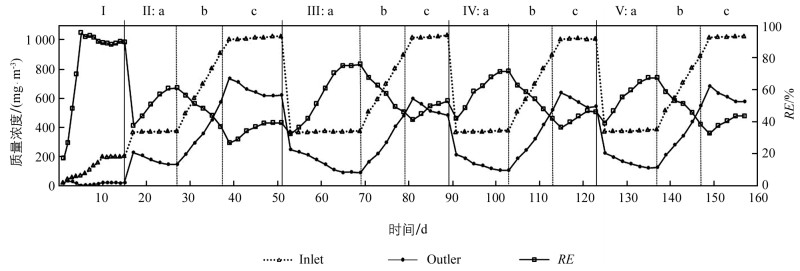
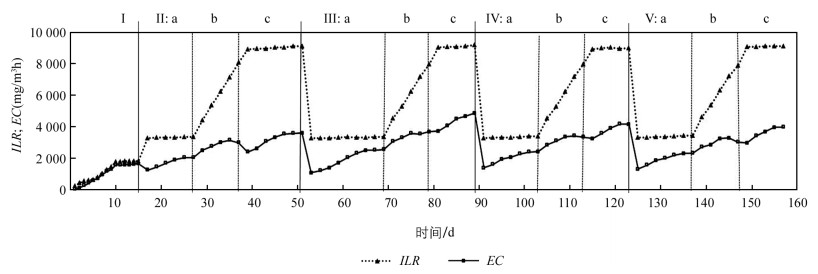
启动时间为1~15 d,生物滴滤器对TCE的去除率(Removal Efficiencies,RE)见图 2Ⅰ. 由图可知随着启动时间的延长,RE逐渐增加,生物膜形成加快. 挂膜第1 d,TCE的质量浓度为24.6 mg/m3,RE为17.17%. 接下来的启动时间里,随着生物膜的快速形成,RE也快速提高. 尤其是第5 d,TCE质量浓度为69.6 mg/m3,RE为95.5%. 为了确定生物膜形成是否成熟,在6~15 d,提高TCE进气质量浓度为86.7~204.6 mg/m3,RE逐渐增大,在15 d,稳定在87.8%. 图 3Ⅰ所示此时最大去除容量(Maximum Elimination Capacities,ECmax)为1 630.0 mg/m3h,对应的进气负荷(Inlet Loading Rate,ILR)为1 818.4 mg/m3h,说明生物滴滤器的挂膜启动阶段基本完成. 此结果表明,以木片为填料的生物滴滤器,接种已驯化的真菌菌液,生物滴滤器启动时间短,缩短进入稳定运行期的时间.
-
16~157 d反应器进入稳定运行期,依次改变磁场强度:MFI 0 mT,MFI 20.0 mT,MFI 60.0 mT,MFI 80.0 mT,考察对TCE的RE和EC的影响. 共代谢基质仍然为乙酸钠,营养液仍为改良后的MDS培养液,EBRT为405 s;为考察不同磁场强度下反应器对不同质量浓度TCE的去除效果,TCE的进气质量浓度设置为:低质量浓度370 mg/m3,变质量浓度梯度500~900 mg/m3,高质量浓度1 000 mg/m3.
-
TCE质量浓度为370 mg/m3,生物滴滤器对TCE的RE如图 2所示. 由图可知,随着处理时间的延长,RE逐渐增大. 变换磁场大小时,RE开始均较小,32.3%(MFI 20.0 mT)<37.6%(MFI 0 mT)<39.2%(MFI 80.0mT)<41.8%(MFI 60.0mT),尤其是MFI 20.0 mT,开始的RE最小,主要由于磁场刚建立,有些真菌不适合磁场环境,生长速度变慢甚至死亡,而随着外加磁场时间的延长,一些真菌逐渐适合磁场环境,生长速度和产酶量也随之增大,RE增大,并达到稳定值. 当磁场强度分别为MFI 20.0 mT,MFI 60.0 mT,MFI 80.0 mT和MFI 0 mT,达到的稳定RE及所需时间分别为:75.9%,18 d;71.4%,14 d;67.3%,14 d;61.0%,12 d. 由此可见,磁场强度越小,稳定后RE越大,RE最大为75.9%,此时的MFI为20.0 mT. 图 3a表示ILR为3 300 g/m3h条件下,不同磁场强度下的EC图,由图可知,随着磁场强化时间的延长,EC逐渐增大,ECmax顺序为:2 548.1 mg/m3h (MFI 20.0 mT)>2 412.2 mg/m3h (MFI 60.0 mT)>2 318.0 mg/m3h (MFI 80.0 mT)>2 038.8 mg/m3h (MFI 0 mT). 此结果说明,磁场提高对370 mg/m3低质量浓度TCE的去除效果,尤其是MFI 20.0 mT下的去除效果最好.
-
工厂排放的废气质量浓度多变,因此,考察了不同磁场强度下(0 mT,20.0 mT,60.0 mT,80.0 mT)生物滴滤器对变质量浓度TCE的处理效果,每2 d改变TCE质量浓度(500~900 mg/m3),结果如图 2、图 3所示.
由图 2b可见,随着TCE质量浓度的增大,RE呈现降低趋势. MFI 20.0 mT下生物滴滤器对TCE的RE最佳,维持在67.4%~46.1%,而当磁场强度增大到60.0,80.0 mT,RE分别在62.8%~41.8%,58.7%~38.1%. 由此可见随着磁场强度的增大,生物滴滤器对TCE的处理效果降低. 而MFI 0 mT条件下生物滴滤器对TCE的处理效果最差,RE为56.5%~36.8%. 结果说明,生物滴滤器外置磁场可以提高对TCE的去除效果,尤其是低MFI 20.0 mT的效果好于MFI 60.0 mT和MFI 80.0 mT. 图 3b为ILR和EC之间的关系图,ILR为4 400~8 000 g/m3h. 如图所示,当MFI 0 mT,60.0 mT,80.0 mT,EC随着ILR的增大而增大,达到最大值后出现下降趋势,主要是由于传质的限制和反应限制所致[16]. 此外,高质量浓度TCE也可能引起底物抑制作用,这也会使高质量浓度下的处理效果降低[16]. 然而MFI 20.0 mT时,EC却随着ILR的增加而增大,没有出现底物抑制作用,说明低磁场强度可以克服底物抑制作用. ECmax的顺序为:3 684.3 mg/m3h (MFI 20.0 mT)>3 425.4 mg/m3h (MFI 60.0 mT)>3 289.4 mg/m3h (MFI 80.0 mT)>3 138.4 mg/m3h (MFI 0 mT),对应的ILR分别为7 984.2,7 162.9,7 204.7,7 154.9 mg/m3h.
-
高质量浓度TCE具有质量浓度抑制作用,因此考察高质量浓度(1 000 mg/m3)下不同磁场强度对TCE的去除效果. 如图 2c所示,RE的变化趋势明显,均表现为开始较小,后随时间延长,呈现增大趋势,达到最大值. RE大小依次为MFI 20.0 mT>MFI 60.0 mT>MFI 80.0 mT>MFI 0 mT. 4种磁场强度下,开始阶段RE均较低,主要是因为高质量浓度TCE引起溶剂压力[17]. 开始增大TCE质量浓度,由于真菌对TCE的去除能力较差,随着时间的延长,溶剂压力的影响减弱. 尤其是MFI 20.0 mT表现较好的RE,为41.2%~52.9%,8 d达到最大值. 而MFI 60.0 mT和IMF80 mT,也在8 d达最大RE,对应的RE范围稍低,分别为36.3%~46.6%和32.6%~43.3%. 而无磁场下,MFI 0 mT的RE仅为26.8%,10 d后稳定在39.4%左右. 由此可见,外置磁场可以减小溶剂压力,提高TCE的去除效果. 分析原因:不同磁场强度下真菌群落结构不同,导致RE不同;另外,不同磁场强度下优势降解真菌种类也不同,其对高质量浓度的TCE具有不同的耐受性. 图 3c为EC和ILR的关系图,进气质量浓度为1 000 mg/m3 TCE,对应的进气负荷为9 000 mg/m3h. 由图可见,随着时间的延长,4种磁场强度下的EC均呈现增大趋势,ECmax:4 854.1 mg/m3h (MFI 20.0 mT)>4 168.2 mg/m3h (MFI 60.0 mT)>3 975.4 mg/m3h (MFI 80.0 mT)>3 594.8 mg/m3h (MFI 0 mT).
图 2a,b,c和3a,b,c表明,外置磁场可以增加生物滴滤器对TCE的去除效果,不同磁场强度对RE和EC的影响不同. 尤其是低磁场强度处理效果最好,MFI 20.0 mT的去除效果好于MFI 60.0 mT和MFI 80.0 mT,高磁场强度80.0 mT对TCE去除效果不明显. 关于生物滴滤器处理TCE的研究不多,已报道的接种B. cepacia G4,以陶粒为填料,空床停留时间为8.0~9.8 min,进气负荷为ILR 0.492 0~1.708 mg/m3h,所取得的ECmax仅为1 167 mg/m3h[18]. 空床停留时间为202.5 s,填料为火山石,降解菌为细菌,MFI 60.0 mT,ECmax为2 656.8 mg/m3h,对应的ILR为4 253.0 mg/m3h[6]. 本研究中,当MFI 20.0 mT,ECmax为4 854.1 mg/m3h,比已报道的ECmax大.
-
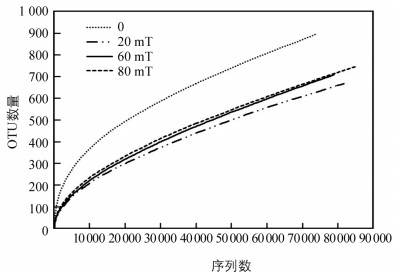
对样本聚类后,MFI 0 mT,MFI 20.0 mT,MFI 60.0 mT和MFI 80.0 mT的生物膜样品分别获得902,680,721,749条OTU. 4个生物膜样本的覆盖率均为0.99,说明本实验所抽取的序列数足够可以反映真菌群落的特征.
Chao指数越大,群落物种数越多,丰富度越高. 由表 1可知,Chao指数MFI 80.0 mT>MFI 0.0 mT>MFI 60.0 mT>MFI 20.0 mT. 群落中物种个体数目分配均匀程度用Shannon指数表示,其均匀度顺序为MFI 0 mT>MFI 80.0 mT>MFI 60.0 mT>MFI 20.0 mT. 由此说明,MFI 20.0 mT作用下的真菌群落物种数最少,均匀度最小. 分析原因为MFI 20.0 mT对某些种类真菌起抑制作用,导致真菌种类减少,而对优势菌具有促进作用,群落以优势菌为主,从而均匀度最小,由此解释了MFI 20.0 mT下对TCE的去除效果最佳的原因.
-
图 4为样品在0.97相似性水平下的稀释曲线,比较说明测序数据量不同的样本中物种的丰富度. 由图 4可知曲线虽未饱和,但均趋平坦,说明样品均已获取了绝大多数样本信息,可表达样品中真菌群落组成[19]. 样本中物种丰富度顺序为:MFI 0 mT>MFI MFI 80.0 mT≈MFI 60.0 mT>MFI 20.0 mT,说明无磁场条件下的真菌物种最多,而MFI 20.0 mT作用下的物种数最少.
-
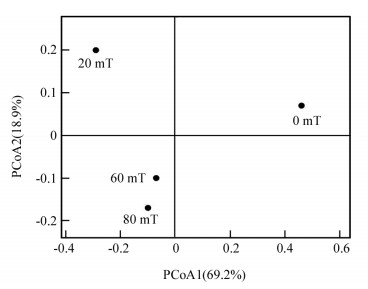
PCoA表示样本间差异,样品间距越近,说明群落组成越相似. 图 5说明4个样本中真菌群落间的差异,主成分1(PC1)和主成分2(PC2)是样品的最大2条差异特征,分别69.2%和18.9%的贡献率. MFI 80.0 mT和MFI 60.0 mT的样品聚在一个格室,距离较近,两者的真菌群落相似性较高. MFI 20.0 mT和MFI 0 mT分别聚在一个格室,真菌群落差异较大. 由于主成分1 (PC1)的贡献率最大为69.2%,所以MFI 20.0 mT和MFI 0 mT真菌群落差异最大. 由此可见,经过磁场强化作用的真菌群落结构与无磁场作用下的差异较大.
-
真菌门分类水平见表 2,表明不同条件下真菌在门水平存在一定差异,主要门包括Ascomycota,Basidiomycota,Zygomycota,Chytridiomycota,Microsporidia. 磁场强化下优势门Ascomycota丰度增大,说明磁场对Ascomycota具有促进作用,低磁场MFI 20.0 mT下的丰度最大. Ascomycota丰度大小顺序为MFI 20.0 mT(90.82%)>MFI 60.0 mT(83.17%)>MFI 80.0mT(79.37%)>MFI 0 mT(51.67%).
本研究结果表明,优势门Ascomycota在磁场作用下的丰度明显增大. Ascomycota门的真菌具有强氧化能力,可被外源物质利用和降解,现已广泛应用于生物修复中:如有机氯化物、多环芳烃、芳香烃类和农药等[20]. 实验结果表明,磁场下TCE去除性提高,由此说明Ascomycota可以共代谢降解TCE,磁场作用下增大Ascomycota的丰度,从而提高磁场作用下对TCE的去除效果. 作为TCE的降解真菌,Ascomycota比其他的降解菌具有更多的优势,具有更强的降解能力. 白腐真菌也常用于生物修复中,但在酸性环境中生长快,而Ascomycota在中性环境中生长快,不降解木质素,不会引起木片填料的降解,导致压降[21]. 所以应用Ascomycota为优势真菌,构建的真菌生物滴滤器对降解Cl-VOCs具有较好的效果,具有广泛的应用前景.
-
为了深入地了解真菌的种类和功能,对排名前10的属进行了分析(表 3). 由表 3可见,不同磁场条件下真菌群落存在明显差异. 存在6个主要属,分别为Pseudallescheria,Parascedosporium,Exophiala,unclassified Ascomycota,unclassified Sordariomycetes和unclassified Herpotrichiellaceae genera,功能上可能起到共代谢降解TCE的作用. 6个属的丰度依次为:MFI 20.0 mT (85.9%)>MFI 60.0 mT (79.7%)>MFI 80.0 mT (63.9%)>MFI 0 mT (34.4%),该顺序与生物滴滤器对TCE的去除效果一致. Pseudallescheria在MFI 20.0 mT中的相对丰度最大为22.1%,而在MFI 0 mT中为16.4%,磁场MFI 60.0 mT和MFI 80.0 mT中仅为4.8%和3.9%. 由此可见弱磁场有利于提高Pseudallescheria的丰度,而高磁场强度对其具有抑制作用. Pseudallescheria sp.分布广泛,在营养条件差的好氧土壤、污染的水体、腐烂的木头、粪便和城市污泥中均有分布[22]. 研究表明Pseudallescheria sp.可以用于原油[22]、二噁英、四氯化到十氯化混合物的二噁英的降解[23]. 通常以葡萄糖为共代谢底物[24],真菌生长的最佳pH值小于9,相比酸性pH值下的白腐真菌具有一定优势[25]. 因此推测Pseudallescheria提高了MFI 20.0 mT下生物滴滤器对TCE的去除效果.
表 2和表 3说明,磁场对真菌群落结构存在影响,通过提高优势门Ascomycota的丰度,从而提高对TCE的去除效率,尤其是弱磁场MFI 20.0 mT作用下去除效果最佳. 多数研究表明弱磁场对微生物起促进作用,而磁场强度增大则起抑制作用. 如安燕等[26]发现由磁粉产生的弱磁场可以加速微生物生长,1~4 g/L的磁粉有利于微生物对数生长期的提前. Okuno等[27]研究发现低磁场强度促进大肠杆菌生长,高强度磁场则无此作用. 分析原因为合适大小的磁场磁化了生物膜中的水,改变了介质水溶液的很多性质,尤其是介质水溶剂渗透压的改变提高了微生物细胞膜的通透性,从而使营养液更容易被微生物吸收,促进了微生物的生长和繁殖[28]. 另外,相同磁场强度对不同种微生物的影响也不同,代群威等[29]研究发现0.15 T磁场对葡萄球菌、大肠杆菌的生长影响不明显,但抑制白色念珠菌生长. 磁场对微生物的影响因素复杂,随着磁场大小和类型、作用时间和温度、生长介质、微生物种类的不同而不同[13].
2.1. 生物滴滤器的挂膜启动
2.2. 磁场强化下对真菌生物滴滤器去除效果影响
2.2.1. 生物滴滤器对低进气质量浓度TCE(370 mg/m3)的去除效果
2.2.2. 生物滴滤器对变质量浓度TCE(500~900 mg/m3)的去除效果
2.2.3. 生物滴滤器对高质量浓度TCE(1 000 mg/m3)的去除效果
2.3. 磁场强度对真菌群落结构影响
2.3.1. Alpha多样性指数分析
2.3.2. 稀疏性曲线
2.3.3. 主坐标分析(PCoA)
2.4. 物种分类水平分析
2.4.1. 门水平分析
2.4.2. 属水平分析
-
以木片为填料,真菌为降解菌,考察磁场强化下生物滴滤器对TCE废气的去除效果. 2.0 g/L乙酸钠为共代谢底物,EBRT为405 s,营养液为改良后的马丁氏营养液,供给量为4.5 L/d,主要结论如下:挂膜启动阶段,TCE进气质量浓度为24.6~204.6 mg/m3,磁场强度为0,在15 d内可快速完成挂膜启动,RE稳定在87.8%;磁场提高真菌生物滴滤器对TCE的去除效果,尤其是MFI 20.0 mT下TCE的去除效果最好:TCE质量浓度为370,500~900,1 000 mg/m3,RE和ECmax分别为75.9%,2 548.1 mg/m3h;67.4%~46.1%,3 684.3mg/m3h;52.9%,4 854.1 mg/m3h;磁场作用下降低真菌丰富度和均匀度,但提高优势菌的丰度. 优势门为Ascomycota,MFI 20.0 mT中丰度最大为90.82%,明显高于MFI 0 mT(51.67%). MFI 20.0 mT中的优势属为Pseudallescheria,丰度为22.1%.



 下载:
下载: