-
开放科学(资源服务)标志码(OSID):

-
柑橘生产主要是采用嫁接苗木,而砧木对植物的耐盐性起关键性作用[1]. 在传统以枳为砧木的柑橘果园中,土壤高pH值(7.55~8.50)使得果树普遍发生缺铁黄化,严重影响柑橘生长和产量[2]. 柑橘砧木对接穗生长发育具有重要的基础作用,了解柑橘砧木缺铁的生理特性及其分子机制具有重要的理论价值和实际意义.
铁螯合还原酶基因(FRO)是双子叶植物从土壤中吸收铁的关键基因,在其铁营养吸收过程中发挥着至关重要的作用. 研究表明,拟南芥基因组存在8个编码铁螯合还原酶的基因[3-4](AtFRO1-8),其中,AtFRO2在拟南芥根系中高水平表达,负责将土壤中氧化铁还原为二价铁,供植物利用[3-4]. AtFRO3在根和地上部分均表达,缺铁能提高其表达水平,同时受到铜的诱导[5]. AtFRO4在子叶和角果中有表达,AtFRO5主要在茎和花中表达[5-6],这两个基因具有冗余功能,参与铜响应和吸收过程[7]. AtFRO6和AtFRO7在植物绿色组织器官中高水平表达,并受光调控[5, 8]. 烟草中组成型表达AtFRO6基因能增加叶片中铁螯合还原酶活性和亚铁含量,但其根中铁螯合还原酶活性和亚铁含量均未提高,表明AtFRO6在叶细胞中可发挥螯合还原三价铁的作用[9]. AtFRO7参与缺铁条件下幼苗光合作用过程中叶绿体中铁的获取过程[10]. AtFRO8主要在地上部分表达[5],在衰老叶片维管组织中也有表达[6]. 而AtFRO1在各植物组织器官中表达水平极低[5-6]. 这些结果显示植物基因组存在多个FRO同源基因,且各FRO同源基因在植物铁营养吸收过程中发挥着不同的作用.
Sudahono等[11]分析了18种柑橘砧木在缺铁性土壤中的表现,其结果表明非枳类型的柑橘砧木对缺铁表现出耐性或中等耐性,而大部分的枳类型则表现出中等敏感或非常敏感. 朱世平等[12-13]对15种柑橘砧木品种耐盐性的研究表明,不同砧木品种在耐盐耐碱方面存在非常大的差异,如印度酸橘、扁平橘、红皮酸橘、资阳香橙和枸头橙适应盐碱能力强,而枳、莽山野柑对盐比较敏感,柑橘砧木可以通过调控相关离子吸收和提高抗氧化物质活性从而增强耐盐性. 这些研究结果表明不同柑橘砧木品种在耐缺铁、耐盐碱方面存在较大差异,但具体机制还不是很清楚.
为研究缺铁对不同柑橘砧木材料的影响,了解柑橘基因组中FRO基因的遗传背景,本研究选取了目前常用以及新发现的具有砧木价值的17个柑橘砧木品种,进行缺铁胁迫处理,分析其耐缺铁特性和柑橘基因组中编码铁螯合还原酶的同源基因的缺铁诱导特性,克隆了明显受缺铁诱导的同源基因上游调控区,分析其序列特征及其单体类型,进而分析了主要柑橘砧木的耐缺铁特性和其单体型的相关性,并通过转基因拟南芥分析了不同单体类型上游调控区的缺铁诱导特性. 这将有助于进一步了解不同柑橘砧木种质资源在耐缺铁特性方面存在差异的原因,为筛选优良的柑橘砧木提供理论依据.
全文HTML
-
柑橘砧木品种种子购自中国农业科学院柑桔研究所种质资源研究室(表 1). 柑橘种子经3%的高锰酸钾溶液浸泡30 min,去离子水漂洗3次以上,剥去外种皮置于28 ℃培养箱中暗培养2周至种子萌发;将萌发的种子放入PNS营养液中进行水培. 光照条件为20 000 Lx,16 h光照/8 h黑暗. 水培4周,每7 d更换1次营养液,水培过程中进行通气处理. 铁缺乏实验组EDTA-Fe2+浓度为2 μmol/L,铁充足对照组EDTA-Fe2+浓度为20 μmol/L.
-
叶绿素质量分数的测定参考张志良等[14]的方法.
总铁质量分数的测定采用原子吸收分光光度计(TAS-900)法.
柑橘砧木根尖FCR酶活性测定参考Waters等[15]的方法.
-
对克里曼丁橘(Citrus clementina)和甜橙(Citrus sinesis)基因组数据库进行检索,获得FRO同源基因序列,然后用Clontech Advantage高保真酶扩增FRO同源基因及其启动子序列,进行亚克隆后送华大基因公司测序验证.
序列聚类分析结果经MEGA6软件UPGMA算法产生,motif结合位点经MEME(Suite 5.0.5,http://meme-suite.org/)和PlantRegMap(http://plantregmap.cbi.pku.edu.cn/binding_site_prediction.php)获得[16],聚类分析与motif结合位点的整合经TBtools(v.0.6669)软件生成[17].
-
实验操作步骤参照天根生化科技有限公司的植物RNA提取试剂盒和反转录试剂盒说明书. 按照表 2设计不同基因的RT-qPCR引物对,并使用Bio-Rad公司96 FX型定量PCR仪进行基因表达水平分析,循环参数为95 ℃ 3 min;95 ℃ 15 s,58 ℃ 15 s,72 ℃ 30 s,40个循环;最后反应产物进行熔解曲线分析(60~95 ℃),鉴定产物特异性,根据Ct值计算基因的相对表达水平.
1.1. 实验材料与处理
1.2. 叶绿素质量分数、铁质量分数和铁螯合还原酶活性的测定方法
1.3. 基因的克隆测序与信息学分析
1.4. 基因表达分析
-
缺铁症状主要表现在柑橘叶片中,其中枳橙(CC)、莽山野柑(MY)、酸橘(SH)、扁平橘(SW)、枸头橙(AL)、枳(TO)和兴义大红袍(XD)等几个柑橘砧木的黄化现象最为明显;汕头酸橘(SS)、红橘(BL)、朱橘(EH)、兰卜莱檬(RL)、土橘(CH)、枳雀(ZQ)的黄化现象较明显;而枳柚(ZY)、资阳香橙(ZX)、皱皮橘(VH)和黄木黎檬(HL)等的缺铁黄化现象最轻. 叶绿素质量分数检测结果显示,多数砧木品种在缺铁处理后其叶绿素a、叶绿素b和类胡萝卜素质量分数均明显下降(图 1a,1b,1C). 以叶绿素a为例,下降幅度最为明显的有莽山野柑(MY)、枳橙(CC)、黄木黎檬(HL)、枳(TO)、汕头酸橘(SS)等. 另外,对主根长度和侧根数目进行统计,发现各品种主根长度和侧根数量在缺铁处理组和对照组间差异无统计学意义.
铁质量分数可以在一定程度上衡量植物吸收铁的能力. 与对照组相比,柑橘砧木在缺铁胁迫条件下,地上部分及地下部分的总铁质量分数均降低(图 1d,1e);由于铁元素的主要吸收部位在根部,所以其地下部分的总铁质量分数高于地上部分,并且缺铁处理后总铁质量分数的降低程度也是地下部分高于地上部分.
-
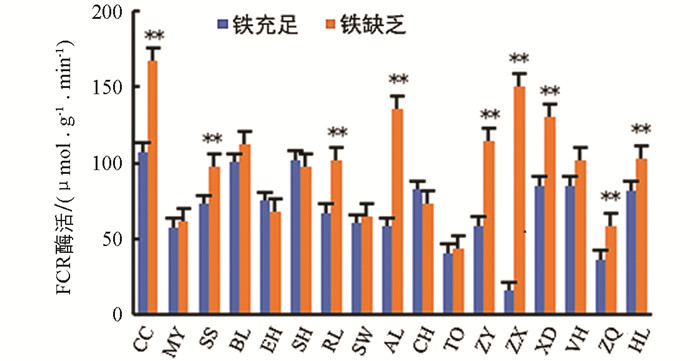
铁螯合还原酶(FCR)是双子叶和非禾本科单子叶植物从土壤中吸收铁的关键酶,比较了17种砧木品种根系在铁营养充足与缺乏条件下FCR酶活性. 与铁充足条件相比,17种柑橘砧木品种在铁缺乏条件下,大部分砧木品种根系FCR酶活性均被诱导升高,其中资阳香橙(ZX)、枸头橙(AL)、枳柚(ZY)、枳雀(ZQ)、枳橙(CC)、兰卜莱檬(RL)、兴义大红袍(XD)、汕头酸橘(SS)和黄木黎檬(HL)FCR酶活性均极显著升高,分别升高了850%,133%,95%,61%,57%,53%,53%,34%,26%;而莽山野柑(MY)、红橘(BL)、朱橘(EH)、酸橘(SH)、扁平橘(SW)、土橘(CH)、枳(TO)和皱皮橘(VH)FCR酶活性在铁营养欠缺条件下与对照组的差异无统计学意义(图 2).
根据这17种柑橘砧木品种在铁缺乏条件下其根系FCR酶活性是否被显著诱导升高,并结合其叶片黄化程度、叶绿素质量分数变化等生理指标,将砧木分为3种类型:枳柚(ZY)、资阳香橙(ZX)和枳雀(ZQ)属于缺铁耐受型;莽山野柑(MY)、红橘(BL)、朱橘(EH)、酸橘(SH)、扁平橘(SW)、土橘(CH)、枳(TO)、兴义大红袍(XO)和皱皮橘(VH)属于缺铁敏感型;枳橙(CC)、汕头酸橘(SS)、兰卜莱檬(RL)、枸头橙(AL)和黄木黎檬(HL)属于中间型.
-
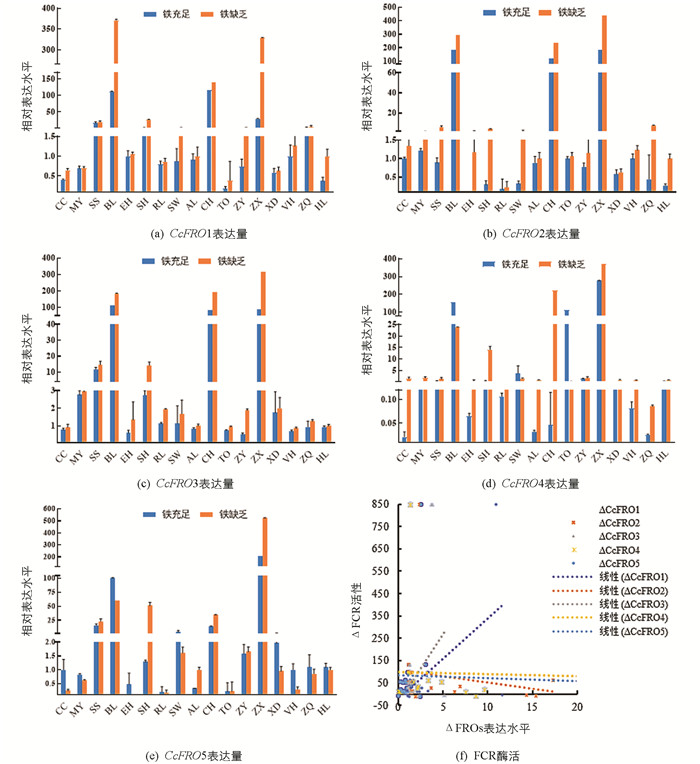
为了解柑橘中FRO基因家族成员的缺铁胁迫响应特性以及在各砧木品种根中受缺铁诱导表达特性,通过定量PCR检测了克里曼丁橘基因组中5个同源基因在铁充足和缺乏条件下不同砧木根中的表达水平. 结果显示:与铁充足相比,缺铁胁迫后CcFRO1,CcFRO2和CcFRO3基因在17种柑橘砧木品种根中的表达量都上调(图 3a,3b,3C),而CcFRO4和CcFRO5基因表达量仅在少数砧木品种中上调(图 3d,3e). 在17个柑橘砧木品种中,资阳香橙(ZX)、红橘(BL)和土橘(CH)根中的CcFRO1,CcFRO2和CcFRO3基因的表达量上调幅度最大,而枳(TO)、枳橙(CC)和兴义大红袍(XD)根中的CcFRO1,CcFRO2和CcFRO3基因的表达量都比较低. 以上结果表明不同柑橘砧木品种根中的CcFRO基因对缺铁诱导存在差异,其中CcFRO1,CcFRO2和CcFRO3表达明显受缺铁诱导.
分析铁充足与缺乏条件下CcFROs基因表达水平变化与砧木根中FCR酶活性间的相关性,结果显示CcFRO1和CcFRO3表达水平变化与砧木根中FCR酶活性变化存在正相关关系,其余CcFROs基因表达水平变化与FCR酶活性变化均无正相关关系(图 3f). 推测CcFRO1和CcFRO3表达水平增加可能是导致其根系铁螯合还原酶活性上升的主要原因.
-
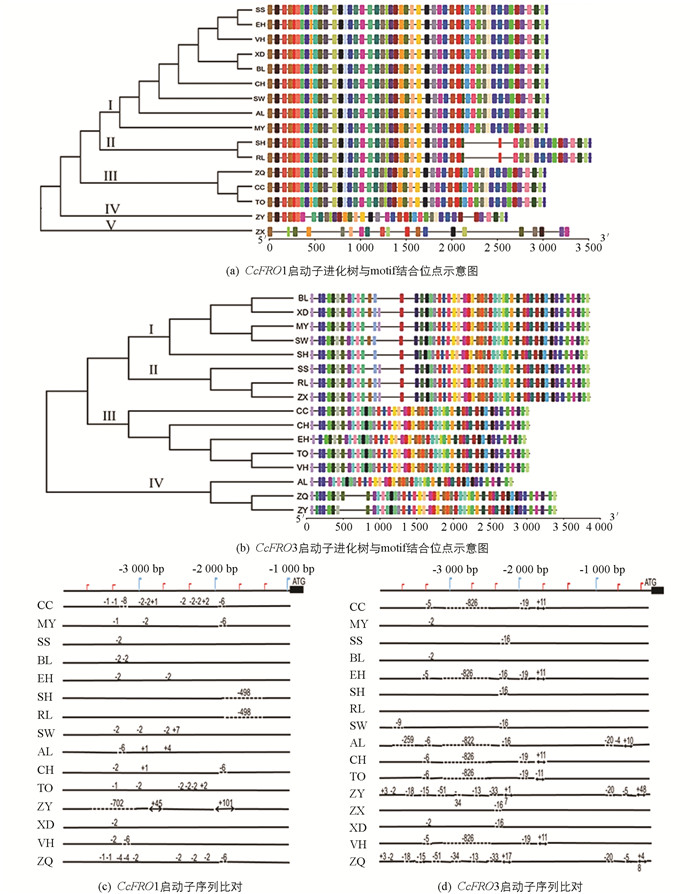
从柑橘砧木品种中克隆了CcFRO1和CcFRO3两个基因长约3 000 bp上游调控区,序列进化树分析发现:柑橘砧木品种中CcFRO1上游调控序列可分为5类(黄木黎檬在各网站上均无其基因组序列,且设计引物多次扩增未能成功,因此去除):资阳香橙(ZX)、枳柚(ZY)与其他品种序列差异最大,各自单独成为一类;枳雀(ZQ)、枳橙(CC)和枳(TO)为一类;酸橘(SH)和兰卜莱檬(RL)为一类;其余砧木品种为一类(图 4a). CcFRO3上游调控序列可分为4类:红橘(BL)、兴义大红袍(XD)、扁平橘(SW)、酸橘(SH)和莽山野柑(MY)为一类;汕头酸橘(SS)、兰卜莱檬(RL)和资阳香橙(ZX)为一类;枳橙(CC)、土橘(CH)、朱橘(EH)、枳(TO)和皱皮橘(VH)为一类;枸头橙(AL)、枳柚(ZY)和枳雀(ZQ)为一类(图 4b).
砧木品种CcFRO1和CcFRO3启动子序列的转录因子结合位点分析结果显示:CcFRO1基因启动子序列在克里曼丁橘和甜橙基因组中分别检测到289和272个转录因子结合位点,资阳香橙的CcFRO1启动子序列中转录结合位点和其他品种存在较大差异,ARR-B,BBR-BPC,BES1和TALE等转录结合位点只存在于资阳香橙CcFRO1基因上游调控序列中(图 4a). 而CcFRO3启动子序列进行转录因子结合位点分析发现,在Citrus clementina和Citrus sinesis基因组中分别检测到169和151个转录因子结合位点,在耐缺铁和敏感类型砧木品种间存在5个差异的结合位点,其中仅在耐缺铁砧木品种启动子序列存在转录因子E2F/DP,BBR-BPC和bZIP结合位点,在敏感型砧木品种启动子序列中存在转录因子GRAS和EIL结合位点(图 4b). 作为调控铁吸收关键转录因子FIT的结合位点E-box特征序列(5′-CANNTG-3′),在敏感类型品种中最多的存在2个,在耐缺铁品种中存在2~5个,其中资阳香橙CcFRO1启动子区存在E-box序列最多,为5个.
为进一步了解柑橘砧木CcFRO1和CcFRO3启动子序列和其耐缺铁特性的关系,用生物学软件MegAlign比较分析了所研究柑橘砧木的启动子序列. 结果(图 4c)显示,不同柑橘砧木的启动子序列存在较大的差异. CcFRO1启动子序列中第IV类枳柚的差异最大,有702 bp的缺失,在不同位置分别有45 bp和101 bp的插入;第II类的酸橘(SH)和兰卜莱檬(RL)也存在较大的差异,均有498 bp缺失;第III类的枳橙(CC)、枳(TO)和枳雀(ZQ)在多个位置存在碱基的缺失和插入;第I类的汕头酸橘(SS)、莽山野柑(MY)、红橘(BL)、朱橘(EH)等砧木的序列同源性较高,不同砧木之间只有少数碱基的差异(资阳香橙CcFRO1启动子片段经多次扩增未能成功,图中未对其序列进行比对). CcFRO3启动子序列中差异最大的是第III类的枳橙(CC)、朱橘(EH)、土橘(CH)、枳(TO)、皱皮橘(VH)和第IV类的枸头橙(AL),分别缺失了826 bp和822 bp,并且这6个品种的pFRO3序列同源性较高;其次第IV类的枳柚(ZY)和枳雀(ZQ)的差异较大,在多个位置存在几十个碱基的缺失和插入,且枳雀(ZQ)和枳柚(ZY)的pFRO3序列同源性较高;汕头酸橘(SS)、酸橘(SH)、扁平橘(SW)、资阳香橙(ZX)和兴义大红袍(XD)之间的pFRO3序列同源性较高,都在同一位置缺失了16 bp的序列(图 4d).
-
构建各类型启动子控制GUS基因表达的植物表达载体,并获得相应T3代转基因拟南芥株系,组织化学染色结果显示:来源于不同砧木品种CcFRO1基因启动子表达特性存在很大差异,如来源于敏感型砧木莽山野柑的启动子信号很弱,而来源于酸橘的启动子在根、茎、叶中均有很强的信号,资阳香橙的启动子在根尖有很强的信号,来源于枳柚的启动子未见明显的组织化学染色. 但在铁充足和缺乏情况下,不同砧木品种的CcFRO1基因启动子的表达均未见明显差异.
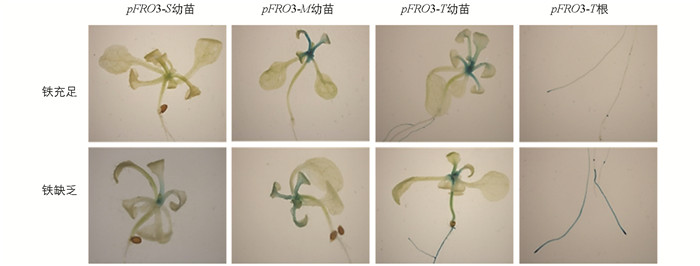
在铁充足条件下,来源于敏感型砧木品种的CcFRO3基因启动子在根和地上组织器官中无明显的蓝色,来源于耐缺铁砧木品种CcFRO3基因启动子在根尖、侧根和地上部分生长中心和叶柄中呈现出强烈的蓝色,来源于中间型砧木品种CcFRO3基因启动子仅在地上部分生长中心和叶柄中有蓝色出现(图 5). 在缺铁条件下,敏感型和中间型品种启动子转基因植株在地上部分生长中心出现较淡的蓝色,而耐缺铁品种启动子转基因植株在整个根系、茎中出现很强的蓝色,特别是主根根冠、伸长区以及成熟区蓝色都加深,在地上部分生长中心蓝色较铁充足条件下变浅(图 5). 这些结果表明在缺铁条件下,来源于敏感型和中间型砧木品种的CcFRO3基因启动子表达活性变化较弱,耐缺铁砧木品种该基因启动子表达活性增强,有较强的缺铁诱导特性.
2.1. 缺铁胁迫对17种柑橘砧木品种生理特性的影响
2.1.1. 缺铁胁迫对17种柑橘砧木品种叶绿素质量分数和铁质量分数的影响
2.1.2. 缺铁胁迫对17种柑橘砧木品种根系FCR酶活性的影响
2.2. 柑橘中铁螯合还原酶同源基因CcFROs对缺铁胁迫的响应
2.3. CcFRO1和CcFRO3基因上游调控区序列特征及其转基因分析
2.3.1. CcFRO1和CcFRO3基因上游调控区序列聚类、motif和序列差异分析
2.3.2. CcFRO1和CcFRO3基因上游调控区序列的启动特性
-
AtFRO基因家族成员在植物各组织器官的金属离子稳态中起作用,其中AtFRO2基因编码缺铁诱导的铁螯合还原酶,负责还原根表面的三价铁,随后被还原的二价铁通过质膜的转运蛋白IRT1被运输至细胞内[4, 18]. 本文用拟南芥的8个AtFRO基因的氨基酸序列作为参考,检索和克隆了柑橘的5个FRO同源基因. 根据CcFROs转录水平以及缺铁诱导特性,表明CcFRO1,CcFRO2和CcFRO3基因能够响应柑橘砧木缺铁胁迫. 根据与拟南芥的AtFROs基因亲缘关系推测,CcFRO1参与柑橘砧木叶绿体中的铁还原过程,CcFRO2参与种子中的铁还原过程,CcFRO3负责根部的铁还原过程,CcFRO4和CcFRO5则可能在维持细胞内金属离子的动态平衡中发挥重要作用,至于具体的作用和机制还有待进一步实验.
-
转录因子在植物响应非生物胁迫中发挥着重要作用. 其中bHLH类FIT转录因子调控双子叶植物铁吸收关键基因FRO2,IRT1等的表达,参与铁吸收过程. 在拟南芥中,AtFRO2的表达受转录因子FIT与AtbHLH38,AtbHLH39,AtbHLH100和AtbHLH101的共同调节[19-20]. 在本研究的柑橘砧木对铁响应的CcFRO1和CcFRO3启动子区存在多个bHLH结合位点和E-box特征序列(5′-CANNTG-3′),但是柑橘基因组中所预测的能结合CcFRO1和CcFRO3启动子的bHLH类转录因子中并没有包括同属于bHLH类的FIT转录因子. 这表明柑橘基因组中调控铁吸收的bHLH类转录因子可能不是FIT,而是其他bHLH类转录因子.
在耐缺铁柑橘砧木品种的CcFRO1和CcFRO3启动子区特异存在有E2F/DP,TALE,ARR-B,BBR-BPC,BES1,CAMTA和bZIP结合位点,其中E2F/DP和BBR-BPC在耐缺铁柑橘品种的CcFRO1和CcFRO3启动子序列中都存在. 这些转录因子参与调控细胞增殖[21]、分生组织形成[22]、以及CK[23],GA[24],BR[25]等激素信号和钙信号[26-27]的响应过程等. 暗示缺铁过程中,耐缺铁柑橘品种会调配激素信号来刺激或激活根发育相关转录因子的表达,从而提升植物根系吸收铁的能力. 而在敏感型品种中特异存在GRAS和EIL两个转录因子结合位点,EIL1与FIT直接作用保持FIT蛋白水平来参与乙烯对缺铁的响应过程[28],GRAS在植物根、茎顶端以及茎的顶端分生组织发育阶段中发挥作用[29],这时转录因子在敏感砧木中可能起负调控作用. 这些分析结果表明多个转录因子参与柑橘砧木缺铁响应过程,为下一步深入研究提供了重要的线索.




 下载:
下载: