-
开放科学(资源服务)标识码(OSID):

-
蚕桑业在中国古代丝绸之路中发挥了关键作用,也是“一带一路”建设的重要组成部分. 桑树(Morus L.)不仅是家蚕的独特食物来源[1],亦是抗干旱、盐碱及水涝的生态修复植物[2],其所含活性物质还是抗炎、降脂、降血糖类药物的主要成分[3-4]. 然而,桑树常受到桑青枯病、白粉病、桑枝枯菌核病等植物病害的威胁[5-6]. 其中,桑枝枯菌核病主要危害春季新萌发的桑叶及枝梢,造成桑芽、新梢基部形成褐色病斑,上部芽叶迅速失水导致桑枝折断,对桑叶产量影响巨大[7]. 桑枝枯菌核病最早发现于我国广东[8],之后在全国各地陆续出现,江苏省唯宁县1999年开始出现病情,至2002年桑园大面积发病,发病率高达80%~100%,桑叶因此减产50%[9]. 2011年该病在广西宜州市广泛流行,发病面积占全市桑树种植面积的28%左右,导致桑叶减产60%~90%[10]. 此外,蓝月丘[11]发现该病还会危害桑椹,造成桑椹膨大变白,内部产生大量黑色粉状物. 因此,研究桑枝枯菌核病对于提升桑叶和桑椹的产量和质量具有重要意义.
明确导致病害发生的病原微生物是桑枝枯菌核病防控的第一步. 目前针对桑枝枯菌核病病原菌尚无系统性的鉴定报道,仅有研究指出其病原菌来自核盘菌属(Sclerotinia sp.)[10],但该属的真菌包括核盘菌(S. sclerotiorum)[12]、三叶草核盘菌(S. trifoliorum)[13]、小核盘菌(S. minor)[14]以及雪腐核盘菌(S. nivalis)[15]等. 核盘菌属多数为植物病原真菌,不同种类之间差异较大[16]. 因此,进一步明确桑枝枯菌核病病原菌的种类尤为必要. 此外,了解病原菌的生物学特性有助于明确病害的发病条件及规律,从而能在培育桑树时创造不利于病原菌生存的环境条件,进而降低病害发生率. 目前,关于桑枝枯菌核病病原菌生物学特性的研究较少[17],且病原菌种间存在丰富的遗传多样性,不同来源的分离株之间的生物学特性和致病力也存在差异[18-19].
本研究从桑树发病组织内分离纯化获得病原菌,并验证其致病能力;通过形态学观察以及分子生物学手段明确其分类地位;最后对病原菌生长最适温度、pH值、碳氮源和培养基等基本生物学特性及其侵染过程进行研究,以期更全面地了解该菌发病条件,为桑枝枯菌核病的防治奠定基础.
全文HTML
-
马铃薯葡萄糖琼脂培养基(PDA)、燕麦培养基(OA)、麦芽浸粉培养基(MEA)、水培养基(WA)、察氏培养基(CZA)、察氏酵母培养基(CYA)、桑汁培养基(SA)、基础培养基(MM)[20].
-
发病桑树样品采集自广西河池市宜州区龙头乡龙田村池沟屯村头(24°26′N-108°8′E).
-
取发病桑树枝条用无菌水冲洗表面杂质,用滤纸吸干水分. 75%乙醇消毒5 min后,无菌水冲洗2~3次,吸干水分,切取患病组织置于PDA培养基,22 ℃培养,逐日观察,待组织长出菌丝后,通过菌丝尖端纯化法进行纯化培养[21],重复操作3次,最后将纯化获得的菌株进行斜面培养,置于4 ℃保存.
-
选取大小相似的桑叶,用75%乙醇消毒后,无菌水冲洗2~3次,晾干备用. 用6 mm打孔器获取菌饼,对叶片进行刺伤处理,将菌丝面朝下接种于桑叶上. 培养温度22 ℃,湿度大于90%,光照与黑暗交替12 h,培养36 h. 以无菌PDA培养基为对照,待叶片发病后,对病原菌进行重分离,重分离方法参照1.2.1. 致病性检测后,确定对编号为GXS1的病原菌开展后续研究.
-
将接种至PDA培养基的病原菌于22 ℃黑暗条件下分别培养2 d和10 d后,观察菌落形态并记录. 利用光学显微镜观察菌株的显微形态,记录其颜色、大小及形状.
-
刮取新鲜菌丝,加入装有20 μL DNA快速提取液PrepMan Ultra Sample Preparation Reagent(Applied Biosystems,USA) 的1.5 mL离心管中,涡旋30 s,100 ℃加热10~15 min,12 000 r/min离心3 min,吸取上清即得真菌总DNA. 以菌株GXS1基因组DNA为模板,以引物18S-F(5′-CCAGTAGTCATATGCTTGTCT-3′)和18S-R(5′-ACCTTGTTACGACTTTTACTTCC-3′)扩增18S rDNA序列;以引物ITS1(5′-TCCGTAGGTGAACCTTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)扩增ITS rDNA部分基因序列. PCR反应体系为:模板DNA 1.0 μL;上下游引物各1.0 μL;Taq酶(南京诺唯赞生物科技有限公司)12.5 μL;ddH2O 9.5 μL. PCR扩增程序为:95 ℃预变性5 min;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸15 s,进行30个循环;最后72 ℃延伸5 min. PCR产物送至生工生物工程(上海)股份有限公司进行Sanger测序.
将所得序列在NCBI数据库中进行BLAST比对,在Genbank数据库中下载同源序列,利用MUSCLE进行多序列比对,设置模型为p-distance,bootstrap设置为1 000,其余参数默认,采用邻接法(Neighbor-Joining Method)构建系统发育进化树.
-
取直径为6 mm的S. sclerotiorum GXS1菌饼接种至PDA培养基,置于温度分别为5 ℃,10 ℃,15 ℃,20 ℃,25 ℃,30 ℃,35 ℃,40 ℃的培养箱,黑暗条件下培养2 d. 每个处理设置3个重复,用十字交叉法记录菌落直径.
-
以PDA培养基为初始培养基,利用1 mol/L的HCl和NaOH调节其pH值分别至4,5,6,7,8,9,10,11. 取直径为6 mm的菌饼接种至不同pH值的培养基中,于22 ℃黑暗条件下培养2 d. 每个处理设置3个重复,用十字交叉法记录菌落直径.
-
分别以2%(m/v)葡萄糖、山梨醇、麦芽糖、蔗糖、淀粉、乳糖和果糖为碳源,加入基础培养基中,接种新鲜的菌饼,置于22 ℃黑暗培养2 d. 每个处理设置3个重复,用十字交叉法记录菌落直径.
-
分别以0.2%(m/v)硝酸钠、硝酸钾、甘氨酸、硫酸铵、尿素、酵母浸粉和蛋白胨为氮源,加入基础培养基中,接种新鲜的菌饼,置于22 ℃黑暗培养2 d. 每个处理设置3个重复,用十字交叉法记录菌落直径.
-
将直径为6 mm的菌饼分别接种至马铃薯葡萄糖琼脂培养基(PDA)、水培养基(WA)、察氏培养基(CZA)、察氏酵母培养基(CYA)、燕麦培养基(OA)、麦芽浸粉培养基(MEA)、桑汁培养基(SA),于22 ℃黑暗培养2 d. 每个处理设置3个重复,用十字交叉法记录菌落直径.
-
将S. sclerotiorum GXS1接种到100 mL马铃薯葡萄糖培养基(PDB)中,温度22 ℃,150 r/min旋转摇床培养5 d,收集菌丝. 用组织研磨仪将菌丝磨碎,用无菌水调OD600至2.0,制得菌丝悬浮液. 取桑叶,用75%酒精消毒5 min,然后用无菌水清洗2~3次,将上述菌丝悬浮液均匀喷洒到叶片上,保湿培养. 以喷洒无菌水的叶片作为对照,分别在6 h,12 h,24 h,48 h取样,加入适量FAA固定液固定24~48 h,之后用无菌水冲洗,将叶片剪成小叶段,在叶片各处均匀取样10个,加入2.5 g/mL水合氯醛透明24~48 h,棉蓝染色3 min后,无菌水洗去染液,进行镜检观察.
-
所有数据采用Excel 2016进行统计处理,用SPSS Statistics 21.0进行单因素方差Tukey分析,利用GraphPad Prism 8.0.2作图.
1.1. 材料
1.1.1. 培养基
1.1.2. 发病桑树样品
1.2. 方法
1.2.1. 菌株分离纯化
1.2.2. 菌株致病性检测
1.2.3. 菌株形态特征观察
1.2.4. 菌株分子生物学鉴定
1.2.5. S. sclerotiorum GXS1的生物学特性检测
1.2.5.1. 温度对菌丝生长的影响
1.2.5.2. pH值对菌丝生长的影响
1.2.5.3. 碳源对菌丝生长的影响
1.2.5.4. 氮源对菌丝生长的影响
1.2.5.5. 培养基对菌丝生长的影响
1.2.6. S. sclerotiorum GXS1对桑叶侵染过程的观察
1.2.7. 数据统计
-
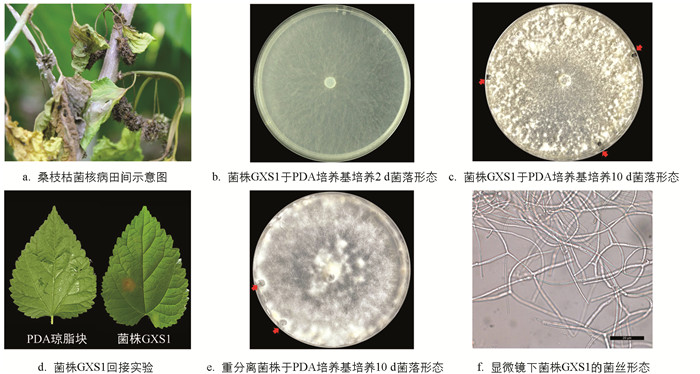
从发病桑树的枝叶分离病原菌(图 1a),共获得6株潜在病原菌(结果未显示),经ITS初步鉴定,核盘菌Sclerotinia sclerotiorum为优势种类. 将其中一株潜在病原菌菌株GXS1接种于PDA培养基,对其进行进一步观察,发现培养2 d后,菌丝铺满直径为9 cm的平板,生长初期气生菌丝较稀疏(图 1b);10 d后菌丝变得浓厚,培养基边缘出现菌丝纠结,形成菌丝团,菌丝团逐渐变大,颜色加深,表面出现小水珠,最后形成黑色、表面光滑、大小不一的菌核(图 1c). 将菌株GXS1回接桑叶36 h后,桑叶出现明显病症,其病斑呈褐色腐烂状,而对照组叶片状况良好(图 1d). 取发病部位重分离病原菌,均能得到菌丝呈白色且能产生黑色菌核的分离菌株(图 1e),与桑枝枯菌核病菌GXS1菌落形态一致,而对照组未得到类似菌株. 这说明桑枝枯菌核病病原菌GXS1具有导致桑树发病的能力. 利用显微镜进一步观察菌株GXS1,发现菌丝无色透明,有隔,未观察到分生孢子(图 1f).
-
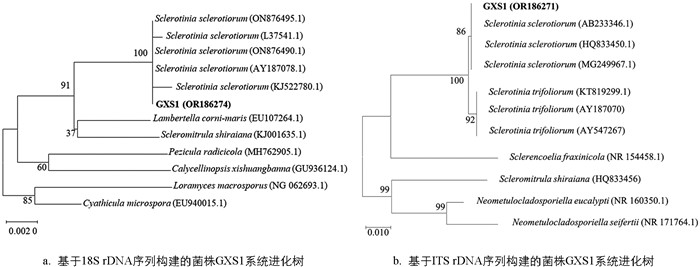
以GXS1菌株的基因组DNA为模板,扩增获得菌株的18S rDNA及ITS rDNA保守基因序列,片段长度分别为1 692 bp和511 bp,将序列提交至Genbank获得登录号OR186274和OR186271. 基于18S rDNA序列的BLAST比对结果显示,该菌与S. sclerotiorum相似度为100%,系统发育分析结果表明,菌株GXS1的18S序列与多株S. sclerotiorum聚为同一最小分枝(图 2a). 基于ITS rDNA序列的BLAST比对结果显示,该菌与S. sclerotiorum相似度为100%,系统发育分析结果显示,菌株GXS1与多株S. sclerotiorum聚为同一最小分枝,二者亲缘关系最近(图 2b). 因此,综合菌株的形态学和分子生物学特征,将GXS1菌株鉴定为核盘菌(Sclerotinia sclerotiorum),命名为S. sclerotiorum GXS1.
-
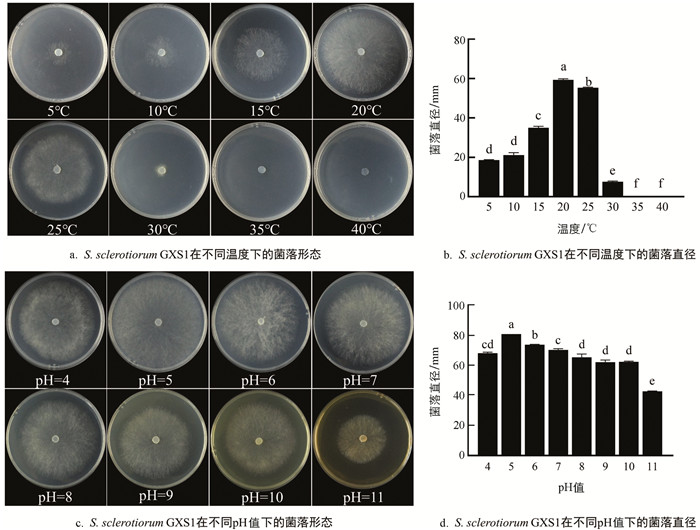
将S. sclerotiorum GXS1接种于PDA培养基,在不同温度条件下进行培养,结果发现S. sclerotiorum GXS1在5~30 ℃时均能生长,但菌落生长情况差异较大(图 3a和图 3b). 该菌在5 ℃低温下能够缓慢生长,随着温度的升高,菌丝生长速度逐渐加快,20 ℃时菌株生长速度最快,平均菌落直径可达59.3 mm. 当温度到达25 ℃时,菌丝生长开始受到抑制,菌落直径减少至55.3 mm,而高于或等于35 ℃时,S. sclerotiorum GXS1则完全停止生长. 因此,S. sclerotiorum GXS1最适生长温度为20 ℃,温度过高或过低均会抑制其生长.
在不同pH值条件下进行培养发现,S. sclerotiorum GXS1在pH值为4~11时均可生长,但菌落在不同pH值条件下生长速度存在差异(图 3c和图 3d). 当pH值为5时,菌株生长速度最快,菌落直径可达78.0 mm. 当pH值为4时,其生长开始受到抑制,菌丝变得致密,菌落直径为65.3 mm,此外,随着pH值的升高,菌丝生长速度逐渐变慢. 因此,S. sclerotiorum GXS1最适pH值为5,表明中性偏酸的条件更适合该菌生长,但过酸或者过碱条件下都不利于其生长.
-
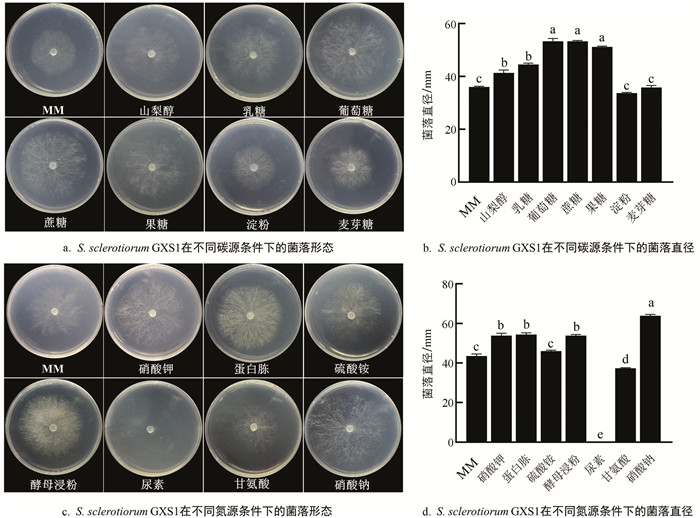
探究菌株碳氮源的利用情况发现,S. sclerotiorum GXS1在供试的7种碳源培养基上均能生长(图 4a和图 4b). 当以蔗糖、葡萄糖和果糖作为碳源时,菌株生长速度均较快,培养2 d后菌落直径分别为53.3 mm,53.3 mm和51.2 mm,三者之间无显著差异,其次为以乳糖和山梨醇为碳源时,平均菌落直径为44.5 mm和41.3 mm,而以淀粉和麦芽糖为碳源时,菌落直径与无碳对照组无明显差异(p>0.05). 因此,S. sclerotiorum GXS1菌株对葡萄糖、蔗糖和果糖的利用效果最好,但不能够利用淀粉和麦芽糖作为碳源.
在供试的7种氮源培养基中,除以尿素作为氮源的培养基外,S. sclerotiorum GXS1在其他氮源培养基上均能生长(图 4c和图 4d). 在以硝酸钠为氮源的培养基中菌丝生长速度最快,平均菌落直径为63.8 mm;其次为以蛋白胨、酵母浸粉和硝酸钾为氮源的培养基,平均直径为54.3 mm,53.8 mm和53.8 mm;以硝酸钾为氮源时菌丝较稀薄,而以蛋白胨或酵母浸粉为氮源时菌丝更致密. 然而,S. sclerotiorum GXS1以甘氨酸为唯一氮源时,平均菌落直径下降为37.3 mm,菌落直径小于对照组直径43.5 mm,表明甘氨酸会抑制菌落生长. 因此,S. sclerotiorum GXS1菌株对硝酸钠的利用效果最好,且其生长会受到甘氨酸和尿素的抑制.
-
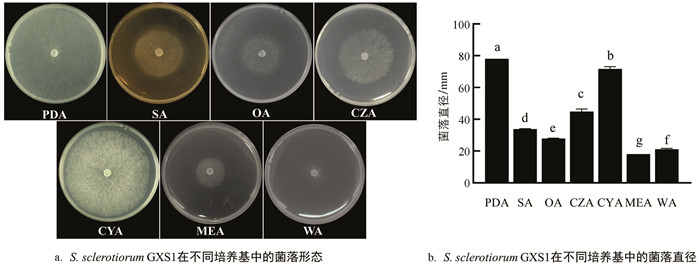
探究不同培养基对菌株生长情况的影响发现,S. sclerotiorum GXS1在供试的7种培养基上生长时,菌落边缘规则,生长速度存在明显差异(图 5a和图 5b). S. sclerotiorum GXS1在PDA培养基上生长速度最快,且菌丝致密,2 d后菌落长满整个平板,平均菌落直径为78.0 mm;其次为CYA培养基,培养2 d后,菌丝浓厚、气生菌丝发达,菌落直径为71.7 mm;而其在CZA,SA,OA,MEA和WA培养基上生长较慢. 因此,S. sclerotiorum GXS1的最适培养基为PDA.
-
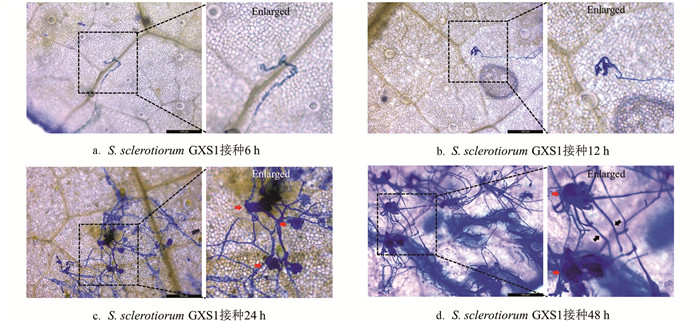
采用S. sclerotiorum GXS1菌丝悬浮液接种离体桑叶,分别在不同时间取样,观察菌株侵染桑叶的过程. 结果发现:在桑叶表面接种6 h后,S. sclerotiorum GXS1以菌丝的形态附着在叶片表面(图 6a);接种12 h后,S. sclerotiorum GXS1的菌丝开始扭曲分叉,形成侵染垫结构(图 6b);接种24 h后(图 6c),S. sclerotiorum GXS1在叶表形成密集的网状结构,可见多个清晰的球状侵染垫结构;接种48 h后,侵染垫延伸出菌丝,菌丝向周围细胞蔓延、扩散(图 6d).
2.1. 桑枝枯菌核病病原菌的分离及形态特征
2.2. 桑枝枯菌核病原菌的分子生物学鉴定
2.3. 温度和pH值对S. sclerotiorum GXS1生长的影响
2.4. 碳氮源对S. sclerotiorum GXS1生长的影响
2.5. 培养基对S. sclerotiorum GXS1生长的影响
2.6. S. sclerotiorum GXS1对桑叶的侵染过程
-
明确植物病害的病原菌种类是制定综合防治方法的前提,近年来陆续有核盘菌从不同菌核病寄主中被分离鉴定出来,如花生[22]、马铃薯[23]、花菜[24]、茄子[25]等. 核盘菌是一种全球分布的植物病原真菌[12],可危害600多种植物,常侵染植物的叶、茎以及果实等组织,进而造成严重的经济损失[26]. 本研究对引起桑枝枯菌核病的病原菌进行了系统性鉴定,并通过回接桑叶验证其致病性,确认导致桑枝枯菌核病的病原菌为核盘菌Sclerotinia sclerotiorum.
环境条件是病害流行的重要因素,植物的种植环境会影响病原菌生长,从而间接影响病害发生[27-28],如pH值、温度、水分和养分等环境因素. 因此,阐明病原菌的生物学特性对确定合适的管理策略具有重要意义. 有研究表明,大部分核盘菌的最适生长温度为20~25 ℃[29-30],说明较低的温度更适合核盘菌的生长. 本研究表明,S. sclerotiorum GXS1在5~30 ℃均能生长,最适生长温度为20 ℃,在30 ℃到40 ℃之间受到明显抑制,这与Prova等[31]的研究结果一致. 研究还发现S. sclerotiorum GXS1在5 ℃的低温下也能生长,这与春季土壤温度较低时病情蔓延情况相符. 环境的pH值对核盘菌的发育和毒力至关重要[32]. 本研究发现S. sclerotiorum GXS1在pH值为4~11时均能生长,说明该菌株对环境pH值的适应能力较强,但其更适宜在酸性条件下生长,在pH值为5时菌丝生长速度最快,这与不同地区、不同寄主中分离出的核盘菌一致[33-34]. 除了温度和pH值等环境因素的影响,碳氮源及培养基的种类也对病原菌的生长有影响. 碳氮化合物是病原真菌在宿主体内生存所必需的,它们能为真菌合成细胞组分提供所需的碳氮源[35]. 王丹等[36]发现人参核盘菌最适碳源为蔗糖或葡萄糖,最适氮源为蛋白胨、牛肉膏或酵母浸粉,最适培养基为SDA;周洁等[29]发现明日叶核盘菌的最适碳源是果糖、葡萄糖以及蔗糖,最适氮源是酵母提取物;杨顺超等[33]发现菊花核盘菌对果糖和蛋白胨的利用率最高,最适培养基为酵母浸出粉胨葡萄糖培养基(YEPD). 本研究中,S. sclerotiorum GXS1可以利用多种碳氮化合物,以葡萄糖、蔗糖或果糖为碳源,硝酸钠为氮源时对菌株生长最有利,最适培养基为PDA,葡萄糖和蔗糖这类简单的碳水化合物可以被核盘菌利用并转化为草酸盐,这有利于核盘菌的生长,且能增强其致病能力[35]. 本研究表明该菌能够同化利用不同的碳氮源,从而促进病原菌在宿主中的生长,但尿素对菌株有明显抑制作用,表明其具有防控该病害的潜力,但具体作用机制仍需进一步探究.
植物病原真菌在入侵植物时,常常会形成特殊的侵染结构[37-38],这些结构在病原菌穿透植物表皮时发挥着重要作用,具体过程与寄主和菌株有关[39-40]. 核盘菌能够利用植物表面营养帮助自身发育,形成侵染垫,从而破坏植物表面角质层,侵染垫进一步分化出菌丝入侵到植物内部,抑制植物防御杀死细胞[26]. 孙明明等[41]发现大豆核盘菌在侵染大豆叶片和茎秆的过程中,菌丝形成分枝,最终在尖端形成椭圆形的“侵染胞”结构,菌丝通过气孔或直接入侵植物组织. 本研究在S. sclerotiorum GXS1侵染桑树叶片的过程中发现,接种6 h后,叶面观察到菌丝,未出现结构改变;接种12 h后,菌丝开始扭曲膨胀,出现分叉,这与Liang等[26]的报道一致;接种24 h后,可以观察到密集的菌丝网,菌丝尖端膨大形成多个球状的侵染垫;接种48 h后,侵染垫分化出入侵菌丝,不断分支延伸,向周围细胞扩散. 本研究探究了S. sclerotiorum GXS1入侵桑树叶片的动态过程,发现该菌能够通过形成特殊的侵染结构入侵桑树叶片,帮助自身侵染植物细胞,这为进一步探究病原菌的侵染过程和致病机制奠定了基础.
-
本研究通过分离纯化获得一株桑枝枯菌核病病原菌GXS1,根据菌株形态特征、ITS和18S保守序列分析,将该菌株鉴定为Sclerotinia sclerotiorum,回接实验证实S. sclerotiorum GXS1能够导致桑叶发病. S. sclerotiorum GXS1的生物学特性研究结果表明,其生长最适温度为20 ℃,最适pH值为5,最适碳源为葡萄糖、蔗糖或果糖,最适氮源为硝酸钠,最适培养基为PDA. 桑叶侵染过程显示,S. sclerotiorum GXS1接种桑叶后会形成侵染垫结构,再分支产生菌丝入侵桑叶.



 下载:
下载: