-
贝母属于百合科多年生草本植物,是一种药食同源植物.主要药用或食用部位是贝母鳞茎,其性苦、甘、微寒,归肺、心经,具有镇咳、祛痰、平喘、镇静、镇痛、抗心血管病、抗溃疡、抗血小板聚集、抗肿瘤等功效[1-2].依据产地的不同,贝母可以分为川贝母、浙贝母、土贝母、伊贝母[3].太白贝母(Fritillaria taipaiensis P. Y. Li)是川贝母入药的重要基源之一[4],其又名太贝、尖贝、秦贝.大量研究表明太白贝母化学成分、植物形态和药理作用与野生川贝母没有明显差异,同时太白贝母栽培技术已经较为成熟、且产量大,适宜低海拔栽培,尤其有分析认为重庆太白贝母栽培历史悠久、产业基础较好,通过整合市场、技术、资金及政策资源,未来重庆可能建成全国最大的太白贝母生产基地,太白贝母也可能发展成为川贝母的主流品[5],有替代川贝母入药的巨大商品经济价值.多糖作为近年来研究的热点之一,大量研究表明植物多糖具有抗衰老等多种生物学功效,而且对机体几乎没有毒性,故对其生物学功效的研究愈来愈引起人们的重视[6-7].目前国内外关于贝母多糖相关的研究较多,主要集中在川贝母[8-9]、平贝母[10]、浙贝母[11]多糖含量及药理活性,以及平贝母多糖单糖组成分析及活性研究方面[12-13],但关于太白贝母多糖的相关研究甚少,且主要集中在太白贝母多糖提取纯化工艺,以及抗氧化活性研究等方面[14-15].总体来讲仍然处于起步阶段,许多方面需要加强研究,尤其是太白贝母多糖相对分子量和结构表征等方面研究尚不足.本研究着重研究太白贝母多糖的相对分子质量、多糖的单糖组成类型以及结构表征,为进一步开发利用太白贝母多糖药用及食用价值提供理论参考.
全文HTML
-
太白贝母样品购自四川成都荷花池中药材市场,其呈类圆锥形或近球形,呈“怀中抱月”之势,先端钝圆或稍尖.经过鉴定为百合科(Liliaceae)贝母属太白贝母(Fritillaria taipaiensis P. Y. Li)的干燥鳞茎.
乙醇、盐酸、甲醇、硫酸、氯仿、磷酸、冰醋酸,重庆川东化工集团有限公司;丙酮,重庆市科龙化工试剂厂;正丁醇、BaCO3、吡啶、六甲基二硅烷、苯胺、三甲基氯硅烷、无水葡萄糖,成都市科龙化工试剂厂;氢氧化钠,四川西陇化工有限公司;二苯胺,天津市凯通化学试剂有限公司;蒽酮,中国试剂网-上海市宁波路54号;NaCl,天津市鼎盛鑫化工有限公司;3500道尔顿的透析袋(截留分子量14 000),北京经科宏达生物技术有限公司;AB-8型号大孔吸附树脂,东鸿化工有限公司;DEAE纤维素,上海金穗生物科技有限公司;标准单糖:D(+)-半乳糖(质量分数≥98,CAS号59-23-4)、D(+)-无水葡萄糖(质量分数≥98%,CAS号50-99-7)、鼠李糖(质量分数≥98%,CAS号6155-35-7)、D(+)-木糖(质量分数≥98%,CAS号58-86-6)、D(+)-甘露糖(质量分数≥98%,CAS号3458-28-4),北京索莱宝科技有限公司;分子量分别为T-500,T-70,T-40,T-10标准葡聚糖、蓝色葡聚糖(平均分子量2×106)、葡聚糖凝胶G-100,美国Pharmacia公司.
722型可见分光光度计,上海欣茂仪器有限公司;FA1004型电子天平,上海舜宇恒平科学仪器有限公司;EL104电子天平,梅特勒-托利多仪器上海有限公司;薄层硅胶板,青岛海洋化工厂分厂;HH.S精密恒温水浴锅,江苏金坛市医疗仪器厂;ZWY-110X30往复式水浴恒温摇床,上海智城分析仪器有限公司;LC-4010低速离心机,安徽中科中佳科学仪器有限公司;TG16-WS高速离心机,长沙湘仪离心机仪器有限公司;FW80型高速试样粉碎机,河北新兴电器厂;ZXFD-B5250十段编程鼓风干燥箱,上海智城分析仪器制造有限公司;RE-3000A旋转蒸发仪,上海亚荣生化仪器厂;GDYQ-701S超声波清洗器,长春吉大小天鹅仪器有限公司;AIphal1-2 LDplus真空冷冻干燥机,德国Christ公司;7890A-5975C型GC-MS仪,美国Agilent公司;TENSOR 27傅里叶红外光谱仪,德国布鲁克公司.
-
将贝母干燥品粉碎,并过60目筛(0.280 mm)保存于干燥器备用,参见姜峻等[16]报道的方法进行贝母粗多糖提取.准确称取60.0 g贝母样品(粉末)于1 000 mL圆底烧瓶中,加入250 mL石油醚回流提取1 h,加入250 mL无水乙醇回流提取2 h.将有机溶剂挥干,得固体样渣.之后在固体样渣中加入250 mL蒸馏水90 ℃水浴提取1 h,之后取上清液.该水浴操作提取重复3次,合并上清液,浓缩至原来样液体积的1/3.之后加入4倍体积的冷乙醇,4 ℃醇沉24 h.醇沉过后以4 000 r/min离心5 min,得粗多糖沉淀.加300 mL蒸馏水复溶,加入1倍体积Sevage试剂(V氯仿:V正丁醇=5:1)震荡15 min,之后以4 000 r/min离心6 min,取上层多糖水溶液.上述步骤重复3次,合并多糖水溶液,加入4倍体积冷的无水乙醇,4 ℃醇沉12 h,得粗多糖沉淀.蒸馏水定容40 mL,分装在多个1.5 mL的离心管中冷冻干燥,得固体粗多糖干燥样品,备用.
-
称取3.0 g AB-8型号大孔吸附树脂,用蒸馏水充分清洗以去除表面杂质,再用25 mL 95%无水乙醇浸泡24 h,使树脂充分溶胀.之后弃去乙醇,用蒸馏水洗涤至无味,加20 mL 4%的HCl溶液浸泡3 h,用蒸馏水洗涤至中性.再用20 mL 4%的NaOH溶液浸泡3 h之后,用蒸馏水洗涤至中性,最后加20 mL蒸馏水浸泡,保存4 ℃备用[17].准确称取100 mg太白贝母固体粗多糖干燥样品溶于10 mL双蒸水中过夜溶胀,将粗多糖溶液经大孔吸附树脂震荡摇床24 h后,4 000 r/min离心6 min去除大孔树脂得初步纯化的多糖溶液(Ⅰ).
-
透析袋预处理:用蒸馏水煮沸5 min后,用60 ℃蒸馏水洗冲2 min,置4 ℃蒸馏水中待用[18].将大孔树脂吸附纯化后的太白贝母多糖溶液(Ⅰ)放入截留分子量为3 500 Da的透析袋中,透析48 h,透析过后在多糖溶液中加入95%乙醇,使乙醇浓度达到80%,得到白色絮状沉淀,4 ℃过夜,4 000 r/min离心6 min后真空干燥沉淀,得到多糖半纯产品(Ⅱ).
-
DEAE弱碱性阴离子交换纤维预处理:取25 g DEAE加入500 mL水,浸泡24 h,使纤维素颗粒充分膨胀,去除悬浮的细颗粒.其后再加入4倍量的0.50 mol/L HCl浸泡搅拌4 h,滤去酸液,水洗至中性.再加入4倍量的0.50 mol/L NaOH浸泡搅拌4 h,滤去碱液,水洗至中性.如此反复轮洗,直至洗出液无色澄清为止,脱气,备用[19].
采用DEAE柱层析(2.5×30 cm),对经过透析袋透析过的贝母多糖半纯产品(Ⅱ)进行分离纯化,首先用250 mL蒸馏水进行洗脱,之后用0.05,0.10,0.25,0.50,1.00 mol/L NaCl(各50 mL)依次进行洗脱后,每7 mL收集1次.用蒽酮硫酸方法跟踪[20],按照洗脱峰情况进行收集,透析、冻干,得贝母纯化多糖(Ⅲ).
-
采用葡聚糖凝胶SephadexG-100湿法装柱,层析柱规格为30×2.0 cm,纯水平衡12 h,洗脱液采用蒸馏水,洗脱速度0.5 mL/min.各标准葡聚糖和蓝色葡聚糖(Dextran blue 2×106)上样量均为每4 mL含5 mg标准品溶液.首先用蓝色葡聚糖测得洗脱体积为Vo,然后用型号T-500,T-70,T-40,T-10标准葡聚糖相继上柱,分管收集洗脱液,每管1.5 mL,蒽酮比色法跟踪检测,根据吸光度测定洗脱体积Ve.以Ve/Vo为纵坐标,相对分子量的自然对数为横坐标,绘制标准曲线.同样洗脱条件下,取每4 mL含5 mg贝母纯化多糖(Ⅲ)水溶液上柱,测定各自的洗脱体积Ve′,结合标准曲线和Ve/Vo值计算出相应的分子量[21].
-
称取20 mg太白贝母多糖样品于具塞试管中,加入6 mL 0.2 mol/L H2SO4,110 ℃水解10 h,冷却室温,BaCO3中和,离心去除沉淀,取上清,冷冻干燥得多糖水解物,供薄层和质谱分析待用[22].薄层和质谱分析目的为相互应证结果.单糖标准品包括:D(+)-半乳糖、D(+)-无水葡萄糖、鼠李糖、D(+)-木糖、D(+)-甘露糖.
-
将多糖样品水解物,标准单糖D(+)-半乳糖、D(+)-无水葡萄糖、鼠李糖、D(+)-木糖、D(+)-甘露糖各3 mg,以0.6 mL吡啶溶解,加六甲基二硅胺烷0.4 mL和三甲基氯硅烷0.2 mL,于60 ℃烘箱中放置10 min,离心去除沉淀,进样[22].
GC-MS进样条件(Agilent 7890A-5975C型号仪器)参照段红波等[23]方法:色谱条件DB-35MS型毛细管柱(30 m×250 μm,0.15μm,安捷伦);程序升温:炉温初始温度为150 ℃保持1 min,之后以6 ℃/min升温至190 ℃,之后再以15 ℃/min升温至260 ℃程序升温,保持3 min;载气氦气(纯度99.999%),载气流速1 mL/min;进样量1 μL,进样口温度250 ℃,分流比10:1.质谱条件:EI离子源,离子源温度230 ℃,传输线温度250 ℃,质量扫描范围m/z:20~550;检测器温度260 ℃.
-
展开剂参见杨成等[24]配置方式,苯胺-二苯胺显色剂参见李群等[25]专利配置方式,及张真庆等[26]文献方式进行溶解.展开显色:薄层板(100 mm×100 mm规格),点样样品和标品浓度为2 mg/mL,按照一定顺序毛细管点样到薄层板上风干后,重复点样3~4次,每个样间隔15 mm,起始点样高度10 mm.点样后薄层板放入已预先饱和30 min的双槽层析缸中展开,展开距离8 cm,取出吹干,喷显色剂苯胺-二苯胺显色后,自然风干,85±2 ℃加热显色至斑点清晰,约7±2 min(展开时间约为1.6 h) [27-28].
-
取1.2.4中得到的贝母纯化多糖(Ⅲ)干燥样品1 mg,与干燥的溴化钾(KBr)粉末于玛瑙钵中轻轻研磨均匀,经压片机压成薄片后即可上机测定.检测器分辨率:4 cm-1;扫描次数:64;测试范围:4 000~400 cm-1[29].
-
Microsoft Excel软件及SPSS 22.0软件对实验数据进行分析,结果取3次平行实验的平均值,通过Origin 7.5软件进行制图分析.
1.1. 材料与仪器
1.2. 实验方法
1.2.1. 太白贝母样品预处理以及粗多糖的提取
1.2.2. 太白贝母粗多糖的大孔吸附树脂纯化
1.2.3. 太白贝母粗多糖透析纯化处理
1.2.4. DEAE(二乙基氨基乙基)弱碱性阴离子交换纤维柱层析分离纯化
1.2.5. 太白贝母多糖相对分子量的测定
1.2.6. 太白贝母多糖中单糖种类分析
1.2.6.1. GC-MS分析
1.2.6.2. 硅胶薄层分析
1.2.7. 太白贝母多糖傅里叶红外光谱分析
1.3. 数据统计分析
-
太白贝母多糖经过大孔吸附树脂纯化后得率约为60%,经过透析处理后多糖得率约为3.0%.太白贝母多糖DEAE弱碱性阴离子交换纤维柱层析纯化结果如图 1.太白贝母多糖先后采用蒸馏水和不同浓度梯度NaCl溶液(0.05~1.0 mol/L)经过DEAE纤维素柱纯化洗脱后,得到至少3个分离的洗脱峰,3-20管和21-28管均为蒸馏水洗脱产物;29-53管为NaCl溶液洗脱产物.但是总体比较峰分离效果不明显,表明多糖级分之间相对分子质量没有数量级差异.也可能受到NaCl洗脱溶液洗脱体积偏少,每管收集体积偏多的影响[30].经过对太白贝母蒸馏水和NaCl洗脱多糖含量进行吸光度测定比对,显示NaCl洗脱产物含糖量较高,所以本实验主要对NaCl溶液洗脱产物进行进一步纯化.而已经报道的平贝母多糖DEAE纤维素柱纯化洗脱结果显示,平贝母多糖蒸馏水洗脱量最多[12],这可能是由于不同的太白贝母与平贝母具有不同性质的多糖.
-
不同相对分子量葡聚糖标准品,经过葡聚糖凝胶G-100层析柱洗脱得出的标准曲线为y=-6.880 1x(Ve/Vo)+12.979,相关系数为R2=0.936 8(图 2).经过DEAE弱碱性阴离子交换纤维柱层析纯化的太白贝母多糖经过葡聚糖凝胶G-100层析柱洗脱,Ve/Vo的比值为1.07,由此推算,太白贝母多糖的相对分子量约为2×106.
-
薄层层析结果显示(图 3和表 1),标准品的迁移率在0.38~0.58范围之内,太白贝母多糖水解物的Rf值为0.39,与D(+)-半乳糖的Rf值(0.38)迁移率接近,并且显色颜色接近一致(均为蓝色),可见薄层色谱结果显示太白贝母多糖的单糖成分可能为D(+)-半乳糖.硅胶薄层层析分析结果和GC-MS分析结果一致,再次验证了贝母多糖的组成类型主要为D(+)-半乳糖.与平贝母多糖组成比较(由木糖组成,同时含有少量葡萄糖和半乳糖组成),太白贝母多糖不属于杂多糖[12].
-
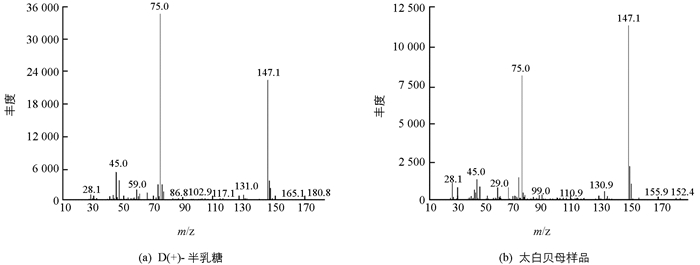
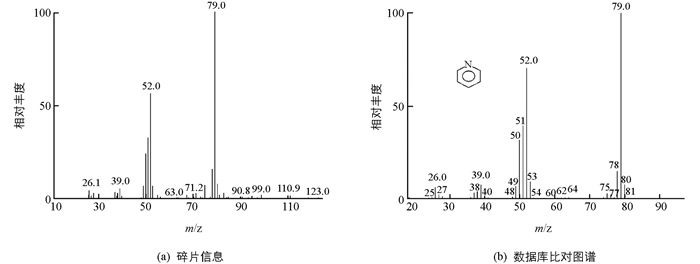
通过GC-MS对于单糖标准品和样品水解物的分析(图 4和表 2),可以看出太白贝母GC-MS出峰时间(1.522 min)与D(+)-半乳糖出峰时间接近(1.520 min),并且主要m/z碎片信息接近为147.1和75.0.太白贝母样品GC-MS主要m/z碎片信息与鼠李糖、D(+)-木糖、D(+)-甘露糖也较为类似,但是出峰时间不是很接近.由此可以看出太白贝母多糖的主要组成成分为D(+)-半乳糖.此外1.580~1.628 min出峰时间,依据碎片信息为79.0和52.0等以及与美国化学协会标准化合物数据库比对(图 5),该碎片信息主要是由吡啶溶剂引起.
-
太白贝母纯化后对多糖进行红外光谱特性分析,图 6显示特征谱带分别在3 442,2 256,2 129,1 654,1 050,1 027,1 003,827,765,632 cm-1 ,且具有明显的多糖特征谱带.太白贝母多糖红外光谱在3 600~3 200 cm-1 (3 442 cm-1 )出现一宽峰,表明多糖存在分子间、分子内氢键,存在着O—H的伸缩振动[31].呋喃糖在1 100~1 010 cm-1 之间会出现有2个较强吸收峰,吡喃糖在1 100~1 010 cm-1 之间会有3个强吸收峰[32].由光谱图 6可知,在1 100~1 010 cm-1之间有3个强吸收峰(1 050 cm-1 ,1 027 cm-1 ,1 003 cm-1 ).徐也等[33]报道在1 100~1 010 cm-1之间有3个强吸收峰(1 103 cm-1 ,1 049 cm-1 和1 016 cm-1 ),此为吡喃糖苷的特征吸收峰,这说明太白贝母多糖属于吡喃糖. 1 078 cm-1附近出现的峰是常见的吡喃糖环内酯和羟基吸收产生的吸收峰,是由于糖环上C—O—O醚键的不对称伸缩振动,构成了糖类的特征吸收峰,也是葡聚糖典型的红外光谱信号[34].在1 000 cm-1以下的区域称为指纹区,此区的光谱更为繁琐,可用于整体分子特征的研究分析.光谱图 6在827 cm-1 处有吸收峰,而在890 cm-1 处无吸收峰(吡喃糖苷特征吸收峰)[35],说明太白贝母多糖是以α-型糖苷键链接[36]. 765 cm-1为吡喃环的对称环伸缩振动[37].
2.1. 太白贝母多糖纯化
2.2. 太白贝母多糖分子量的测定
2.3. 太白贝母多糖中单糖种类分析
2.3.1. 硅胶薄层层析分析结果
2.3.2. GC-MS分析结果
2.4. 太白贝母多糖傅里叶红外光谱分析
-
本实验通过对太白贝母多糖的提取以纯化后,测定太白贝母多糖的相对分子量以及多糖中单糖的结构特点分析,结果显示太白贝母NaCl洗脱的多糖相对分子质量为2×106.单糖组成类型相对较为单一,主要的单糖类型是D(+)-半乳糖,并且是属于α-型吡喃糖.




 下载:
下载: