-
茉莉酸甲酯(methyl jasmonate,MJ)是茉莉酸(jasmonate,JA)的一种挥发性甲酯衍生物,植物在受到环境胁迫时,可作为信号转导分子激发植物防御基因的表达,从而诱导植物的化学防御[1-2].伤害胁迫下,膜脂过氧化加剧[3],MDA含量提高,SOD,POD,CAT等膜保护酶活性增加,提高植物的抗逆性[4].已有研究表明外源性茉莉酸类化合物能刺激植物次生代谢物合成[5-6],使植物次生代谢产物迅速积累[5],且作用广泛,可诱导萜类、黄酮类、生物碱类化合物的积累.
颠茄Atropa belladonna L.为茄科颠茄属多年生草本植物,俗称野山茄、颠茄草.颠茄原产于欧洲和亚洲西部,我国北京、上海、山东、浙江、河南等地均有种植[7-8].其药效成分主要为托品烷类生物碱(Tropane alkaloids,TAs),包括阿托品、莨菪碱和东莨菪碱,有抗胆碱能神经传导或副交感神经阻滞作用,可用于镇静、麻醉、止痛、镇痉、减少腺体如涎腺和汗腺分泌以及扩大瞳孔[9].多项研究表明通过添加外源茉莉酸甲酯可诱导药用植物毛状根中的有效成分含量提高. Yukimune等[10]研究表明外加100 μmol/L茉莉酸甲酯于WPM培养基能明显提高紫杉醇的含量.孙际薇等[11]发现接种18 d后用200 μmol/L茉莉酸甲酯诱导处理3 d可以促进曼陀罗毛状根中东莨菪碱含量提高. Ketchum等[12]也发现在接种8 d后添加100 μmol/L茉莉酸甲酯能显著提高紫杉醇和紫杉烷类化合物的产量.本实验通过添加外源茉莉酸甲酯,研究了颠茄毛状根中莨菪碱和东莨菪碱含量的变化及对毛状根生长生理特性的影响.
HTML
-
颠茄毛状根由西南大学生命科学学院天然产物与代谢工程实验室保存.继代培养采用B5液体培养基,无激素悬浮培养.试验材料为0.5 g鲜根,150 mL液体培养基,25 ℃,110 r/min,黑暗下悬浮培养.向B5液体培养基中添加终浓度分别为10,20,30,40 μmol/L的MJ进行诱导处理,12 d后收获用于相关指标测定.
-
培养12 d之后,用蒸馏水冲洗去毛状根上的残留液体培养基,并用吸水纸吸干水分后进行毛状根的鲜质量测定.并按如下公式计算毛状根培养物的鲜质量增殖倍数(n),
式中m1表示接种鲜质量(g),m2表示收获鲜质量(g).
-
根据Giannopolitis等[13]的方法测定超氧化物歧化酶(SOD)活性;过氧化氢酶(CAT)活性的测定根据Aebi[14]的方法;过氧化物酶(POD)活性的测定按张志良等[15]的方法进行.
-
依据Zarate等[18]的提取方法,稍有改动:颠茄毛状根在60 ℃下充分烘干,研磨成粉后过50目筛;称取0.1 g干粉,提取液为10 mL CHCl3-MeOH-NH4OH(15:5:1),超声提取30 min,25 ℃左右室温中放置过夜(10 h),滤纸真空抽滤,用2 mL CHCl3冲洗2遍,合并滤液后40 ℃真空浓缩至干,残留物用5 mL CHCl3和2 mL 1 mol/L H2SO4溶解,静置分层后收集硫酸相于冰浴中用浓氨水调pH值至10,再2次加入2 mL CHCl3提取;静置分层后收集氯仿层,于40 ℃真空浓缩至干,用1 mL MeOH超声溶解,为样品液;样品液0.22 μm滤膜过滤,-4 ℃保存备用.
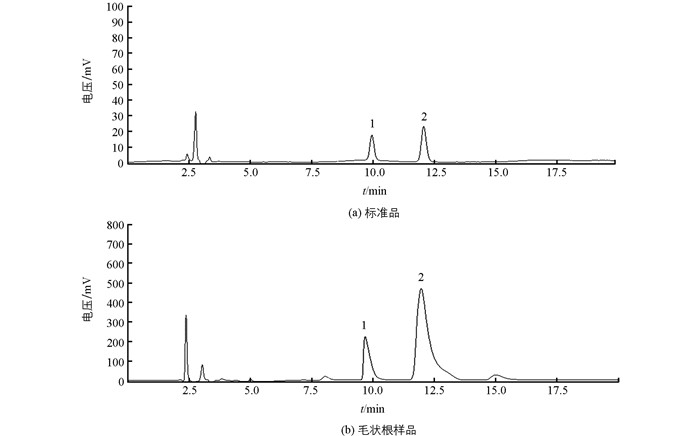
日本岛津(Shimadzu)LC-60A高效液相色谱仪;色谱条件:色谱柱Ultimate XB-C18液相色谱柱(5 μm,4.6×250 mm);流动相甲醇:醋酸缓冲液(0.05 mol/L醋酸铵,pH=4.6)=58:42,0.0025 mol/L SDS;流速1.0 mL/min;检测波长215 nm;柱温40 ℃;进样量:10 μL.分别精密称取莨菪碱和东莨菪碱标准品(Sigma),分别配制成质量浓度为100 μg/mL,200 μg/mL,300 μg/mL,400 μg/mL,500 μg/mL的标准品贮备液,按照上述的HPLC检测条件进行测定,根据峰面积(Y)对标准品浓度(X)绘制标准曲线,并分别计算出莨菪碱和东莨菪碱的线性回归方程.东莨菪碱和莨菪碱的标准峰图见图 1,东莨菪碱线性回归方程为Y=33 664.3X+1 411 221.6,R2=0.999 3;莨菪碱的线性回归方程为Y=9 930.4X+102 781,R2=0.999 0.
1.1. 材料
1.2. 测定方法
1.2.1. 颠茄毛状根鲜质量的测定
1.2.2. 生理指标测定
1.2.3. 颠茄毛状根中东莨菪碱、莨菪碱的提取与测定
-
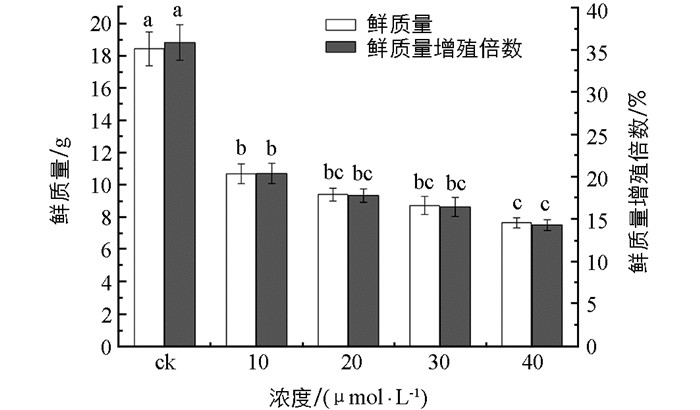
Kang等[19]的研究证明在培养基中添加MJ后显著抑制毛状根的生长,并引起毛状根褐化.培养基中MJ浓度为10 μmol/L的毛状根鲜质量为10.7 g,是对照的58%,添加40 μmol/L MJ的毛状根鲜质量为7.7 g,仅是对照的41.5%. 4个浓度的MJ处理组鲜质量增殖倍数分别为对照组的56.9%,49.6%,45.9%和39.9%(图 2).
-
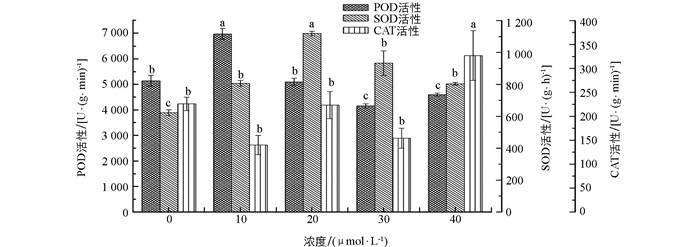
SOD,CAT和POD是细胞抵御活性氧伤害的重要保护酶系统,3种保护酶的协调作用能有效地清除O2-,OH-,H2O2-等自由基,防止膜脂过氧化,从而使细胞膜免受其伤害[20].经不同浓度MJ诱导处理后,颠茄毛状根中的SOD活性均显著高于对照组.其中20 μmol/L的MJ处理组SOD活性最高,达1 118.93 U/(g·h),为对照组的1.8倍. 40 μmol/L MJ处理组的CAT活性显著高于其他4组,为对照组的1.4倍. 10 μmol/L的MJ处理组POD活性显著高于对照组,为对照组的1.4倍.随处理浓度的增大,POD活性降低,30,40 μmol/L的MJ处理组POD活性显著低于对照组(图 3).
SOD是最重要的自由基清除酶,能催化O2-发生歧化反应,生成O2和H2O2,从而减轻O2-对植物的毒害作用.而H2O2在多种途径中可转化为O2-,将直接引发膜脂过氧化,CAT,POD和SOD的协同作用能清除细胞内的H2O2,减少活性氧或其他过氧化物自由基对细胞膜系统的伤害,从而保证细胞正常功能. SOD,POD在MJ浓度较低的处理组活性较高,而CAT在MJ浓度高的处理组活性较高,说明CAT对MJ的反应比SOD,POD迟钝.
-
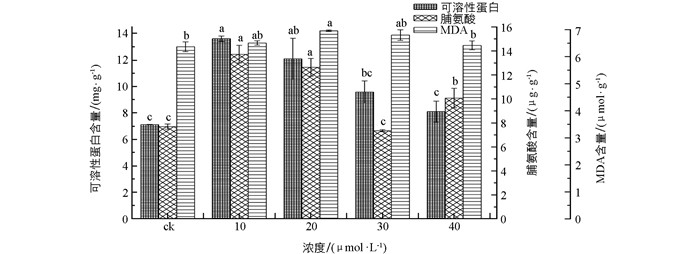
逆境胁迫下植物通过大量合成可溶性蛋白来提高植物抗性.经不同浓度的MJ处理后,低浓度时可溶性蛋白含量较高,高浓度处理后含量较低. 10 μmol/L的MJ处理组可溶性蛋白含量最高,为对照组的1.9倍,20,30 μmol/L的MJ处理组可溶性蛋白含量分别为对照组的1.6倍和1.3倍,40 μmol/L的MJ处理组与对照组的差异不具有统计学意义.
脯氨酸为最常见的渗透调节物质,主要以游离状态存在.植物在逆境胁迫下,脯氨酸含量的增加有助于保护植物免受外界胁迫伤害. 10,20 μmol/L的MJ处理组脯氨酸含量最高,显著高于对照组,其次为40 μmol/L的MJ处理组,30 μmol/L的MJ处理组脯氨酸含量与对照组的差异不具有统计学意义.
植物组织在逆境下遭受氧化胁迫时,常常会发生膜脂过氧化作用,MDA是其产物之一. MDA含量的高低反映了植物细胞膜过氧化作用的强弱与质膜的破坏程度.经MJ处理后颠茄毛状根中的MDA含量变化不明显,仅20 μmol/L的MJ处理组MDA含量显著高于对照组,其他三个处理组与对照组的差异不具有统计学意义(图 4).
-
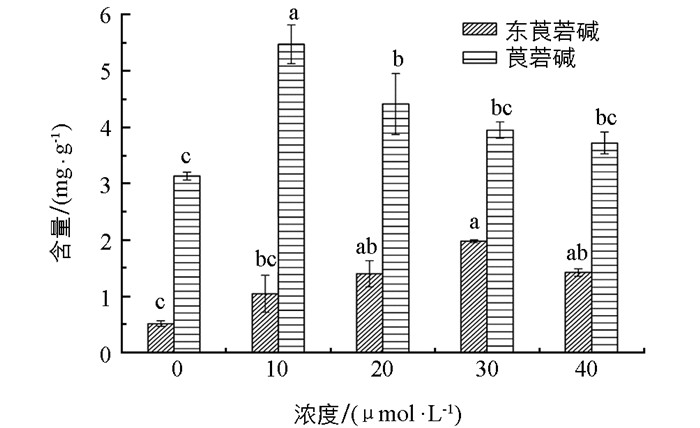
经MJ处理12 d后,颠茄毛状根中的东莨菪碱、莨菪碱含量均显著提高,东莨菪碱含量提高较明显. 30 μmol/L的MJ处理组东莨菪碱含量为对照组的3.8倍,20,40 μmol/L的MJ处理组东莨菪碱含量分别达到对照组的2.7倍和2.8倍. 10 μmol/L的MJ处理组莨菪碱含量提高最显著,为对照组的1.7倍.其次为20 μmol/L的MJ处理组,莨菪碱含量为对照组的1.4倍. 30,40 μmol/L的MJ处理组莨菪碱含量变化不显著(图 5).各处理组单瓶生物碱产量为
式中y表示生物碱产量(mg),c表示生物碱含量(mg/g),m表示每瓶毛状根的干质量(g).
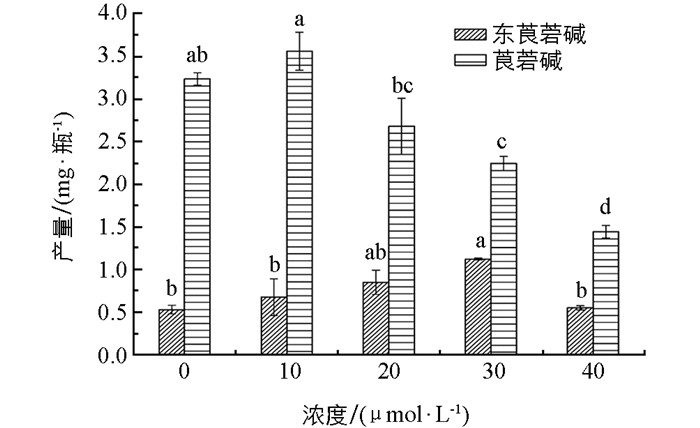
各处理组单瓶生物碱产量与含量相比稍有变化. 30 μmol/L的MJ处理组单瓶东莨菪碱产量仍为最高,为对照组的2.1倍.其次为20 μmol/L MJ处理组,东莨菪碱产量为对照组的1.6倍. 10 μmol/L的MJ处理组单瓶莨菪碱产量最高,为对照组的1.1倍(图 6).经MJ处理后,东莨菪碱增加比例较莨菪碱更大.综合经济效益,40 μmol/L的MJ处理组虽然生物碱含量有一定程度的增加,但其生物碱产量明显低于对照组. 30 μmol/L的MJ处理组中莨菪碱产量显著低于对照组,但更具有药用价值的东莨菪碱含量显著高于对照组. 4个处理组中只有10 μmol/L的MJ处理后总生物碱产量提高.总生物碱产量为
Y表示总生物碱产量(mg),y1表示东莨菪碱产量(mg),y2表示莨菪碱产量(mg).
2.1. MJ对颠茄毛状根生长量的影响
2.2. MJ对颠茄毛状根中保护酶活性的影响
2.3. MJ对颠茄毛状根中可溶性蛋白、脯氨酸、MDA含量的影响
2.4. MJ对颠茄毛状根中东莨菪碱、莨菪碱合成的影响
-
从实验结果可知,用不同浓度的MJ处理12 d后,颠茄毛状根主根出现变黄和褐化现象;颠茄毛状根鲜质量明显低于对照,说明MJ对颠茄毛状根生长有抑制作用.这可能是由于MJ作为一种外源刺激,激发了植物细胞的多种逆境反应,使毛状根较快地由初生代谢转为次生代谢.渗透调节是植物抵御逆境胁迫的一种重要方式.可溶性蛋白质和游离脯氨酸是重要的渗透调节物质,可增加细胞对不良环境的适应性[21].颠茄毛状根的可溶性蛋白质、脯氨酸含量均有不同程度的增加或先增加后降低的趋势. MDA是植物细胞膜脂过氧化最重要的产物之一,它的产生还能加剧膜的损伤,在植物抗逆性的研究中是一个重要指标[22].正常情况下细胞自由基活性氧如O2-,OH-,H2O2-等的产生和清除处于动态平衡状态,在逆境胁迫下,SOD,POD和CAT等保护酶活性发生相应变化,而这些变化又与MDA积累密切相关[23].在20 μmol/L的MJ处理组SOD活性最高,歧化反应生成的H2O2量增多,而CAT活性较低将导致对H2O2的清除不足,使其在植物体内的含量增加,或导致活性氧自由基含量增加,使细胞膜过氧化程度加重,从而在4个MJ处理组中MDA含量最高.在40 μmol/L的MJ处理组CAT活性最高,清除H2O2的能力最强,其MDA含量最低.本研究中MDA含量增加的幅度并不大,可能与毛状根内氨基酸含量上升干扰了MDA的测定有关[21]. SOD,POD,CAT这3种保护酶活性的变化说明,MJ能影响颠茄毛状根氧化酶的活性,刺激颠茄毛状根保护酶活性增强,有利于东莨菪碱和莨菪碱的合成积累.
有研究表明MJ作为一种诱导子,可以被毛状根细胞膜上的受体所识别并与之结合,使细胞膜成分和性质发生变化,这种变化通过第二信使传递到细胞内,经过一系列的级联反应引起相关基因的启动或抑制,从而使关键酶的合成或活性发生改变,次生代谢物的积累随之增加或降低[24-25].在本研究中,颠茄毛状根经过不同浓度MJ诱导处理后,东莨菪碱含量均有明显提高,但莨菪碱含量提高幅度较小. MJ作为植物次生代谢过程中起诱导信号传导作用的物质,与颠茄次生代谢过程中哪些环节有关,是否能增强颠茄托品烷类生物碱代谢途径中相关酶的活性,促进其相关基因的表达,从而促进托品烷类生物碱成分的积累等,还有待于进一步研究.






 DownLoad:
DownLoad: