-
近年来,随着食品加工业与餐饮业的迅速发展,富含油脂的生活污水已成为水体的重要污染源.据不完全统计,每年餐饮业排放的未经处理的废水达上亿吨,且有不断上升的趋势[1].污染水体成分复杂,主要以胶体形式存在,化学需氧量(COD)与生化耗氧量(BOD)相对较高,富含油脂、纤维素等有机物[2-3].不经处理直接排放的废水,不仅会引起水体富营养化,破坏水体自净能力,给环境治理带来恶劣影响[4-6],而且废水中的有害微生物也会成为疾病的传播源,严重威胁人们的身心健康[1].近年来,国内外主要采用物理、化学、物化和生物技术等方法对含油污水进行处理[2],其中,采用微生物降解含油废弃物的研究逐渐增多[7-8].微生物能够利用油脂作为生长所需营养,并在脂肪酶等多种酶系的催化作用下,将其水解为甘油、脂肪酸等代谢产物[9].在此过程中,脂肪酶作为一种高效解脂酶,具有重要的研究与开发应用价值.
脂肪酶(Lipase EC.3.1.1.3),即酰基甘油水解酶(Acylglycerol hydrolases)广泛存在于动植物及微生物[10],是一类具有多种催化能力(解脂、酯交换和酯合成等)的酶[11-12].由于微生物产生的脂肪酶种类繁多、来源广泛(据不完全统计,自然界中已有65个属的微生物能够产生脂肪酶[13-14]),且具有高效的底物专一性、便于工业大规模生产和较高纯度酶制剂的获取等优势[15-16],因此工业上普遍采用培养微生物生产脂肪酶.尽管脂肪酶产生菌屡有报道,如荧光假单胞菌、不动杆菌、黑曲霉、扩展青霉、假丝酵母和涅斯捷连科氏菌[17-18],且目前市场上已经存在利用微生物生产的酶制剂商品[19],但总体来说,脂肪酶高产菌株的数量还是十分有限的[7],且适用于工业大规模生产的菌株甚少.因此,从环境中筛选出具有高活力、耐受性强和酶学性质稳定的脂肪酶生产菌株,对实际生产中应用脂肪酶降解油脂的意义重大.
本研究从校园土壤中分离微生物,并通过中性红油脂平板筛选法与三丁酸甘油酯平板透明圈法筛选脂肪酶高产菌株.同时以脂肪乳化液为原料,利用酸碱滴定法对高产菌株的酶学性质进行初探,为后续进一步提高脂肪酶产量并进行工业化生产提供研究基础.
HTML
-
用于分离筛选脂肪酶产生菌的土壤采自西南大学楠园学生二食堂附近.
-
初筛培养基(中性红油脂培养基)[20]:牛肉膏3.0 g,蛋白胨10.0 g,NaCl 5.0 g,琼脂20.0 g,猪油20.0 g,中性红16.0 g,蒸馏水1 000 mL,pH值为7.0,121 ℃灭菌20 min;复筛培养基[11]:100 g/L的三丁酸甘油酯(用体积比为3%的聚乙二醇溶液配制)100 mL,Tris-HCl缓冲液(pH=8.0)900 mL,琼脂20.0 g,121 ℃灭菌20 min;产酶基础培养基:蛋白胨10.0 g,蔗糖5.0 g,脂肪乳化液10.0 g,硫酸铵1.0 g,硫酸镁0.5 g,磷酸氢二钾2.0 g,蒸馏水1 000 mL,121 ℃灭菌20 min;种子培养基:马铃薯200.0 g,葡萄糖20.0 g,蒸馏水1 000 mL,pH值自然,121 ℃灭菌20 min;菌株活化培养基:马铃薯200.0 g,葡萄糖20.0 g,琼脂15.0 g,蒸馏水1 000 mL,pH值自然,121 ℃灭菌20 min.
-
基因组DNA提取试剂盒PrepMan Ultra Sample Preparation Reagent购自美国ABI公司;DNA marker 2000、rTaq酶、dNTP、PCR引物、10×PCR Buffer和Mg2+均购自生工生物工程(上海)股份有限公司;细菌生理生化检测鉴定管购自广东环凯微生物科技有限公司;PCR仪购自美国ABI公司;恒温摇床、电泳仪购自北京六一仪器厂;普通显微镜购自奥林巴斯公司;三丁酸甘油酯、聚乙二醇2000、(NH4)2SO4、MgSO4、K2HPO4和NaCl等均为国产分析纯.
-
称取含菌土样0.5 g混悬于49.5 mL含有玻璃珠的生理盐水中,作为10-2 g/mL稀释度,振荡混匀(约30 min).静置后,将上清液作连续10倍梯度稀释,取10-2,10-3,10-4,10-5 g/mL等4种不同质量浓度稀释液200 μL涂布于PDA培养基,每个稀释度2次重复,28 ℃倒置培养48 h,挑取生长较快的菌株划线接种至初筛培养基,每隔12 h观察一次,将菌落周围发生红色显色带的菌株进行纯化并保种.
-
将初筛确定的脂肪酶生产菌株在PDA平板上划线活化后,接种于产酶基础培养基中,于30 ℃条件下以180 r/min的转速振荡培养72 h,并以10 000 r/min的转速离心10 min后获取发酵上清液,用三丁酸甘油酯平板透明圈法[11]检测脂肪酶活,即:用直径为5 mm的打孔器在复筛培养基上打孔,取50 μL目标菌株发酵上清液注入孔中,28 ℃培养5 d,观察培养液周围是否有透明圈,并根据透明圈的大小判定酶活强弱.
-
将筛选获得的脂肪酶产生菌SLB-1接种至PDA培养基,28 ℃培养18~24 h,观察单菌落的大小、形状、颜色、透明度和色泽等特征.同时,将培养24 h和96 h的细菌分别进行革兰氏染色和芽孢染色,具体操作方法参照文献[21].
-
使用PrepMan Ultra Sample Preparation Reagent (Applied Biosystems,USA)试剂盒提取目标菌株基因组,并以其为模板,采用细菌16S rDNA通用引物27F (5'-AGAGTTTGATCCTGGCTCAG-3')和1492R (5'-GGCTACCTTGTTACGACTT-3')进行PCR扩增,PCR扩增体系为:dd H2O 15.9 μL,10×PCR Buffer 2.5 μL,Mg2+(1.5 mmol/L)1.5 μL,dNTP(10 mmol/L) 2.0 μL,Primer-F(10 μmol/L) 1.0 μL,Primer-R(10 μmol/L) 1.0 μL,模板1.0 μL,rTaq酶0.1 μL. PCR反应条件为:95 ℃预变性5 min;94 ℃变性30 s,53 ℃退火45 s,72 ℃延伸1 min,共30个循环;最后72 ℃延伸10 min.扩增产物用1%琼脂糖凝胶电泳分离后,送至生工生物工程(上海)股份有限公司测序.将获得的基因序列拼接后用BLAST程序(http://blLast.ncbi.nlm.nih.gov/Blast.cgi)进行同源性比较分析,下载同源性较高的序列,用Clustal 1.83软件进行同源性分析,并用MEGA 4.0软件邻接法(Neighbor-joining method)进行1 000次步长计算,构建系统发育树[24-25].
-
参考文献[26]中所述的酸碱滴定法测定脂肪酶酶活,具体操作方法为:用体积比为3%的聚乙二醇溶液制备含100 g/L的三丁酸甘油酯乳化液.取该底物乳化液5 mL,加入4 mL 0.025 mol/L的磷酸缓冲液(pH=7.0) 组成反应体系,置于40 ℃水浴中保温5 min,加入1 mL发酵上清粗酶液开始精确计时,继续保温15 min后取出,立即加入95%的乙醇15 mL终止酶反应,以加入高温灭活酶液为对照.将酶促反应后的底物与对照分别加入15 mL蒸馏水稀释,并加入3滴酚酞指示剂,用0.05 mol/L的NaOH溶液滴定水解产生的游离脂肪酸.根据两者耗碱量的差值计算酶活大小.脂肪酶酶活单位定义为:一定条件下,每分钟产生1 μmol脂肪酸所需的酶量定义为1个酶活单位(U).酶活的计算公式为:
式中:U为酶活,V为滴定样所消耗的NaOH体积(mL),V0为滴定空白样所消耗的NaOH体积(mL),t为反应时间(min),n为酶液体积(mL),M为滴定用的NaOH溶液的浓度(mol/mL).
-
1) 产酶最适培养时间:将脂肪酶产生菌SLB-1接种于产酶基础培养基,分别振荡培养12,24,48,72,96 h后,以10 000 r/min的转速离心10 min,取各上清液作为粗酶液测定酶活,确定菌株产酶最适培养时间;
2) 酶促反应的最适温度与最适pH值:将脂肪酶产生菌SLB-1接种于产酶基础培养基中振荡培养24 h后,以10 000 r/min的转速离心10 min,上清液即为粗酶液.分别设置酶促反应温度为20,25,30,35,40,45 ℃,酶促反应pH值为5.0,6.0,7.0,8.0,9.0,测定不同的温度及不同pH值条件下的酶活,确定酶促反应的最适温度与最适pH值.
1.1. 材料
1.1.1. 土壤采集
1.1.2. 培养基
1.1.3. 主要试剂与仪器
1.2. 方法
1.2.1. 脂肪酶产生菌分离与筛选的方法
1.2.1.1. 脂肪酶产生菌的分离
1.2.1.2. 脂肪酶产生菌的筛选
1.2.2. 脂肪酶产生菌菌种鉴定的方法
1.2.2.1. 菌体培养特征、形态的观察
1.2.2.2. 生理生化反应特征的检测
1.2.2.3. 分子生物学特征检测
1.2.3. 脂肪酶酶学性质的研究
1.2.3.1. 脂肪酶酶活定量测定方法
1.2.3.2. 脂肪酶酶学性质研究
-
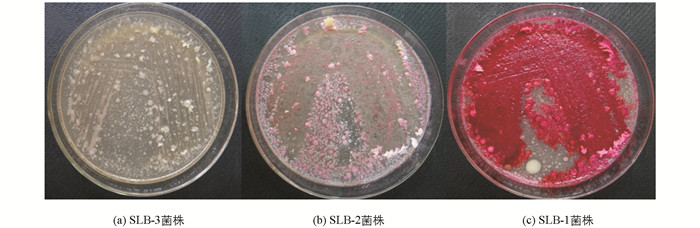
从采集的含菌土壤样品中分离获得11个细菌分离株,分别命名为SLB-1-SLB-11.其中SLB-3(图 1(a)),SLB-4,SLB-6,SLB-7,SLB-11共5株细菌在初筛平板上能够生长,但无显色反应;其余6株细菌在初筛平板上生长良好,且均能发生显色反应,但各菌株所产脂肪酶酶活有所差异,SLB-2菌株在初筛平板上显淡红色,其脂肪酶酶活较弱(图 1(b)),SLB-1菌株在初筛平板上颜色最红,表明该菌株所产脂肪酶酶活最高(图 1(c)).选择初筛获得的6株脂肪酶产生菌进行复筛,结果显示SLB-1菌株上清液周围出现明显的透明圈,培养5 d后透明圈直径可达(29.8±0.2) mm(图 2),而其他菌株无透明圈产生或产生透明圈较小,由此表明SLB-1菌株上清液中的脂肪酶具有较高酶活,且由该菌株所产脂肪酶酶活较为稳定,故选取SLB-1菌株进行后续研究.
-
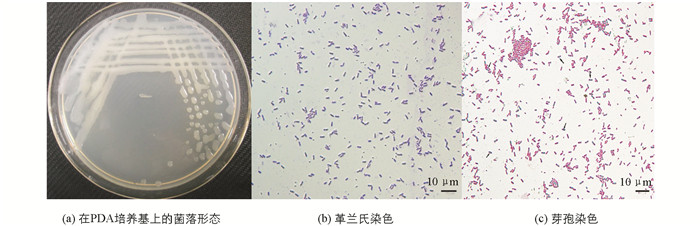
将获得纯培养的SLB-1菌株接种于PDA培养基,于28 ℃下倒置培养24 h,菌落呈乳白色,较透明,圆形,边缘整齐,蜡质,表面光滑(图 3(a)).菌株SLB-1革兰氏染色呈蓝紫色,为革兰氏阳性菌(图 3(b)),芽孢染色后,菌体中央有椭圆形绿色芽孢(图 3(c)).生理生化检测结果表明脂肪酶产生菌SLB-1菌株硝酸盐还原呈阳性,能够水解淀粉和液化明胶(表 1).结合对菌株SLB-1的形态及培养特征观察结果,判断脂肪酶产生菌SLB-1为芽孢杆菌属菌株.
-
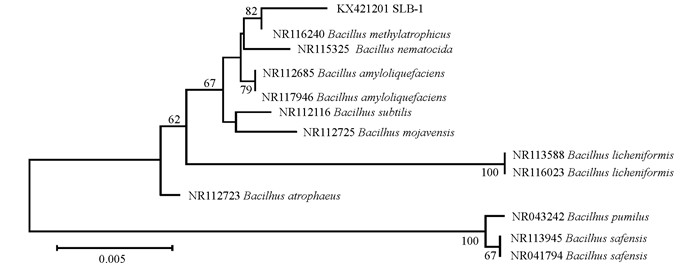
以脂肪酶产生菌SLB-1基因组DNA为模板,使用16S rDNA通用引物PCR扩增,获得一条长度为1457 bp的目的片段.将测序后的16S rDNA序列提交GenBank,获得登录号为KX421201.使用MEGA 4.0软件,根据16S rDNA序列采用邻接法构建SLB-1菌株的系统发育树,结果显示菌株SLB-1与登录号为NR116240甲基营养型芽孢杆菌Bacillus methylotrophicus(又名Bacillus velezensis[27])处于同一最小分支(图 4),且序列同源性高于99%.结合形态学和生理生化特征及16S rDNA序列的系统发育分析结果,鉴定该菌株为甲基营养型芽孢杆菌(Bacillus methylotrophicus),命名为B. methylotrophicus SLB-1.
-
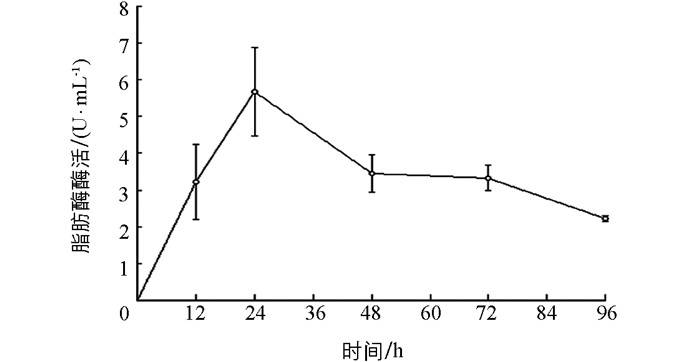
SLB-1菌株产脂肪酶酶活整体呈现先上升后下降的趋势,在0~24 h期间,发酵上清液中脂肪酶酶活逐渐升高,培养24 h时脂肪酶酶活达到峰值5.67 U/mL,随后随着培养时间的延长,脂肪酶酶活呈下降趋势(图 5),故初步确定24 h为该菌株产脂肪酶的最适培养时间.
-
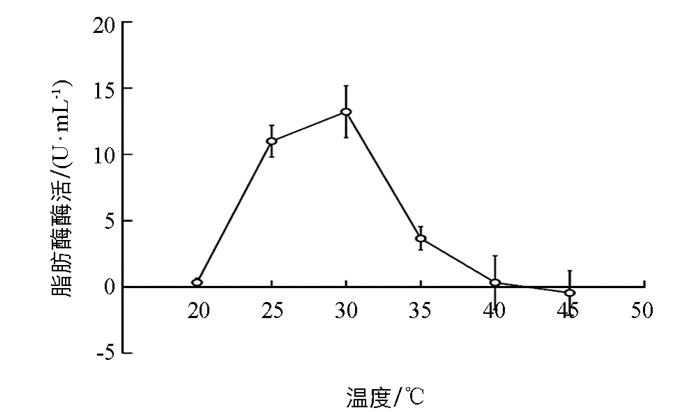
SLB-1菌株所产脂肪酶酶促反应的最适温度测定结果表明,该酶最适作用温度为30 ℃,其酶活达到13.22 U/mL.超过30 ℃后,脂肪酶酶活力急剧下降,直至45 ℃时,脂肪酶完全失活(图 6),该实验结果表明该脂肪酶为常温酶,且其对酶促反应温度极为敏感.由此结果可知,在研究SLB-1菌株产酶最佳时间时,由于选用酶促反应温度为40 ℃,导致即使在最适培养时间24 h,酶活亦仅为5.67 U/mL.
-
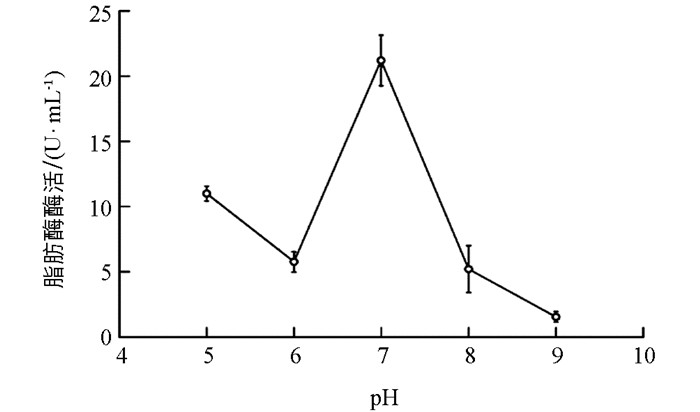
SLB-1菌株所产脂肪酶酶促反应的最适pH值研究结果表明,该酶酶促反应的最适pH值为7.0,其酶活可达21.22 U/mL,酶促反应pH值为8.0时,酶活仅为5.22 U/mL(图 7),该结果表明SLB-1菌株产生的脂肪酶属于中性脂肪酶.
2.1. 脂肪酶产生菌分离筛选的结果
2.2. 脂肪酶产生菌菌种鉴定的结果
2.2.1. 脂肪酶产生菌的形态及生理生化特征
2.2.2. 脂肪酶产生菌基于16S rDNA的系统发育分析
2.3. B. methylotrophicus SLB-1产脂肪酶的酶学性质
2.3.1. SLB-1菌株产酶的最适培养时间
2.3.2. 酶促反应的最适温度
2.3.3. 酶促反应的最适pH值
-
含油污水是一种量大而面广的污染源,利用微生物对油脂降解进而治理含油污水是一种经济、高效且环保的可行办法[28].本研究以猪油和三丁酸甘油酯为底物,从西南大学食堂附近富含油脂的土壤中筛选获得一株脂肪酶产生菌SLB-1,根据其形态学特征、生理生化特性及基于16S rDNA的系统发育分析,将其鉴定为甲基营养型芽孢杆菌(Bacillus methylotrophicus).产生脂肪酶的微生物在自然界分布广泛,尤其是在种植大豆等农作物的富含植物油脂或食堂、厨房等附近排放废弃油脂的土壤或水体内更容易筛选出脂肪酶活高产菌株[29].近几十年来,随着脂肪酶在工业上的广泛运用,能够产生脂肪酶的微生物也不断被发现.其中,有关枯草芽孢杆菌[30-31]与假单胞菌属菌株[32]生产脂肪酶的研究报道颇多,但有关甲基营养型芽孢杆菌产生脂肪酶却鲜见报道.
一般来说,细菌脂肪酶大多数为中性或碱性脂肪酶,且在pH值为4~11、温度为30 ℃~60 ℃的条件下具有良好的稳定性[33-34],这与本研究的SLB-1菌株所产脂肪酶酶学性质实验结果一致,该菌株培养时间为24 h时上清液中脂肪酶酶活最高,其最适反应温度为30 ℃,最适反应pH值为7.0,属于常温中性脂肪酶.该菌株在30 ℃、pH=7.0条件下的脂肪酶酶活为21.22 U/mL,略高于伍康荣等筛选的铜绿假单胞菌(Pseudomonas aeruginosa)在最佳培养基条件下的脂肪酶酶活(8.293 U/mL)[32]以及张博等从土壤中筛选的假单胞菌属(Pseudomonas sp.)菌株在最适产酶条件下发酵脂肪酶所产生的酶活(15.5 U/mL)[35].本研究以猪油与三丁酸甘油酯为油脂来源筛选得到脂肪酶生产菌SLB-1菌株,并对其脂肪酶的部分酶学性质进行探究,为后续优化SLB-1菌株产生脂肪酶的发酵条件奠定了前期研究基础,亦将有利于利用该菌株进行富含油脂工业废水及生活污水的环境治理.







 DownLoad:
DownLoad: