-
朱砂叶螨Tetranychus cinnabarinus Boisduval属于叶螨科Tetranychidae叶螨属,又名红蜘蛛,是广泛分布于世界温带地区及温室的重要多食性害螨之一,是世界性经济害螨,严重危害100余种作物,尤其对棉花、多种蔬菜及花卉造成严重危害,使其产量和品质大幅下降[1-2].阿维菌素是一种农用抗生素,属于昆虫神经毒剂,其作用机理是干扰神经生理活动,刺激释放γ-氨基丁酸,而氨基丁酸对节肢动物的神经传导有抑制作用.哒螨灵又称哒螨酮,是具有呼吸抑制作用的杀螨剂.螺螨酯是具有生长调节活性的杂环类杀螨剂,可以抑制螨类体内的脂肪体合成,破坏螨类的能量代谢活动,最终杀死害螨[3].姜黄素是从姜科姜黄属Curcuma longa L.植物姜黄、莪术、郁金等的根茎中提取的一种天然有效成分[4].张永强等[5]及罗金香[6]发现姜黄素及其衍生物对朱砂叶螨具有很好的生物活性.东莨菪内酯是从黄花蒿中提取出来的化合物[7],梁为等[8]报道东莨菪素处理朱砂叶螨后,致毒症状表现为神经毒剂的症状,如兴奋、痉挛等.马志卿[9]对比了DDT等13类杀虫药剂和松油烯-4-醇对粘虫Mythimna separata、棉蚜Aphis gossypii和家蝇Musca domestica等的致毒症状,通过观察推测出松油烯-4-醇有可能和菊酯类药剂的作用机理相似或一致.在朱砂叶螨形态学方面,洪晓月等[10]对朱砂叶螨体表结构进行扫描电镜观察,测得了雌成螨体长、体宽.在水分损失方面,荒漠昆虫天花吉丁虫不同温度下的水分损失率,棉铃虫蛹期在极端湿度下的失水动态,美凤蝶非滞育蛹、滞育蛹和滞育蛹羽化成虫不同发育阶段水分含量都曾报道过[11-13].姜黄素和东莨菪内酯都是植物源活性化合物,其对朱砂叶螨的作用机制至今尚不清楚,而各种药剂对朱砂叶螨的形态变化和水分损失尚未进行过专门研究.本试验从药剂处理对朱砂叶螨形态变化和水分损失来研究,为揭示其作用机理提供一定的参考.
HTML
-
供试朱砂叶螨最初采自重庆市北碚区田间的豇豆苗,并在室内不接触任何药剂的情况下以盆栽新鲜豇豆苗饲养多年.室内饲养条件为(26±1) ℃,相对湿度55%~70%,光照周期14 h:10 h(L:D).试验中选择个体大小一致、体色鲜红刚进入成螨期的个体进行室内毒力测定.
-
用于室内毒力测定的药剂均为原药,分别为95%阿维菌素(武汉宏信康精细化工有限公司),95%螺螨酯原药(山东康乔化学有限公司),95.5%哒螨灵(山东青岛瀚生有限公司),95%姜黄素(河南中大生物工程有限公司),80%东莨菪内酯(西南大学天然产物农药研究室).
-
Motic双目摄像显微镜(麦克奥迪实业集团有限公司型号SMZ168-BL(60)),DHP-500型电热恒温培养箱(北京市永光明医疗仪器厂),RXZ-260A人工气候箱(宁波东南仪器有限公司).
-
参照FAO(联合国粮农组织)推荐的测定害螨的标准方法——玻片浸渍法并加以改进.方法是将双面胶带贴在载玻片的一端,用镊子揭去胶带上的纸片,用零号毛笔轻轻粘取豇豆叶背上的叶螨,使叶螨背部粘在双面胶带上,使各螯肢和足可以自由活动,每片胶带粘2行,每行粘15~20头螨,将粘有叶螨的玻片放入清洁无毒的瓷盘内,瓷盘置于室温下放置4 h,用双目解剖镜观察,严格剔除死亡、不活泼及体位不合适的叶螨个体,保留个体较大、活跃的雌成螨为供试螨.称取一定量供试药剂,加入吐温-80作为乳化剂,搅匀,用少量丙酮使其完全溶解,各药剂在预试验的基础上用RO水将药剂稀释5~7个质量浓度,溶液中用含同等体积的吐温-80清水为对照.每一质量浓度处理3次,试验重复4次.将载螨玻片的一端浸入药液,轻摇5 s后取出,迅速用吸水纸吸干周边多余药液.在瓷盘内铺1层蓝色绒布,下边放一层海绵,将玻片放在蓝色绒布上,在瓷盘里加水以达到保湿的效果,浸过药液的玻片放置于大瓷盘内.置于温度为25 ℃、相对湿度75%、光照L:D为14:10的恒温培养箱中,分别于24 h,48 h和72 h时用双目解剖镜下检查死亡情况,分别记录存活和死亡的叶螨数量.以毛笔轻触螨体,螯肢不动者视为死亡.
-
用各种药剂48 h的LC50浓度浸渍玻片上的朱砂叶螨,然后放置于人工气候箱中.使用Motic摄像显微镜自带软件测量工具,并用校准工具校准.在显微镜下对螨体进行拍照,每天3次,分别测出浸药后各时间段螨的体长和体宽,选出0 h,72 h和168 h时间段,求出皱缩率.
其中:SR为体长(宽)皱缩率;L0为0 h体长(宽);LN为Nh体长(宽).
-
采用DHP-500型电热恒温培养箱控制恒温环境,试验温度为25 ℃,在培养箱内放入干燥剂CaCl2 250 g,吸收蒸发的水分,培养箱内湿度为75%.试验前禁食4 h后,用电子天平称质量后将玻片放入培养箱中,用各种药剂的48 h LC50质量浓度浸渍玻片上的朱砂叶螨,数量为100头,3次重复.每8 h称质量一次,监测水分在不同药剂处理不同时间后的水分变化.每次测量结束后继续放入培养箱内至120 h,试验结束再称质量.
其中:WR为水分损失率;W0为0 h体质量;WN为Nh体质量.
1.1. 试验材料
1.2. 供试药剂
1.3. 试验仪器
1.4. 毒力测定
1.5. 体壁皱缩率测定方法
1.6. 朱砂叶螨水分损失率测定
-
试验测得5种药剂对朱砂叶螨的毒力表 1.从表 1可知,48 h内各种药剂对朱砂叶螨都有一定的触杀活性,毒力相差很大.
-
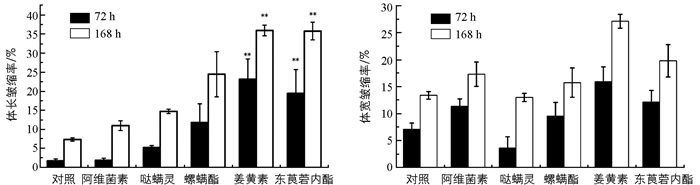
由表 2可知,朱砂叶螨雌成螨的体长在450~510 μm之间,体宽在260~290 μm之间,经过不同药剂处理72 h和168 h后朱砂叶螨体长、体宽都出现减小的情况,但是各药剂之间朱砂叶螨体长、体宽减小的程度不同.其中姜黄素、东莨菪内酯处理朱砂叶螨后72 h和168 h内体长、体宽减少较大,72 h内体长分别减少96.90,116.94 μm,168 h内分别减少181.2,177.53 μm;72 h内体宽分别减少45.97和32.53 μm,168 h内减少77.33和52.97 μm.
从图 1结果可知,5种药剂处理对朱砂叶螨形态变化的影响各不相同. 72 h,168 h内体长皱缩率在1.73%~35.94%之间,体宽皱缩率在3.64%~27.15%之间.其中姜黄素和东莨菪内酯处理对朱砂叶螨的体长皱缩率影响较大,72 h皱缩率分别为23.17%,19.46%;168 h皱缩率达到30%以上,分别为35.94%,35.79%,相对于空白对照、阿维菌素和哒螨灵来说差异具有统计学意义. 72 h,168 h内各种药剂对朱砂叶螨体宽皱缩率的影响差异不具有统计学意义.
-
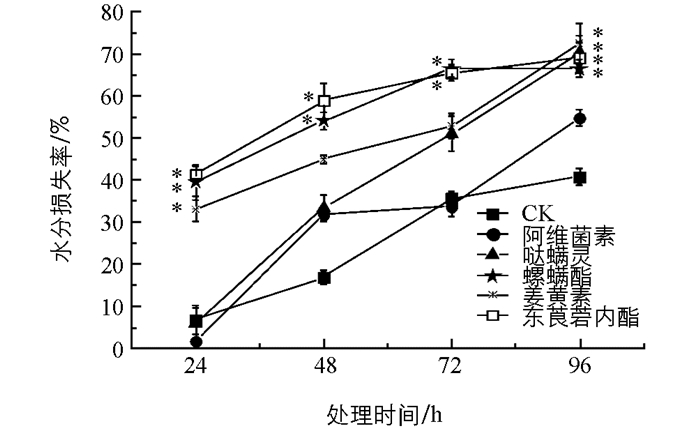
由表 3可知,0 h朱砂叶螨单头质量在16.33~20.05 μg之间,随着时间的变化,各药剂处理后朱砂叶螨的质量都有减少,不同药剂处理不同时间后朱砂叶螨的水分损失量不同. 48 h以前螺螨酯、姜黄素、东莨菪内酯处理后朱砂叶螨水分损失较快,72 h以后哒螨灵、螺螨酯、姜黄素和东莨菪内酯水分损失较快,到96 h经哒螨灵处理后朱砂叶螨体质量减少到5.20 μg.
从图 2的结果可知,5种药剂处理后螨体水分损失率随着时间的延长逐渐增大,螨体水分最大损失率为经姜黄素处理96 h后的72.59%. 24 h,48 h经东莨菪内酯处理后螨水分损失达到最大为41.55%,58.98%;72 h经螺螨酯处理的螨体水分损失率达到最大为66.67%,96 h经姜黄素处理的螨体水分损失率达到最大为72.59%.从时间效应上看,螺螨酯、姜黄素、东莨菪内酯在96 h内的水分损失率与对照相比差异具有统计学意义.
2.1. 5种药剂的毒力测定结果
2.2. 5种药剂处理后对朱砂叶螨的影响
2.2.1. 5种药剂处理对朱砂叶螨形态的影响
2.2.2. 5种药剂处理对朱砂叶螨水分损失的影响
-
试验选取的5种药剂对朱砂叶螨都有一定的触杀活性,其中化学药剂阿维菌素属于神经生理性抑制剂,可刺激释放γ-氨基丁酸,从而抑制螨体正常的神经传导;哒螨灵属于线粒体电子传递链抑制剂;螺螨酯属于生理代谢类抑制剂,可抑制螨体脂肪的合成[3].植物源杀螨活性化合物姜黄素和东莨菪内酯处理朱砂叶螨后,在形态变化和水分损失方面,与阿维菌素和哒螨灵差异较大,与螺螨酯具有一定的相似性,但也有不同. 5种药剂处理朱砂叶螨后,在形态变化方面螨体都会出现皱缩,尤其姜黄素和东莨菪内酯对朱砂叶螨的体长皱缩率影响较大,姜黄素和东莨菪内酯处理后其体长皱缩率在72 h,168 h分别达到23.17%,35.94%和19.46%,35.79%,与其他药剂和对照的差异具有统计学意义;药剂处理后,朱砂叶螨体内的水分都会出现一定程度的损失,但各药剂之间水分损失率不同,经姜黄素和哒螨灵处理96 h后,其水分损失率达到70%以上.其中,在96 h内螺螨酯、姜黄素和东莨菪内酯处理朱砂叶螨后的水分损失率与对照相比差异具有统计学意义.
有报道称植物源农药印楝素能影响昆虫体内激素平衡,从而干扰昆虫生长发育[14].植物源杀螨活性化合物往往从多作用位点对靶标生物产生影响,生物体对外源有害物的解毒代谢机制也是多方面的,各生化指标间并不独立,而是相互联系、互为补充[15].从本试验结果可以看出,姜黄素和东莨菪内酯处理朱砂叶螨后其体长、体宽皱缩率和其他几种药剂差异具有统计学意义,姜黄素、东莨菪内酯和螺螨酯处理96 h后水分损失率跟阿维菌素、哒螨灵差异具有统计学意义,即姜黄素和东莨菪内酯对朱砂叶螨的水分损失情况和生长调节剂螺螨酯具有相似之处.结合本试验药剂处理后朱砂叶螨体长、体宽及皱缩等形态变化情况,姜黄素和东莨菪内酯的作用机制和生长调节类物质螺螨酯不完全相同.有报道称,姜黄素处理朱砂叶螨的中毒症状类似神经毒剂[16],如站立不稳,足过度伸张,运动失调,蹒跚爬行,螨体打颤、痉挛、抽搐等.东莨菪内酯处理朱砂叶螨后也表现出神经毒剂的症状[8],如开始表现出兴奋状态,产卵量减少甚至不产卵,螨体抽搐和痉挛等,因此姜黄素和东莨菪内酯具体的作用机制还需进一步地探究.姜黄素和东莨菪内酯作为新型的杀螨剂,对朱砂叶螨具有很好的活性,笔者从形态变化和水分损失等方面进行观察和测定,进而和其他药剂进行对比,对揭示杀螨剂的作用机理具有一定的参考作用.






 DownLoad:
DownLoad: