-
金针菇在我国种植历史悠久,是最早进行人工栽培的食用菌之一,其含有丰富的蛋白质、维生素及矿物质等营养元素,同时富含8种人体必需的氨基酸,占总氨基酸量的42.29%~51.17%,其中每100 g干制金针菇中精氨酸和赖氨酸含量分别为1.231 g和1.024 g[1],比其他品种食用菌中的含量都高出许多,对调整人体新陈代谢、改善体质、提高健康水平有明显作用[2].另外,金针菇所含有的多糖类[3-4]、黄酮类[5]以及碱性蛋白质火菇素[6]等生物活性物质具有抗氧化、抗肿瘤、提高机体免疫功能等作用.因此,金针菇具有符合现代社会人类对食物营养、健康、有机、绿色的发展要求,深受消费者喜爱,具有巨大的发展潜力.
金针菇主要以鲜销为主,采后金针菇呼吸代谢旺盛,不耐贮藏,室温下1~2 d发生萎蔫、褐变、腐烂,严重影响其食用价值[7],故新鲜金针菇的保鲜是产业全面发展的重要前提.目前金针菇的保鲜技术主要集中在不同包装材料简易包装[8]、气调保鲜[9]、化学保鲜[10]、热处理保鲜[11]等方面,而关于现阶段国内外学者研究热点的抗性诱导剂应用至金针菇保鲜方面的研究则少有报道.采后抗病性诱导是指利用抗病性诱导因子预先处理果蔬,使其对贮藏或运输过程中可能侵染果蔬的致病菌产生抗性免疫反应,这是一种通过激发果蔬自身抗病性而有效抵御或杀死病原菌的防治方法[12],而这种抗性诱导是植物天然的抗病防御机制的表达,加强了植株抵御病原菌侵染的能力,是植物自身基因的表达,而不是基因突变或者是外来基因的整合,因此抗性诱导具有高度的生物安全性.目前研究中经常使用的有植物生长调节物质如茉莉酸及其甲酯化合物和水杨酸,有氨基酸衍生物类β-氨基丁酸,有的来自生物体如矮壮素,也有多糖类物质壳聚糖,还有苯并噻重氮和2,6-二氯异烟酸这两种人工合成的抗性诱导剂,这些诱导剂具有诱导植物抗病基因产生抗病性的能力,可以为果蔬鲜品保鲜提供一条新途径,且相关研究已表明现阶段常用的抗性剂在哈密瓜、芒果、鸭梨、柑橘、马铃薯、番茄[13-14]等水果蔬菜的研究中具有显著的保鲜效果.
果蔬贮藏过程中,抗氧化酶系统的活性是评价其采后贮藏品质的重要指标. POD,SOD和CAT是活性氧防御系统中的主要酶系统[15],POD酶是一种可避免生物体细胞受到H2O2伤害、在植物抗病防御系统中能发挥有效作用的氧化还原酶[16]. CAT酶是生物体内新陈代谢活动中主要的抗氧化酶之一,具有清除体内H2O2,防止活性氧对脂类物质的破坏以及对蛋白质分子的聚合交联作用[17]. SOD酶可以催化超氧化物阴离子自由基的歧化反应,具有清除O2-的能力,它的存在可以保护细胞的膜结构,使植物的抗逆性、抗病性加强,对逆境胁迫的忍受度增加[18].因此,本文将壳聚糖、水杨酸、苯并噻重氮、茉莉酸甲酯4种抗性诱导剂应用于金针菇的保鲜研究中,分别探究其对金针菇抗氧化酶系统中的POD,CAT,SOD酶的影响,通过其酶活性的高低判断金针菇贮藏性和保鲜效果,确定其较佳的使用浓度,以期为金针菇的贮藏保鲜提供理论依据.
HTML
-
供试金针菇:采自重庆大足正宽食用菌专业种植社,早上7点采取新鲜、无病害的金针菇放入4 ℃的冷库预冷4 h.
过氧化物酶试剂盒、过氧化氢酶试剂盒、超氧化物歧化酶试剂盒、水杨酸、水溶性壳聚糖、苯并噻重氮、茉莉酸甲酯等均为分析纯.
-
EX324ZH型电子分析天平,上海上天精密仪器有限公司;GL-12A型高速冷冻离心机,上海菲恰尔分析仪器有限公司;754E型紫外可见分光光度计,上海元析仪器有限公司;HH-4型电子恒温水浴锅,常州国华电器有限公司.
-
配制浓度梯度为0.5,1.0,1.5,2.0 mmol/L的水杨酸溶液,0.25,0.5,0.75,1.0 g/L壳聚糖溶液,0.25,0.5,0.75,1.0 mmol/L苯丙噻重氮溶液,1,10,100,1 000 μmol/L茉莉酸甲酯溶液,分别对预冷4 h的金针菇采用10 mL化妆用喷雾瓶进行喷雾处理,按照每50 g金针菇1 mL溶液进行均匀喷雾,处理后将金针菇快速晾干,用果蔬防潮纸包装,贮藏在冰箱中,温度设置为2 ℃,每2 d测定酶活1次.
-
粗酶液提取:参考组织质量(g)与提取液体积(mL)为1:5~10的比例,取50 g金针菇切碎混匀,再准确称取0.1~0.2 g金针菇,移取1~2 mL提取液与金针菇混合进行冰浴匀浆,8 000 r/min,4 ℃离心10 min,收集上清液保存在冰箱中备用.
参照POD试剂盒、CAT试剂盒、SOD试剂盒说明书进行测定.
-
数据处理使用Microsoft Excel 2010;采用SPSS 22.0做统计分析并进行数据显著性差异分析(p<0.05为有统计学意义);采用Origin Pro 9.1进行图像处理;所有实验均做3次重复测定.
1.1. 材料与试剂
1.2. 仪器与设备
1.3. 方法
1.3.1. 材料处理
1.3.2. 指标测定
1.3.3. 数据分析
-
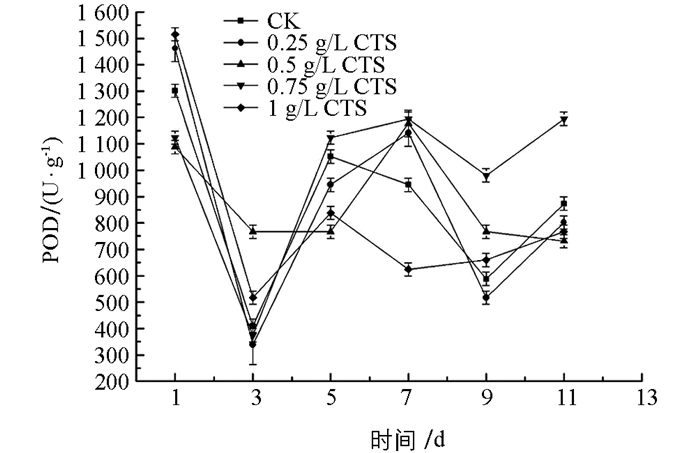
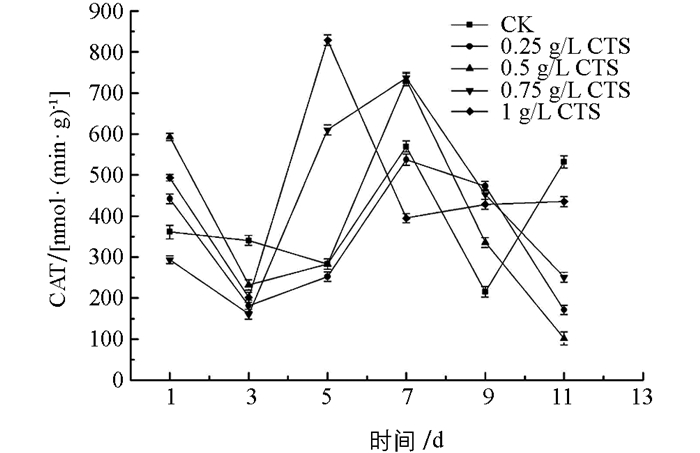
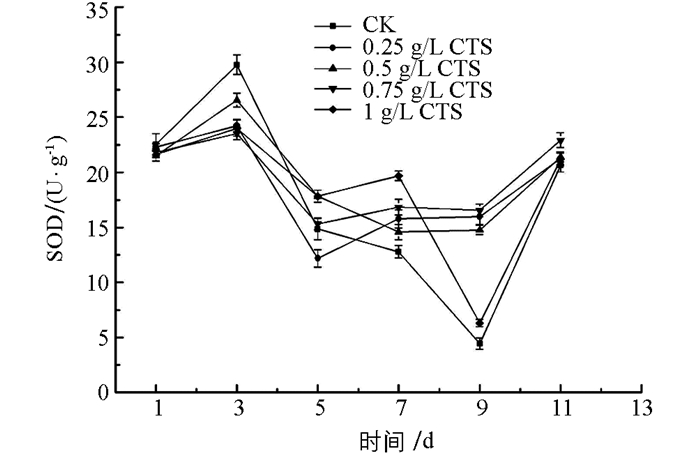
一定浓度的壳聚糖溶液处理均可以提高金针菇的POD,CAT,SOD酶活性. 图 1中显示,在贮藏前5 d,对照组与处理组POD酶活性都急剧下降后又急速上升,可能在贮藏前3 d,壳聚糖溶液处理还未激发金针菇体内应激反应,导致POD酶下降,急速上升表明体内产生了应激反应,0.75 g/L壳聚糖浓度处理组上升速率最快且在整个后期贮藏中,其POD酶活性均高于对照组(CK)和其他处理组. 图 2中,壳聚糖处理组在第3 d后CAT酶活急速上升,其中,1 g/L壳聚糖处理组酶活上升速率最快且在第5 d时达到峰值,7~11 d贮藏期间,除1 g/L壳聚糖处理组酶活基本保持稳定外,其他所有处理组酶活急剧下降. 图 3中,处理组与对照组在贮藏前5 d,SOD酶活性呈现先升后降的趋势,对照组持续下降到第9 d后再上升,上升的可能原因是贮藏9 d后金针菇出现了开伞、组织软化的现象,其自身促使各种酶类升高来达到抗病防御效果.处理组则是逐渐上升(1 g/L处理组除外),酶活均高于对照组,差异有统计学意义(p<0.05),其中,0.75 g/L壳聚糖浓度处理组SOD酶活性一直处于较高水平,优于其他处理组.
综上所述,0.75 g/L壳聚糖浓度处理金针菇,其POD和SOD酶活性在整个贮藏期均保持较高水平,有利于金针菇的采后贮藏;而1 g/L壳聚糖处理CAT酶活性较高,效果最佳.因此,综合壳聚糖对3种酶活性的共同作用,选择0.75 g/L壳聚糖处理作为最佳浓度.
-
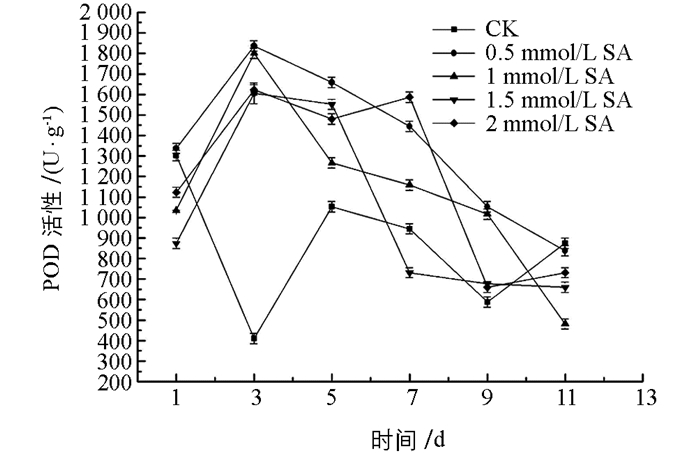
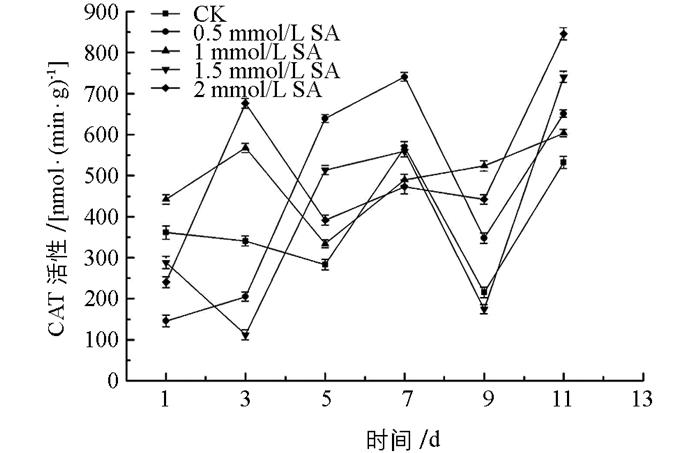
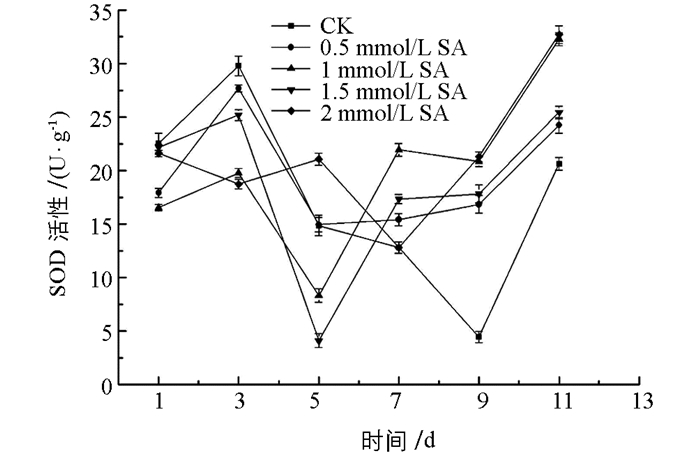
图 4中,所有处理组POD酶活性先升高后逐渐下降,酶活性整体高于对照组(CK),其中,0.5 mmol/L水杨酸处理组在整个贮藏期保持着较高的POD酶活性. 图 5中,0.5 mmol/L水杨酸处理组在1~7 d贮藏期间,CAT酶活逐渐上升,第7 d达到酶活峰值,高于其他处理组和对照组,第9 d降低至最低水平,但其活性仍高出对照组61.43%,两者之间差异有统计学意义(p<0.05),在贮藏第9~11 d时,除1.5 mmol/L处理组外,其他水杨酸处理组CAT酶活性均高于对照组. 图 6中可以看出,水杨酸处理后,贮藏中后期酶活不断升高,作用效果明显,7 d后所有处理组SOD酶活性均高于对照组,而0.5 mmol/L水杨酸处理组在贮藏前期,酶活虽略低于对照组,但5 d后酶活均高于对照组,且差异有统计学意义(p<0.05),同时,与其他处理组比较,0.5 mmol/L水杨酸处理能够使SOD酶活性在整个贮藏期更趋于稳定.
因此,综上所述,0.5 mmol/L水杨酸处理可以较大程度提高POD,CAT,SOD酶活性,减缓金针菇贮藏后期的衰老,有利于延长贮藏期.
-
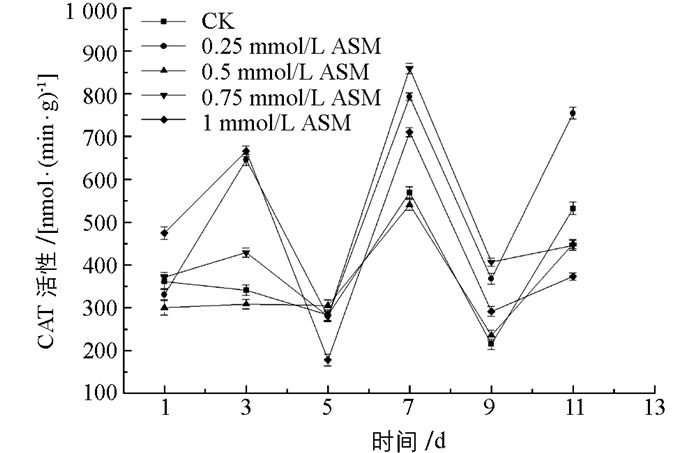
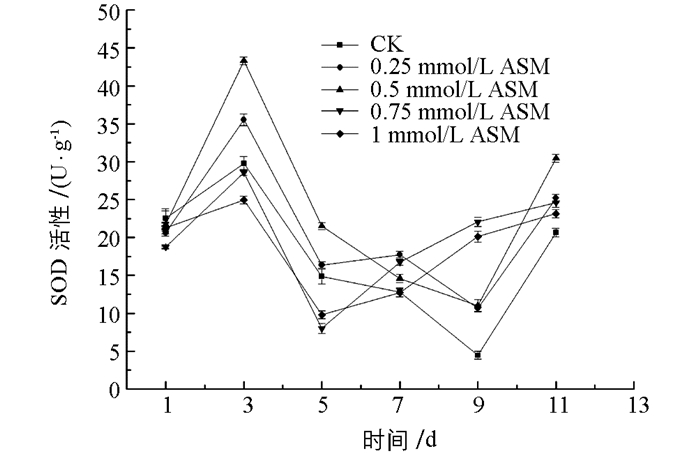
图 7中,处理组与对照组的POD酶活性基本保持一致的变化趋势,在贮藏第3~9 d,所有处理组POD酶活性均高于对照组,且差异有统计学意义(p<0.05),在贮藏后期9~11 d,仅有0.75 mmol/L处理组的POD酶活性高于对照组,优于其他处理组. 图 8中,在整个贮藏期,0.25 mmol/L和0.75 mmol/L苯并噻重氮处理组的CAT酶活大部分时间段都高于其他处理组和对照组,且两组处理对金针菇CAT酶活提高作用相当.这与董柏余[19]用苯并噻重氮处理厚甜瓜抑制了CAT酶活性不同,可能是由于本次实验的金针菇无论是对照组还是处理组都没有发生褐斑病害的原因,导致对照组与处理组的CAT酶活性变化趋势基本一致,且表现为处理组的酶活性高于对照组. 图 9中,两组低浓度的苯并噻重氮处理组变化趋势与对照组变化一致,SOD酶活性在第3 d上升到波峰后持续下降到第9 d的波谷,且在整个贮藏过程,两组低浓度处理组的酶活一直高于对照组,且0.5 mmol/L优于0.25 mmol/L浓度,差异有统计学意义(p<0.05).
因此,综上所述,0.75 mmol/L苯并噻重氮处理可使POD酶活性保持较高水平;0.25 mmol/L和0.75 mmol/L使CAT酶活性提高具有相当效果,0.5 mmol/L可使SOD酶保持高水平.因此,结合3种酶同时作用效果,选择0.75 mmol/L苯并噻重氮处理组作为最佳浓度.
-
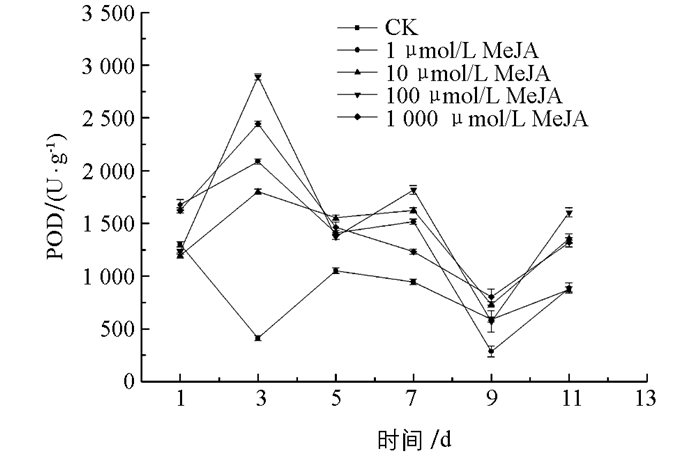
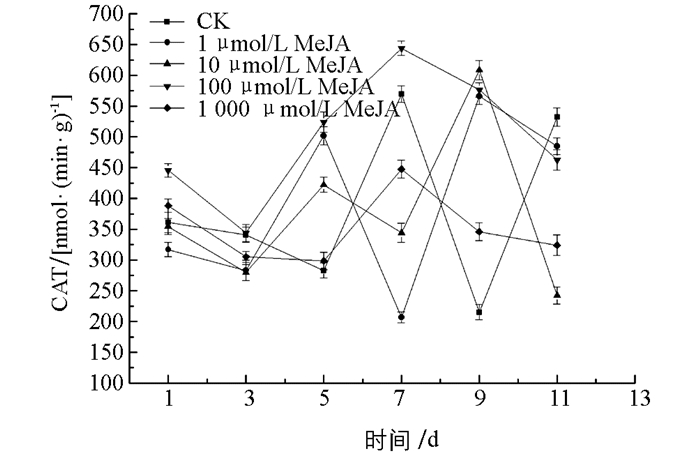
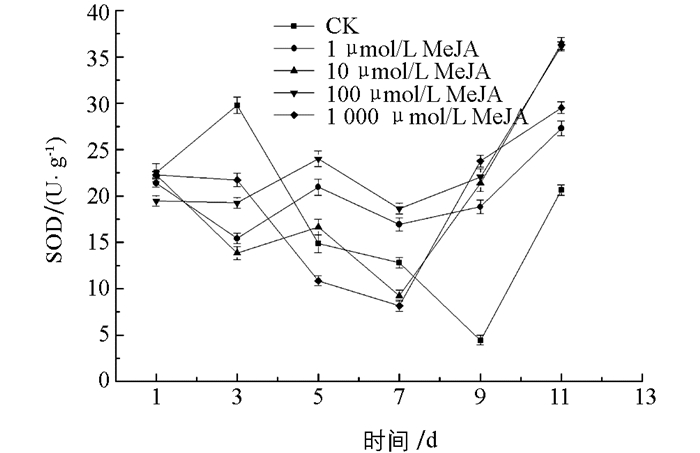
图 10中,在1~7 d贮藏期间,所有的茉莉酸甲酯处理组POD酶活性均高于对照组(CK),且差异有统计学意义(p<0.05),在第3,7 d时,100 μmol/L处理组POD酶活达到最大值,分别为对照组的7.04,1.92倍.实验发现,茉莉酸甲酯处理组的POD酶活性最大值接近3 000 μ/g,远高于其他3种抗性诱导材料,说明茉莉酸甲酯提高金针菇POD酶活性的效力高于其他3种抗性诱导材料,且相关研究表明POD酶与植物抗病性具有正相关关系[20]. 图 11可以看出,100 μmol/L茉莉酸甲酯处理组在整个贮藏期间CAT酶活性保持较高水平,且在贮藏前8 d,该处理组CAT酶活均高于对照组及其他处理组. 图 12中,茉莉酸甲酯处理后,效果主要体现在贮藏中后期,1 μmol/L与100 μmol/L处理组SOD酶活性从第5 d开始均高于对照组,差异有统计学意义(p<0.05),100 μmol/L处理组优于1 μmol/L处理组,在贮藏9~11 d,所有处理组SOD酶活性均高于对照组,差异有统计学意义(p<0.05),且100 μmol/L处理组SOD酶活性急速上升至最大值,高于其他处理组和对照组.
综上所述,茉莉酸甲酯处理金针菇可使POD,CAT,SOD酶活性维持在一个较高水平,尤其对提高POD酶活具有较好效果,且选择100 μmol/L茉莉酸甲酯处理作为最佳浓度.
2.1. 壳聚糖诱导剂对金针菇抗氧化酶活性的影响
2.2. 水杨酸诱导剂对金针菇抗氧化酶活性的影响
2.3. 苯并噻重氮诱导剂对金针菇抗氧化酶活性的影响
2.4. 茉莉酸甲酯诱导剂对金针菇抗氧化酶活性的影响
-
抗性诱导剂通过激发金针菇自身防御系统,提高其活性氧代谢系统活性,增强了对采后病害的抵抗能力,较好地维持了采后金针菇的品质.通过这4种抗性诱导剂处理后的金针菇,其POD,CAT,SOD酶在不同时期均有所增加,表明了金针菇自身产生了抗性反应,在一定程度上减缓了衰老、保持了其品质,同时实验得出了壳聚糖、水杨酸、苯并噻重氮、茉莉酸甲酯的最佳处理浓度分别为0.75 g/L,0.5 mmol/L,0.75 mmol/L,100 μmol/L.







 DownLoad:
DownLoad: