-
玉米黏虫(Mythimna separata)是一种常见的农业害虫,属鳞翅目、夜蛾科,又名行军虫.成虫体长17~20 mm,淡灰褐色或黄褐色,雄蛾体色较深[1].玉米黏虫主要为害玉米、水稻等粮食作物,幼虫期暴食作物叶片,严重时可造成农作物减产甚至绝收[1-2].玉米黏虫在我国多地均有不同程度的发生,且对当地的农作物均造成了不同程度的伤害[3].目前主要采用化学防治措施来防治农业害虫,但频繁使用化学农药会造成农药残留、环境污染以及昆虫抗药性等诸多问题[4].因此,需要一种新的防治策略来解决目前遇到的困难.
微生物与植物在漫长的进化过程中逐渐形成了互惠互利的关系[5].除了互相提供营养物质以供对方生长外,有些致病微生物,尤其是虫生真菌,能将害虫的种群数量长期控制在较低水平以下[6].虫生真菌是昆虫病原微生物的最大类群,据不完全统计,世界上已记载的虫生真菌约100属1 000多种[7],而我国已发现的虫生真菌涵盖40多个属400多个种[8],包括白僵菌属(Beauveria)、绿僵菌属(Metarhizium sorokin)、青霉属(Penicillium)和镰刀菌属(Fusarium)等.虫生真菌侵染昆虫的过程主要包括识别寄主、机械破坏、分泌毒素和干扰代谢等,各种因素的共同作用导致寄主昆虫死亡[8].利用虫生真菌防治害虫,不仅对环境无污染、不易产生抗性,而且可以持续控制靶标害虫[9],故利用虫生真菌防治农林害虫已成为害虫控制的一种新趋势.
草地贪夜蛾(Spodoptera frugiperda)是一种被联合国粮农组织全球预警的跨国迁飞性农业重大害虫,属鳞翅目、夜蛾科,又名秋黏虫,主要为害玉米、水稻和甘蔗等作物[10],具有很强的迁飞扩散和暴发取食能力[11].草地贪夜蛾自2019年1月份入侵我国云南后,快速迁飞到长江中下游、黄淮、华东、东北和西北等地[12],目前已经入侵了25个省. 2019年7月在江津高粱地中发生了草地贪夜蛾危害,本课题组在采集草地贪夜蛾样本时,发现该块高粱地也同时存在大量玉米黏虫,并发现部分死亡的玉米黏虫僵虫.故推测从玉米黏虫僵虫体内分离获得的虫生真菌对草地贪夜蛾也可能存在一定的杀伤作用,并依此开展了实验研究.
本实验以采自重庆江津高粱地中的玉米黏虫僵虫为实验材料,运用传统培养方法分离纯化真菌,通过形态学观察和分子生物学鉴定等方法确定真菌的分类.希望能够发现对玉米黏虫和草地贪夜蛾有致病力的真菌,为玉米黏虫和草地贪夜蛾的生物防治提供更为丰富的虫生真菌资源.
HTML
-
玉米黏虫幼虫僵虫两只:采自重庆江津高粱地中,一只僵虫上附有绿色霉状物,一只附有些许白色粉状物.
-
马铃薯葡萄糖琼脂培养基(PDA)(1 000 mL:马铃薯200 g,葡萄糖20 g,琼脂16 g);ITS1,ITS4引物(上海生工生物工程股份有限公司);Dream Taq PCR酶(Thermofish).
-
玉米黏虫僵虫样本的分离纯化工作均在超净工作台中进行.在PDA培养基上涂布20 μL氨苄青霉素和20 μL卡那霉素,晾干后备用.将黏虫虫体浸入75%的乙醇溶液中,消毒5 s,再用灭菌水漂洗3次.用灭菌滤纸吸净水分后,剪开虫体,将其放置于准备好的PDA平板上.将PDA平板放置于30 ℃恒温培养箱中培养,定期观察.待虫体周围长出菌丝后,挑取菌丝转至新的PDA平板上.重复3次后,挑取单菌落进行分离纯化.
-
将分离纯化的菌株接种到PDA平板中央,置于30 ℃恒温条件下培养,定期观察菌落生长情况,记录其颜色及形态,并且在光学显微镜下观察菌丝及孢子形态,参考真菌鉴定手册[13],对分离到的菌株进行形态学鉴定.
-
使用CTAB法[14]提取菌株的基因组DNA,用NanoDrop ND-2000仪器测定其浓度,-20 ℃保存.采用真菌通用引物ITS1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC -3')进行ITS序列扩增,将扩增产物送往上海生工生物工程股份有限公司测序.
反应体系:模板DNA 2.5 μL,引物ITS1/ITS4各1 μL,Dream Taq酶12.5 μL,无菌水补足至25 μL.
反应程序:94 ℃预变性5 min;94 ℃变性30 s,51 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃延伸10 min.
将测序所得基因序列与GenBank数据库中保存的基因序列进行比对,从中选择下载同源性较高的序列,使用MEGA5.2软件,运用NJ法进行1 000次步长计算,构建系统发育进化树.
1.1. 供试昆虫
1.2. 供试培养基与主要试剂
1.3. 玉米黏虫虫生真菌的分离纯化
1.4. 菌株形态学鉴定
1.5. ITS序列鉴定
-
本次实验从玉米黏虫僵虫样本上共分离得到6株真菌,分别编号为:JJ1-1,JJ1-3,JJ1-4,JJ1-5,JJ3-1,N1-1.
-
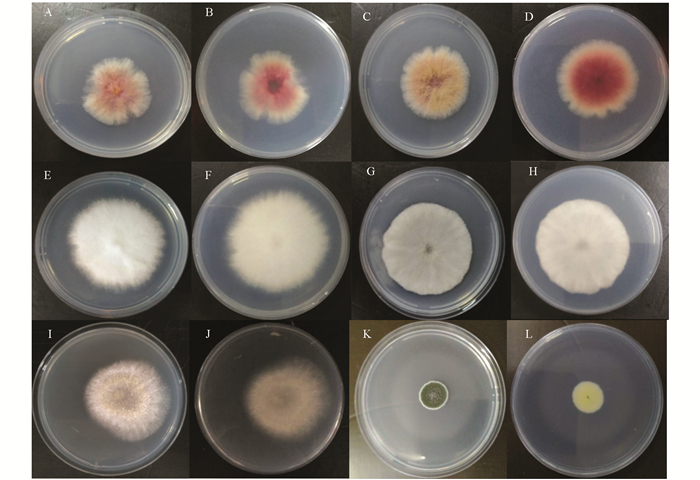
1) 菌株JJ1-1(图 1A为平板正面,图 1B为平板背面),正面边缘呈白色,中间呈现黄色和红色,菌丝发达,绒毛状;菌落背面边缘呈白色,中间呈红色;菌落较为干燥,不透明.
2) 菌株JJ1-4(图 1C为平板正面,图 1D为平板背面),正面边缘呈白色,中间呈现黄色和红色,菌丝发达,绒毛状;菌落背面边缘呈白色,中间呈红色;菌落较为干燥,不透明.
3) 菌株N1-1(图 1E为平板正面,图 1F为平板背面),正面和背面均呈白色,菌丝浓密发达、绒毛状;菌落较为干燥,不透明.
4) 菌株JJ1-5(图 1G为平板正面,图 1H为平板背面),正面和背面均呈白色,菌丝致密,绒毛状;菌落较为干燥,不透明.
5) 菌株JJ3-1(图 1I为平板正面,图 1J为平板背面),正面和背面均边缘呈白色,中心为黄色;菌落较为干燥,不透明.
6) 菌株JJ1-3(图 1K为平板正面,图 1L为平板背面),初期呈白色,质地紧密且菌丝较短;孢子呈深绿色,大量产生、易脱落;菌落外缘有一圈白色菌丝;菌落背面呈淡黄色;菌落较为干燥,不透明.
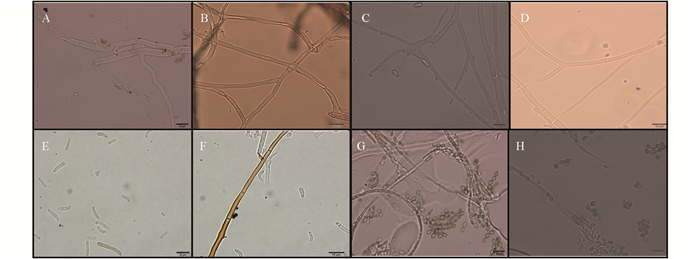
1) 菌株JJ1-1(图 2A),菌丝有隔,分枝.
2) 菌株JJ1-4(图 2B),菌丝有隔,分枝.
3) 菌株N1-1(图 2C),菌丝有隔,分枝;分生孢子呈卵圆形或长柱形.
4) 菌株JJ1-5(图 2D),菌丝有隔,分枝.
-
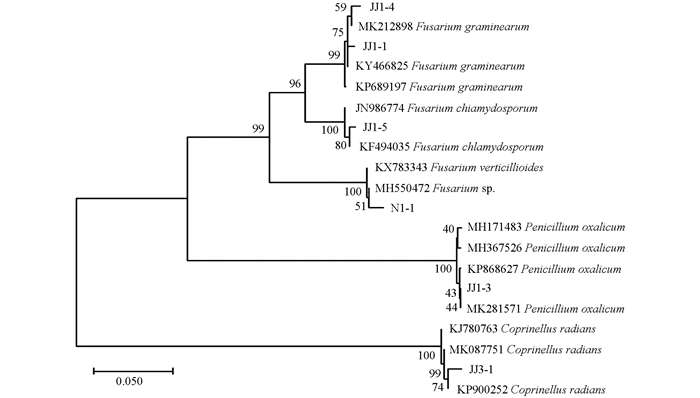
将各菌株测序所得序列在GenBank数据库中进行BLAST比对,选取相关序列通过MEGA 5.2使用NJ进行1 000次步长计算,构建系统发育树.与形态学结果相结合,将菌株JJ1-1,JJ1-4,JJ1-5,N1-1归类于镰刀菌属(Fusarium);JJ1-3归类于青霉属(Penicillium);JJ3-1归类于鬼伞属(Coprinellus).
在基于rDNA ITS序列片段构建的系统发育进化树中,从玉米黏虫僵虫上已分离得到的真菌形成了不同的分支:菌株JJ1-1与Fusarium graminearum(KY466825)聚为同一分支;JJ1-4与Fusarium graminearum(MK212898)聚为同一分支;JJ1-5和Fusarium chlamydosporum(KF494035)聚为同一分支;N1-1和Fusarium sp.(MH550472)聚为同一分支;JJ1-3和Penicillium oxalicum(KP868627)和Penicillium oxalicum(MK281571)聚为同一分支;JJ3-1和Coprinellus radians(KP900252)聚为同一分支.由此可知,在此次实验所得的镰刀菌属真菌中,很有可能有3个镰刀菌种:JJ1-1和JJ1-4更接近于同一个镰刀菌种Fusarium graminearum,JJ1-5和N1-1分别为另外的两个镰刀菌种.从玉米黏虫僵虫上已分离得到的真菌的系统发育树见图 3.
2.1. 真菌菌株形态学鉴定
2.2. 真菌菌株的分子生物学鉴定
-
本次实验以重庆江津高粱地中的玉米黏虫僵虫为样本,共分离得到了3个属6株真菌,分别归类于镰刀菌属(Fusarium)、青霉属(Penicillium)和鬼伞属(Coprinellus).
已有研究报道表明,虫生镰刀菌(Fusariumsp)可作为昆虫病原菌,对昆虫起到杀灭作用.例如,嗜蚧镰刀菌(F. coccophilum)可寄生多种蚧壳虫,对控制蚧壳虫虫口密度具有重要作用;木贼镰刀菌(F. equiseti)可用于防治菜青虫;串珠镰刀菌(F. moniliforme)可用于棉蚜的田间防治[15]等.镰刀菌属(Fusarium)的许多真菌可寄生于昆虫,包括黑蚁成虫、麻天牛成虫、华北蝼蛄若虫、日本菱蝗若虫和种蝇成虫等[16].镰刀菌可以通过产生某些代谢产物杀死根结线虫的卵粒后再定殖于卵,或影响卵的发育[17].此外,镰刀菌易产生厚垣孢子,又为土壤习居菌,在极端的土壤条件下也能存活定殖,因此作为根结线虫生防菌具有很大的潜力[18].但是,镰刀菌属(Fusarium)同时也是多种经济作物最重要的病原真菌之一,属内的多个种均可侵染玉米引起茎基腐病[19],其产生的次生代谢毒素对人类和动物均有毒害作用,甚至可以致癌[20].
青霉属(Penicillium)真菌在世界上广泛分布,但是关于将青霉属(Penicillium)真菌用作生防菌防治害虫的报道却比较少.孙涛等[21]在鱼藤属植物内发现了一株内生青霉菌,研究后发现其代谢产物具有杀灭蚜虫的能力.也有研究表明,从青霉属(Penicillium)真菌中可以筛选到红青霉素和青霉酸等有明显杀灭昆虫活性的物质[22].同时也发现青霉属(Penicillium)真菌可以寄生于多种昆虫,使其染病甚至死亡,例如落叶松八齿小蠹成虫、小猿叶甲成虫(鞘翅目)、黑蚁成虫、斑须蝽若虫(半翅目)、棉蚜成虫(同翅目)和印度大蚕蛾等[22].有报道显示:草酸青霉菌的发酵液对植物寄生线虫有明显的的毒杀作用,不同浓度的发酵液对大豆胞囊线虫2龄幼虫均具有毒杀作用,对卵的孵化也有一定的抑制作用[23].由此可见,利用青霉属(Penicillium)真菌防治农作物病虫害是很有研究价值的.但是,青霉属(Penicillium)内的多个种也是植物病原菌,例如可以引起枣果霉烂[24].
而关于鬼伞属(Coprinellus)真菌用作生防菌防治昆虫的报道比较少,大多都是用于防治线虫.研究发现,鬼伞属(Coprinellus)真菌的杀线虫活性与杀线虫毒素密切相关,毛头鬼伞(C. comatus)含有多种杀线虫毒素,可以捕杀全齿复活线虫和根结线虫[25].青岛农业大学的学者[26]曾将一株辐毛小鬼伞应用于防治小麦禾谷孢囊线虫病害.因此,利用鬼伞属(Coprinellus)真菌防治农作物害虫是有一定的潜力的.
虫生真菌的宿主种属特异性较强,不同菌株的宿主谱和毒力的差别也比较大,因此分离鉴定更多的菌株有助于丰富虫生真菌资源,为虫生真菌生防农药的开发提供更多的材料[27].鉴于当前很难获得玉米黏虫与草地贪夜蛾的幼虫,本实验中分离到的虫生真菌对玉米黏虫和草地贪夜蛾幼虫的毒力还未能测定,有待于进一步的研究.






 DownLoad:
DownLoad: