-
开放科学(资源服务)标志码(OSID):

-
干旱是全球范围内广泛存在且仍在不断扩大的环境问题. 干旱胁迫严重影响着植物的生长发育,对植物造成的伤害远远超过其他逆境因子[1]. 因此,如何缓解干旱胁迫对植物生理特性的损伤和生长的限制是现代植物研究的重要课题.
红椿(Toona ciliata Roem.)主要分布于东南亚地区,是中国热带、亚热带地区的珍贵速生用材树种,被称为“中国桃花心木”,同时具有一定的药用价值. 红椿在我国分布范围较广,但因其天然林呈零星分布,自然更新能力较差,已成为渐危树种,被列为国家二级重点保护野生植物[2-3]. 目前有关干旱胁迫对红椿的影响已有初步研究,刘球等[4]用精胺修复干旱胁迫对红椿幼苗造成的形态和生理损伤,发现喷施精胺对干旱胁迫缓解作用显著,并能提高植株持续抗旱能力. 孙洪刚等[5]发现水分胁迫对红椿根系生长的限制作用明显大于苗高,对地径限制作用不明显;随着胁迫程度增加,根质量比表现出先增大后减小,叶质量比在处理初期和中期增大,后期和末期降低,茎质量比始终保持增加的趋势. 吴际友等[6]对红椿无性系幼苗进行干旱胁迫,发现重度干旱胁迫使红椿幼苗中的含水量下降,叶绿素质量分数增高,说明红椿无性系对干旱胁迫有较强的抗逆性. 然而目前对如何缓解红椿干旱胁迫、提高红椿耐旱能力方面仍有待进一步研究. 由于木本植物具有相对复杂的抗旱机制,本试验选取了3种常见的干旱胁迫外源缓解物质,研究其对红椿干旱胁迫的缓解作用,探究不同外源物质对红椿干旱胁迫的缓解机制,以期为缓解红椿干旱胁迫提供理论基础.
HTML
-
试验材料为1年生红椿幼苗,于2019年7月初移栽至西南大学后山苗圃. 选择苗高1.0 m,地径1.8 cm左右的长势均匀、无病虫害的健康红椿幼苗装盆,盆钵口径25 cm,深20 cm,每盆装土5 kg,原土与泥炭土比例为2∶1,统一配盆垫,进行正常浇水管护.
-
2020年7月取长势一致的健康红椿盆栽苗浇透水后放置棚内,根据20世纪60年代以来重庆地区以轻旱和中旱为主,夏秋两季略强的特点选择中度干旱强度[7]并参照气象干旱等级国家标准(GB/T20481-2006)取中度干旱(40%<H湿度≤50%,H湿度为土壤相对湿度)中间值45%为控水区间中值进行胁迫及干旱缓解试验. 结合预试验和文献,设置3个干旱缓解组:茉莉酸甲酯处理组(MeJA,0.4 mmol/L)、褪黑素处理组(MT,0.1 mmol/L)、水杨酸处理组(SA,0.5 mmol/L),2个对照组:干旱对照组(MD)和正常供水组(CK),干旱对照组设置土壤相对湿度区间为45%±3%,正常供水组设置土壤相对湿度区间为70%±3%,每组3株,重复3次(表 1). 3个处理组在干旱胁迫开始前3 d叶面喷施处理液,当处理组土壤相对湿度达到45%时(中度干旱)再进行1次处理液补喷,固定在每天18:00喷施叶片正反两面,以叶片充分润湿但无水珠滴落为标准,干旱对照组喷施纯水. 在第3 d喷施处理液后将各处理组浇透水开始自然干旱,当处理组土壤相对湿度达到45%时开始控水,以便携式土壤水分仪(Delta-T wet sensor)控制下限、称质量法控制上限维持缓解组和干旱对照组土壤相对湿度为45%±3%,正常供水组维持土壤相对湿度为70%±3%,在中度干旱后的第10 d进行指标测定.
-
1) 生长指标测定2次,分别在喷施处理前和中度干旱胁迫10 d后进行,本试验中生长指标测定间隔为27 d. 用软尺测量各植株株高,从土壤表面量至植株顶端;用游标卡尺测量地径,测量位点选择贴近土壤表面的基部,并用马克笔做记号,以确保每次测量位置的准确. 选取新梢往下第3~5叶序的功能叶,用游标卡尺分别测量复叶长、小叶长、小叶宽、叶柄长,每个指标重复测量6次.
2) 生理指标测定在达到中度干旱胁迫10 d后在各组随机摘取完整叶片进行测定,各指标均进行3次重复. 叶片相对含水率测定采用烘干法;叶绿素质量分数测定采用丙酮提取法;可溶性糖质量分数和淀粉质量分数测定采用蒽酮比色法[8];可溶性蛋白质量分数测定采用考马斯亮蓝G250染色法[8];游离脯氨酸质量分数测定采用茚三酮比色法[9];丙二醛(MDA)质量分数测定采用硫代巴比妥酸法[10];过氧化氢(H2O2)质量分数测定采用碘化钾法;超氧阴离子(
${\rm{O}}_2^{\bar \cdot }$ )质量分数测定采用盐酸羟胺氧化法[11]. -
由于各指标间纲量不同,在分析前先对数据进行标准化,再对无纲量新指标矩阵进行统计分析,计算主成分特征根、方差贡献率和各指标相关系数矩阵. 分析结果以特征值大于1,累积方差贡献率大于70%为标准提取主成分,再根据主成分中各指标方差贡献率的大小,分析外源物质缓解红椿干旱胁迫的关键生理指标.
-
利用Excel 2016软件进行数据处理和作图,取值用x±s表示;采用SPSS 19.0软件进行统计分析及主成分分析,其中采用One-Way ANOVA进行单因素方差分析,LSD分析法进行多重比较.
1.1. 试验材料
1.2. 试验处理
1.3. 各项指标测定
1.4. 主效应分析
1.5. 数据分析
-
在干旱胁迫下红椿地径、株高、复叶长、小叶宽生长增量出现显著下降(p<0.05),而小叶长生长增量下降无统计学意义(p>0.05). 3种外源缓解物质的喷施能够使红椿生长增量整体呈现提升,但MeJA对地径生长、MT对株高生长有限制作用. MT使株高以外各部分生长增量小幅提升,但差异无统计学意义(表 2).
-
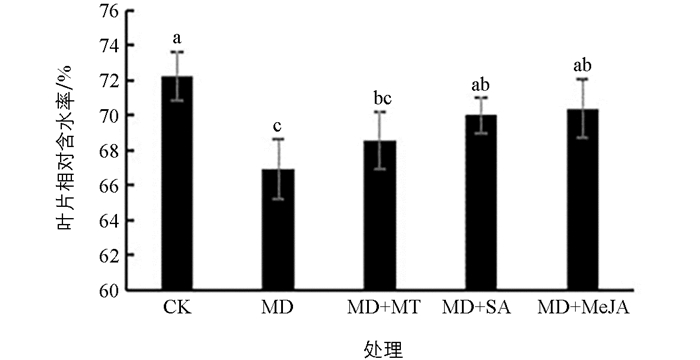
叶片相对含水率可以直观反映植株的受干旱协迫的情况. 中度干旱胁迫下红椿叶片相对含水率显著下降(p<0.05),降幅为7.39%. 3种缓解物质中,SA和MeJA能够显著提高干旱胁迫下红椿叶片的含水率(p<0.05),增幅分别为4.63%和5.17%,而MT的提升无统计学意义(p>0.05),增幅仅为2.47%(图 1). 3种外源物质对红椿干旱的缓解作用由大到小依次为MeJA,SA,MT.
-
干旱胁迫使红椿叶绿素(Chl)质量分数显著下降(表 3),叶绿素a(Chla)、叶绿素b(Chlb)和叶绿素(a+b)质量分数降幅分别为26.89%,38.25%,30.88%. 喷施外源物质的处理中,SA组和MeJA组较干旱对照组出现上升,MT组则出现下降,但均未达到统计学意义. 3种外源物质对红椿干旱的缓解作用由大到小依次为SA,MeJA,MT.
-
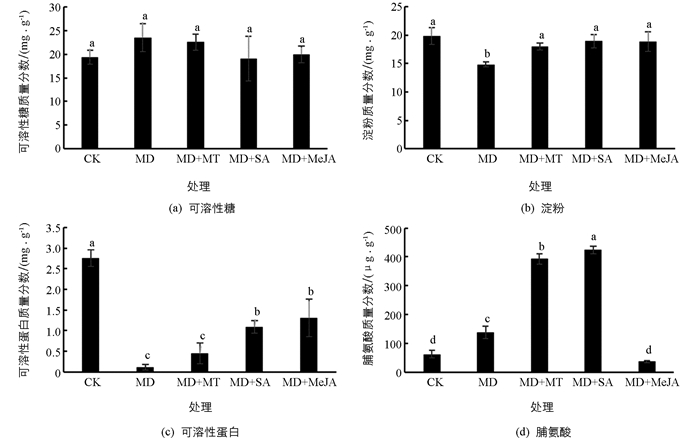
中度干旱胁迫下,红椿叶片中可溶性糖质量分数上升(图 2a),而淀粉质量分数显著下降(图 2b),可溶性糖与淀粉比值上升,增幅达到61.22%. 在缓解组中,3种外源物质均使可溶性糖质量分数小幅下降,其中SA组降幅最大,相较于干旱对照组降低了18.45%. 3种外源物质的缓解作用由大到小依次为SA,MeJA,MT. 在降低可溶性糖质量分数的同时,3种外源物质使红椿叶片中淀粉质量分数显著上升,按效果由大到小依次为SA,MeJA,MT,但3种外源物质组间差异无统计学意义.
与对照组相比,干旱组的可溶性蛋白质量分数显著下降(图 2c),降幅达到了95.9%. 3种外源物质中,SA和MeJA显著提高了红椿叶片中可溶性蛋白的质量分数,分别提升至对照组的39.35%,47.29%,MT对可溶性蛋白的提升作用较小,提升至对照组的16.25%. 3种外源物质对红椿干旱的缓解作用由大到小依次为MeJA,SA,MT.
与对照组相比,中度干旱胁迫使红椿叶片中脯氨酸质量分数显著提升(图 2d),增幅为122.02%. 在喷施外源物质的3个处理中,喷施MT和SA的处理组叶片游离脯氨酸质量分数较对照组显著上升,增幅分别为530.00%和579.71%;喷施MeJA的处理组脯氨酸质量分数较对照组下降,降幅达到40.99%. 3种外源物质对红椿干旱的缓解作用由大到小依次为SA,MT,MeJA,而MeJA起负面作用.
-
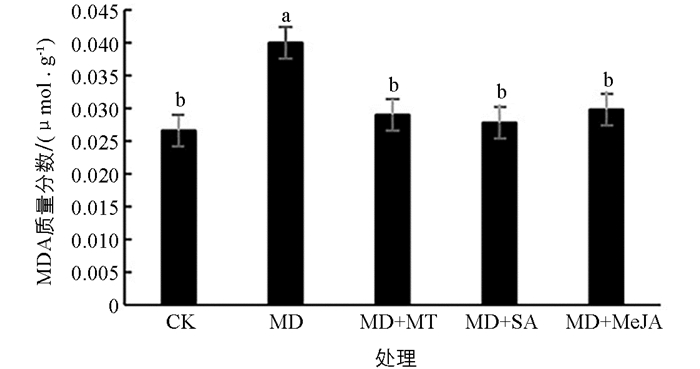
干旱胁迫使红椿叶片中MDA质量分数显著增加(图 3),增幅为53.85%. 3种外源物质均使MDA质量分数显著下降,3种外源物质间缓解效果差异无统计学意义,与干旱对照组相比降幅在27.50%左右. 3种外源物质对红椿干旱的缓解作用由大到小依次为SA,MT,MeJA.
-
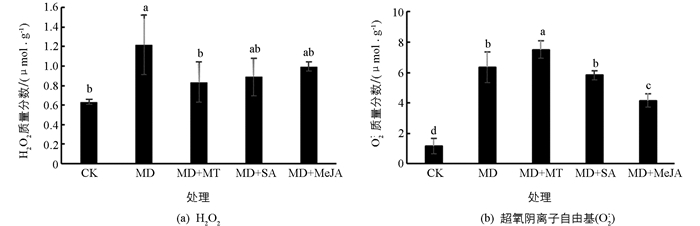
相较于对照组,中度干旱使红椿叶片中活性氧过氧化氢(H2O2)质量分数显著提升(图 4a),增幅达到92.42%. 喷施外源物质的处理组其叶片中H2O2质量分数均出现下降,SA和MeJA使H2O2质量分数较干旱对照组出现了小幅下降,但差异无统计学意义,降幅分别为27.09%和18.23%;MT组H2O2质量分数显著下降,降幅达到31.36%. 3种外源物质作用由大到小依次为MT,SA,MeJA.
在中度干旱胁迫下,红椿叶片超氧阴离子自由基(
${\rm{O}}_2^{\bar \cdot }$ )质量分数的增加更为显著(图 4b),增幅达到452.17%. 在3种外源物质缓解处理中,MeJA显著降低了红椿叶片中的${\rm{O}}_2^{\bar \cdot }$ 质量分数,较干旱对照组降幅为34.33%;SA作用无统计学意义,${\rm{O}}_2^{\bar \cdot }$ 质量分数较干旱对照组降幅为8.19%;而MT使${\rm{O}}_2^{\bar \cdot }$ 质量分数显著上升,较干旱对照组增幅为18.11%. 3种外源物质作用由大到小依次为MeJA,SA,MT,而MT起负面作用. -
对红椿干旱胁迫和缓解过程中的8项生理指标进行标准化后的主成分方差贡献率分析,得出各成分初始特征值及贡献率、分级指标成分因子载荷矩阵. 按特征值大于1的要求提取,得出成分1、成分2两个主因子,包含了8项指标中73.473%的信息量,具有较高的代表性(表 4). 将选取的2个主因子作为主成分进行分析,主成分1中MDA,H2O2,
${\rm{O}}_2^{\bar \cdot }$ 3个指标有较高的载荷,为决定因子,主成分2则主要由脯氨酸决定. 在成分因子载荷矩阵中,各个指标检测值的绝对值大小反映着其对该主成分的贡献率,通过对各主成分中指标贡献率进行比较可以看出,H2O2,MDA,${\rm{O}}_2^{\bar \cdot }$ 在8项指标中具有较高的代表性,贡献率由大到小依次为H2O2,MDA,${\rm{O}}_2^{\bar \cdot }$ (表 5). 而H2O2,MDA,${\rm{O}}_2^{\bar \cdot }$ 均为反映植物过氧化程度的指标,由此可以推断,干旱胁迫下植株过氧化可能是造成红椿干旱伤害的主要原因,H2O2,MDA,${\rm{O}}_2^{\bar \cdot }$ 等可能是决定红椿干旱胁迫的关键因子,可作为红椿干旱胁迫过程中的代表性指标.
2.1. 3种外源缓解物质对红椿幼苗生长的影响
2.2. 3种外源缓解物质对红椿叶片含水率的影响
2.3. 3种外源缓解物质对红椿叶绿素质量分数的影响
2.4. 3种外源缓解物质对红椿叶片渗透调节系统的影响
2.5. 3种外源缓解物质对红椿叶片膜脂过氧化的影响
2.6. 3种外源缓解物质对红椿叶片活性氧质量分数的影响
2.7. 主效应分析
-
干旱是制约植物生长发育的重要因素,较其他逆境因子对植物伤害更大、存在更广泛[12-13]. 在干旱胁迫下,植物细胞分裂受到抑制,生物量分配倾向于地下部分,导致植株地上部分矮小、生长缓慢,各器官生长发育迟缓,而根冠比增加. 同时,光合作用作为植物生产力形成的核心环节对水分亏缺较为敏感[14-16]. 在干旱胁迫下植物光合能力降低,叶片中的叶绿素分解出现叶色变浅发黄等表观特征,植物可积累的生物量也随之下降. 本试验中红椿幼苗各部分生长增量和叶片中叶绿素质量分数均在干旱胁迫下下降,说明中度干旱胁迫限制了红椿幼苗的生长和光合作用. 在分别喷施外源物质后,SA和MeJA使红椿生长增量得到显著提升,但MeJA对红椿地径生长有明显的限制作用,这与田力[14]的结果相似. 而MT对红椿株高有限制作用,且对其余各部分生长增量均没有显著提升,这可能是受到了光合能力下降的影响. 在本试验的3种外源物质中,MT对提升叶绿素质量分数的作用最弱,该组各类叶绿素质量分数较干旱对照组差异无统计学意义.
在干旱胁迫下,植物能够通过调节生理代谢抵御、缓解或修复胁迫造成的伤害,这些自发的调节体现着植物本身的耐旱性. 植物在缺水、失水条件下增加体内各类渗透调节物质质量分数,维持细胞膨压和胞内各器官的膜透性,以保证细胞的正常生理功能[17-18]. 在这些渗透调节物质中,可溶性糖和脯氨酸被认为是最重要的两类[19]. 可溶性糖和淀粉是植物体内非结构性碳水化合物(NSC)的重要组成部分,占比在90%以上,在一般的研究中以二者之和代指NSC质量分数. 在适宜条件下,植物通过光合作用储备NSC,其质量分数受到光照强度的调节,可用于夜间、冬季、胁迫等条件下的新陈代谢和生理防御[20-21]. 在遭遇干旱胁迫时,植物体内淀粉分解为可溶性糖,增大细胞渗透压以维持水分,这时可溶性糖与淀粉质量分数比值上升,而NSC质量分数随着代谢消耗下降[22-23]. 本试验中,红椿幼苗在干旱胁迫下的可溶性糖和淀粉质量分数变化符合一般规律,可溶性糖和淀粉比值上升而NSC质量分数下降. 在喷施外源物质的3个处理组中NSC质量分数出现上升,但可溶性糖和淀粉的比值下降,这可能是由于多种生理调节物质存在相互作用的结果. 大量研究表明,干旱胁迫下植物内脯氨酸质量分数常出现急剧增长,这与本试验中的结果一致:红椿幼苗在干旱胁迫下体内脯氨酸质量分数增幅达到122.02%,在喷施MT和SA的处理中脯氨酸增幅更大,分别达到了530.00%和579.71%,这说明增加脯氨酸质量分数是红椿调节渗透压的重要途径. 与之相反,红椿叶片中可溶性蛋白质量分数在干旱胁迫下反而出现急剧下降,在喷施外源物质后则出现不同程度的上升. 这可能是由于木本植物与草本植物的耐旱机制存在差异. 如张强等[24]对不同种源香椿在干旱胁迫下生理特征的研究中发现,6个种源香椿中仅有2个种源香椿在干旱胁迫下可溶性蛋白质量分数上升,其余皆出现下降. 王晶英等[25]的研究发现银中杨在干旱胁迫下叶片可溶性蛋白质量分数下降可能是由于细胞内肽酶活性增加导致蛋白质的合成受阻并加速分解.
干旱条件能够直接导致植物细胞原生质脱水,引起细胞膜结构和透性改变等一系列伤害. MDA是植物体内膜脂过氧化作用的最终分解产物,其质量分数是判断植物生物膜系统过氧化受损程度的重要指标[23]. 一般认为在干旱胁迫下MDA质量分数增幅较小的植物具有更好的耐旱性[24]. 在本试验中,中度干旱条件下红椿叶片中MDA质量分数显著增加,说明细胞膜功能受到抑制. 在喷施外源物质的3个处理组中,MDA质量分数均显著下降,说明3种物质均能有效缓解干旱条件导致的膜脂过氧化作用,其中SA缓解作用最好,但与其他2种物质在缓解效果上差异无统计学意义.
植物体内的酶促反应及一些氧化反应会产生活性氧物质如超氧阴离子自由基(
${\rm{O}}_2^{} $ )、过氧化氢(H2O2)等. 在正常条件下,植物细胞中活性氧的产生和清除处在动态平衡之中,但当植物受到外界不利条件胁迫时,这种平衡就会被打破,造成活性氧的大量积累. 这些物质能够氧化植物体内的核酸等大分子,攻击蛋白质的氨基酸残基形成羰基衍生物[26],造成二硫键的形成和蛋白质的断裂[27],并导致细胞膜膜脂过氧化,最终破坏细胞结构,造成植物细胞的死亡[28]. 其中H2O2可通过Haber-Weiss反应产生羟自由基(·OH),这种更为活跃的活性氧可提高部分蛋白质对水解酶的敏感性,造成蛋白质的降解[29]. 在本试验中,干旱处理使红椿叶片中H2O2和${\rm{O}}_2^{\bar \cdot }$ 质量分数显著上升,其中${\rm{O}}_2^{\bar \cdot }$ 质量分数增幅远大于H2O2,这可能是由于H2O2在植物体内并非稳定存在. 在喷施外源物质的3个处理中,H2O2质量分数较干旱对照组出现不同程度下降,其中MT处理组下降最为显著,而该处理对${\rm{O}}_2^{\bar \cdot }$ 没有清除效果,甚至使${\rm{O}}_2^{\bar \cdot }$ 质量分数出现显著上升. 与之相似的,SA与MeJA处理组在两种活性氧的清除上也显示出倾向性,其中喷施SA使H2O2和${\rm{O}}_2^{\bar \cdot }$ 质量分数较干旱对照组分别下降27.09%和8.19%,而MeJA组分别下降了18.23%和34.33%.
-
中度干旱条件下红椿生长受到抑制,MDA和活性氧质量分数上升,对植株造成胁迫;提高脯氨酸质量分数是红椿调节渗透压的重要途径;3种外源物质中,SA和MeJA的缓解效果高于MT;MDA、活性氧可作为缓解红椿干旱胁迫的关键指标.






 DownLoad:
DownLoad: