-
开放科学(资源服务)标志码(OSID):

-
龙眼(Dimocarpus longan Lour.)是原产于中国南部以及越南北部的典型亚热带果树,在中国已有2000余年的种植历史. 重庆作为中国最北缘的晚熟龙眼种植区,所收获的龙眼在9月上市,可满足市场的错季需求. 然而,重庆冬季偶有极端低温的发生,成为威胁北缘地区晚熟龙眼生产的气候因素之一[1-2].
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AM真菌)是农业生态系统中意义非凡的一类菌根真菌,它能够通过不同方式和途径影响多种植物的代谢过程[3-5]. 近年来的研究证实,接种摩西球囊霉(Glomus mosseae)和地表球囊霉(Glomus versiforme)能显著提高低温(15~5 ℃)胁迫下彩叶草(Plectranthus scutellarioides L.)叶片保护酶活性和渗透调节物质质量分数,降低丙二醛(MDA)质量分数和膜透性[6]. 一些学者[7-9]观察到接种AM真菌能够改善低温胁迫下玉米(Zea mays L.)幼苗的生长,提高叶片可溶性糖质量分数,进而增强幼苗的抗寒能力. 重庆冬季偶见有低温(4 ℃)寒害,持续一般4 d左右,这对起源于热带亚热带的龙眼来说可能是致命伤害. 基于生产实际和科学理论探索的需要,以重庆主栽龙眼品种蜀冠和油谭本实生苗作为试验材料,接种根内球囊霉(Glomus intraradices)菌剂,模拟重庆偶见的低温寒害环境,在先行梯度降温锻炼12 d后,再分别在4 ℃进行正式低温胁迫,探索低温胁迫下接种AM真菌对龙眼幼苗渗透调节平衡和保护酶活性等与抗寒性密切相关的生理代谢特征的影响,为菌根生物学技术在龙眼抗寒性育苗中的应用提供理论依据.
HTML
-
植物材料:龙眼(Dimocarpus longan Lour.)品种油谭本和蜀冠的实生苗.
AM真菌材料:根内球囊霉(Glomus intraradices),购自美国国际菌种保存中心(http://www.atcc.org/).
基质材料:按照菜园土、基质与河沙的比例5∶3∶1配制. 其pH值为7.0,有机质20.1 mg/kg,全氮1.4 mg/kg,全磷0.513 mg/kg,全钾27.0 mg/kg,交换性钙6.38 mg/kg,碱解氮111 mg/kg,速效钾350 mg/kg,有效磷48 mg/kg,有效铜0.53 mg/kg,有效锌0.4 mg/kg,有效铁2.66 mg/kg,有效锰26.4 mg/kg,有效钼0.203 mg/kg,有效硫105 mg/kg. 在121 ℃,0.05 MPa下高压蒸汽灭菌2 h备用.
营养液:改良的Hoagland营养液,每隔15 d施加25%的营养液.
营养钵:育苗塑料营养钵(上、下底直径和高分别为20,18,15 cm),用35%~40%的甲醛溶液浸泡20 min,自然晾干,之后用75%的酒精擦拭消毒待用.
-
2018年12月,由重庆市永川区经济作物技术推广站提供成熟健康的龙眼蜀冠和油谭本新鲜果实,取出种子进行表面消毒,无菌水浸泡4~7 d,待种皮裂口后,置于垫有2~3层湿润滤纸的无菌催芽系统中,25 ℃催芽3~4 d. 催芽后的种子播种于装有2/3灭菌基质的营养钵中,出苗后每钵留4株,两种实生苗各100钵. 25 ℃温室内培养1个月后,每株苗根际打孔穴接种9 g AM真菌菌剂(其中含有40个AM真菌活性孢子、大量的菌丝和菌根根段),对照每株根际加入9 g灭菌后的菌剂. 置于25~28 ℃,12 h光照/12 h黑暗温室中培养,每隔15 d适量浇灌25%改良的灭菌Hoagland营养液. 180 d后选取长势基本一致的龙眼菌根苗和非菌根苗各80盆(蜀冠和油谭本各40盆),于4 ℃,光强7 000 lx,光周12 h光照/12 h黑暗,相对湿度65%的人工气候培养箱中进行低温胁迫试验,25 ℃为对照. 正式胁迫前,低温胁迫苗置于人工气候培养箱中,分别在20,15和10 ℃进行梯度降温锻炼各4 d,之后以2 ℃/h的速率降温至4 ℃后保持恒定.
-
菌根侵染率:按照改良的方法[10]对龙眼根样进行固定、透明、染色和制片,在Motic数码显微系统中拍照和测量. 菌根侵染率(Rm)和菌根依赖性(Md)按照公式进行计算:
式中,Li为侵染根段长度(cm),Lo为观察根段长度(cm).
式中,Dm为菌根苗干质量(g),Du为对照苗全株干质量(g).
干质量(D):将对照和低温胁迫6 d后的试验苗从钵中取出,清洗完基质,晾去植株上多余的水分,将枝叶和根系分开,称鲜质量后,75 ℃恒温烘干,分别测量地上部和地下部干质量.
低温胁迫后的0,2,4和6 d时取叶片,用称量法测定相对含水量[11],考马斯亮蓝G250法测定可溶性蛋白质量分数[12],硫酸-苯酚法测定可溶性糖质量分数[13],硫代巴比妥酸法测定丙二醛质量分数,氮蓝四唑法测定超氧化物歧化酶(SOD)活性,紫外吸收法测定过氧化氢酶(CAT)活性,愈创木酚氧化法测定过氧化物酶(POD)活性[14].
1.1. 试验材料
1.2. 试验设计
1.3. 测定指标与方法
-
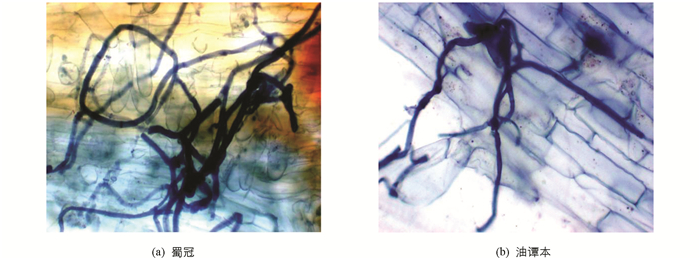
由表 1可知,未接种AM真菌的龙眼处理几乎无菌根侵染,接种处理龙眼苗则全部被侵染. AM真菌侵染过程中,在相应的根部细胞中可以清晰地观察到菌丝结构(图 1),表明根内球囊霉与龙眼根系能够形成良好的菌根共生关系. 研究发现,低温胁迫6 d时,AM真菌侵染率较常温呈现下降趋势,说明低温胁迫抑制AM真菌的形成. 此外,低温胁迫后,龙眼地上部和地下部干质量及其菌根依赖性均有所下降,但菌根苗干质量仍显著高于非菌根苗. 接种AM真菌在低温胁迫条件下对龙眼根系的侵染率有显著的正效应,预示植物的吸收能力在低温胁迫下仍能通过AM真菌菌丝而得到显著增强,对减轻低温伤害有积极意义(表 1).
-
接种AM真菌均提高了两种试验温度条件下龙眼叶片的相对含水量. 低温胁迫下,叶片相对含水量低,随胁迫时间的延长呈递减的趋势,说明低温胁迫使龙眼幼苗吸水较常温条件下困难. 未接种与接种AM真菌处理在25 ℃和4 ℃条件下培养6 d后,分别与各自的0 d相比较,接种蜀冠实生苗叶片的相对含水量分别降低1.3%和16.7%,未接种株实生苗叶片的相对含水量分别降低3.0%和24.7%;接种油谭本实生苗叶片的相对含水量分别降低1.5%和20.2%,未接种株实生苗叶片的相对含水量分别降低1.7%和23.2%(表 2). 结果表明,接种AM真菌不仅可以缓解龙眼叶片常温下的失水量,也可以稳定低温胁迫时蜀冠和油谭本实生苗叶片细胞的持水能力,改善植株的水分状况,维持水分的相对平衡,从而减缓了低温胁迫对龙眼叶内细胞正常代谢的伤害.
-
接种AM真菌均显著提高了两种试验温度条件下龙眼叶片可溶性糖和可溶性蛋白的质量分数(表 2). 低温胁迫条件下,随着胁迫时间的延长可溶性糖质量分数总体呈上升趋势,可溶性蛋白的质量分数总体呈先上升后下降趋势,4 d时达到最大值. 同时也观察到,无论常温处理还是低温胁迫条件下,菌根(接种AM真菌)龙眼苗叶片二者质量分数均高于非菌根(未接种AM真菌)龙眼苗. 在25 ℃和4 ℃培养条件下培养6 d,接种AM真菌后蜀冠叶片中可溶性糖质量分数比未接种株分别高出14.0%和8.8%,可溶性蛋白质量分数比未接种株分别高出16.7%和18.3%;接种油谭本实生苗叶片中可溶性糖质量分数比未接种株分别高出14.4%和12.4%,可溶性蛋白质量分数比未接种株分别高出18.8%和11.9%. 结果表明,低温胁迫条件下,龙眼幼苗叶片渗透调节紊乱,可通过接种AM真菌使得可溶性糖和可溶性蛋白质量分数迅速上升来弥补低温胁迫导致的代谢失衡,维持细胞渗透压的相对稳定,从而提高植株的抗逆性. 蜀冠叶片可溶性糖和可溶性蛋白质量分数要高于油谭本,更有利于降低细胞渗透势,对低温逆境有更强的适应性. 因此认为,低温胁迫条件下接种AM真菌可维持两龙眼品种实生苗细胞的膜脂稳定性,调节渗透平衡,减轻低温胁迫对龙眼的伤害.
接种AM真菌显著降低了两种试验温度条件下龙眼叶片的MDA质量分数和相对电导率(表 3). 低温胁迫条件下,随胁迫时间的延长(2,4和6 d),龙眼幼苗叶片MDA质量分数和相对电导率总体呈上升趋势;同时也观察到,菌根龙眼苗的MDA质量分数和相对电导率均低于同级温度条件下的非菌根苗. 在25 ℃和4 ℃条件下培养6 d,接种AM真菌后蜀冠实生苗的MDA质量分数、相对电导率分别比未接种株低15.6%,23.3%和6.8%,12.3%;接种株油谭本实生苗的MDA质量分数、相对电导率分别比未接种株低22.6%,10.2%和14.0%,13.3%(表 3). 结果表明,低温胁迫使龙眼细胞膜过氧化程度加剧,但已经接种过AM真菌的幼苗能降低叶片MDA质量分数和相对电导率,从而减缓逆境对龙眼幼苗细胞脂膜透性的伤害,进而提高植物的抗逆性. 因此认为,接种AM真菌可维持两个龙眼品种在遇低温胁迫时细胞膜的相对稳定性,减轻低温胁迫对龙眼的伤害.
-
接种AM真菌均显著提高了两种试验温度条件下龙眼叶片的SOD,POD和CAT活性. 低温条件下,龙眼幼苗叶片SOD,POD和CAT酶活性随胁迫时间的延长呈先升高后降低的趋势. 接种AM真菌后,菌根龙眼幼苗叶片SOD,POD和CAT酶活性均显著高于非菌根苗. 在25 ℃和4 ℃条件下培养6 d,接种株蜀冠实生苗叶片中SOD,POD,CAT活性分别比未接种株高出10.1%,31.1%,35.7%和5.7%,35.0%,59.6%;接种株油谭本实生苗叶片中SOD,POD,CAT活性分别比未接种株高出5.1%,12.4%,36.4%和10.1%,10.1%,44.6%(表 3). 结果表明,接种AM真菌都能显著提高龙眼叶片的抗氧化酶活性,尤其是在低温胁迫时,接种AM真菌能通过抑制叶片保护酶活性来提高龙眼对抗氧化酶活性的调节能力,减缓低温逆境造成的伤害,有效提高植物的抗寒能力. 蜀冠叶片SOD活性较油谭本更高,更有利于清除过氧化物,降低活性氧对植物的损伤,提高植物对低温逆境的适应性.
-
分别对蜀冠和油谭本实生苗进行9个抗性指标的相关性分析得到相关系数矩阵(表 4). 结果表明,低温胁迫后,蜀冠菌根侵染率与总干质量间,相对电导率与MDA间,可溶性蛋白与POD,CAT间,可溶性糖与SOD间,POD与CAT间呈极显著正相关. 相对电导率与可溶性蛋白,POD间,MDA与可溶性蛋白,POD间呈显著正相关. 相对含水量与相对电导率,MDA间呈极显著负相关;相对含水量与可溶性蛋白,POD间呈显著负相关(表 4).
油谭本菌根侵染率与总干质量间,相对电导率与MDA间,可溶性蛋白与可溶性糖,SOD,POD,CAT间,可溶性糖与SOD,POD,CAT间,POD与CAT间分别呈极显著正相关;相对电导率与可溶性蛋白,POD间,MDA与可溶性蛋白,POD间分别呈显著正相关. 相对含水量与相对电导率,可溶性蛋白,MDA,POD间分别呈极显著负相关(表 4).
相关性分析结果表明:低温胁迫环境中,蜀冠和油谭本实生苗的一些抗寒性生理代谢特征间存在着显著的相关性,因此使用这些相关性生理代谢指标,可以作为蜀冠、油潭本耐低温胁迫能力的重要判定指标.
2.1. 接种AM真菌提高了低温胁迫下龙眼菌根侵染率和生物量
2.2. 接种AM真菌维持低温胁迫下龙眼叶片含水量的相对稳定
2.3. 接种AM真菌调控低温胁迫下龙眼幼苗渗透平衡
2.4. 接种AM真菌调节低温胁迫下龙眼幼苗抗氧化酶活性
2.5. 抗性指标间的相关性分析
-
菌根效应能否发挥取决于AM真菌与宿主之间的亲和力,侵染率能够表明真菌对根皮层的感染情况,是AM真菌发挥效力的物质基础[15]. 姚青等[16]在接种AM真菌对龙眼实生苗营养生长与矿质营养的影响中发现,石硖接种地表球囊霉(Glomus versiforme)6个月后,其根系侵染率达38.9%. 本试验对蜀冠和油谭本接种根内球囊霉,根系侵染率为77.9%~85.6%(表 1),说明龙眼形成菌根具有普遍性. 低温胁迫条件下,AM真菌侵染率和干质量有所下降,说明低温胁迫抑制了菌丝的生长和入侵,进而降低了菌根的侵染率,吸收能力降低,干质量也随之下降. 但常温接种AM真菌后,菌根侵染率提高,吸收能力增强,促进了龙眼苗的生长,增加了干物质积累,从而提高了龙眼幼苗的抗寒性.
植物细胞内相对含水量与植物的代谢强度、生长速度及其抗性强弱密切联系[17]. 在低温胁迫下植物通常会通过降低叶片的含水量,从而提高细胞液浓度以降低冰点来抵御低温对自身的影响[18]. 本试验研究显示,无论接种或未接种,低温处理2 d时,叶片的相对含水量较常温没有显著的变化,说明2 d的低温胁迫对龙眼幼苗影响不大,处理4 d时叶片相对含水量显著下降,可能是由于植物为了在逆境中生存,进而通过提高细胞液的浓度来抵御低温对自身的伤害. 无论是常温或是低温,相比未接种苗,接种AM真菌后,龙眼苗叶片相对含水量提高. 这可能是由于低温胁迫下AM真菌能够通过菌丝利用根系无法利用的土壤水分来促进龙眼对水分的吸收,改善植株的水分状况,降低冷害的临界温度,从而提高植株的抗寒性.
可溶性蛋白和可溶性糖作为低温胁迫下的重要渗透调节物质,可作为衡量植物抗寒性的重要指标. 本试验研究发现,无论接种或未接种,对比常温,低温胁迫显著增加了龙眼叶片的可溶性糖与可溶性蛋白的质量分数;无论常温或低温处理,对比未接种处理,接种AM真菌均能提高龙眼叶片中可溶性蛋白和可溶性糖的质量分数. 这与其他植物的研究结果相呼应[19-21]. 可溶性糖质量分数持续上升的原因可能有2个方面:一是由于较低的温度胁迫导致细胞呼吸减弱致使消耗降低,同时迫使叶片淀粉大量水解,提高细胞质的浓度,从而有效的抵抗冷害. 孙存华等[22]关于低温(0 ℃,-5 ℃,-10 ℃,-15 ℃,-20 ℃,-25 ℃)对香樟膜脂过氧化和保护酶活性的影响以及姚远等[23]关于低温胁迫(10 ℃)对木薯幼苗叶片转化酶及可溶性糖质量分数的影响研究也印证了此观点;二是因为菌根形成后影响低温胁迫下植物的生理活动、促进细胞内渗透调节物质的积累,从而提高龙眼植株的抗低温能力.
大量研究表明:由逆境导致的活性氧积累及其引起的氧化胁迫是植物受冷害胁迫的重要原因[24, 25],因此,调节活性氧的产生和清除之间的平衡对于植物生长代谢平衡的维持以及对环境胁迫的适应至关重要. SOD,POD和CAT作为活性氧清除剂,在活性氧清除系统中扮演着重要的角色. 徐康[26]在低温胁迫条件下对茶梅(Camellia sasanqua Thunb)的研究发现,茶梅叶片内抗氧化酶活性随低温胁迫(4 ℃,-10 ℃)时间的延长呈现出先升高后降低的变化规律;而孟艳琼等[27]对低温胁迫下6种藤本植物的研究发现,不同低温胁迫(5 ℃,-5 ℃,-10 ℃和-20 ℃)条件下,6种藤本植物的SOD活性和CAT活性均显著升高;李晶等[28]对红松(Pinus koraiensis Sieb)幼苗研究发现,低温胁迫下(4 ℃),SOD,POD及其CAT的活性均逐渐下降. 本试验研究发现,无论接种或未接种,对比常温,在0 d,2 d,4 d和6 d胁迫期间内,随着低温胁迫时间的延长,龙眼叶片中SOD,POD和CAT活性均表现出先升高后降低的趋势. 在低温胁迫初期抗氧化酶活性增加有助于清除低温造成的龙眼细胞内的自由基积累,进而保护龙眼的细胞膜系统;后期抗氧化酶活性随着低温胁迫时间的延长急剧下降,可能是由于低温对植物造成的伤害最终打破了其体内的代谢平衡所致. 这与前人研究结果有相似之处也有不同之处,不同植物中,各抗氧化酶类对低温胁迫的响应不同可能是因为它们对逆境的耐性机制不同,也可能和植物种类、大小及培养温度有关. 无论常温或低温处理,对比未接种处理,接种AM真菌均显著提高了SOD,POD和CAT活性,说明低温胁迫条件下接种AM真菌可以通过显著诱导SOD,POD和CAT活性来减轻膜脂过氧化伤害以缓解低温对植物造成的影响,从而提高植物的抗寒性.
研究发现细胞内自由基代谢平衡伴随着低温冷害的延续最终会被破坏,将更有利于自由基的产生,从而引起和加剧膜脂过氧化的作用程度,作为膜脂过氧化最终产物的MDA随之将会增多[29]. 另外,植物细胞质膜透性会增大,随着向胞外电解质的大量渗漏,相对电导率也会相应增大[30]. 本试验研究显示,无论接种或未接种,对比常温,低温胁迫显著增加了龙眼叶片的MDA质量分数和相对电导率;无论常温或低温处理,菌根龙眼苗MDA质量分数和相对电导率显著低于非菌根苗,这可能是由于接种AM真菌上调了SOD,POD和CAT活性,导致植物细胞内活性氧自由基清除能力有所提高,平衡了细胞内自由基的产生与清除,降低了膜脂过氧化作用,最终导致了其质量分数的降低,缓解了低温导致的细胞膜损伤. 对其他植物的研究也证明了AM真菌可通过提高逆境中植物的抗氧化酶活性来降低MDA质量分数,缓解逆境造成的活性氧紊乱[31].
综合多项评价指标测定结果与分析认为,蜀冠和油谭本的抗寒性都较强,其叶片可以抵御4 ℃低温4 d左右的胁迫. 相同管理水平条件下,接种了菌根的蜀冠幼苗抗寒性更佳.
-
低温胁迫下,龙眼叶片的相对含水量降低,可溶性糖和可溶性蛋白质量分数显著增加,SOD,POD和CAT活性先升高后降低,MDA质量分数与相对电导率显著增加. 与未接种AM真菌的龙眼幼苗相比,接种了AM真菌的龙眼幼苗在低温胁迫下叶片含水量上升,可溶性糖和可溶性蛋白质量分数升高,SOD,POD和CAT活性显著提高,MDA质量分数和相对电导率则显著低于未接种苗. 综上,本研究认为龙眼幼苗接种AM真菌能改善龙眼叶片的水分吸收状态,提升渗透调节物质和抗氧化系统的活力,降低MDA质量分数和缓解电解质渗出,提升幼苗在低温胁迫下的抗寒能力.






 DownLoad:
DownLoad: