-
开放科学(资源服务)标志码(OSID):

-
维氏气单胞菌(Aeromonas veronii)为革兰氏阴性菌,广泛分布于各种水生环境中,可导致鱼类发生细菌性败血症(motile aeromonas septicaemia,MAS). 据报道,维氏气单胞菌感染翘嘴鲌(Culter alburnus)[1]、虹鳟(Oncorhynchus mikiss)[2]、泥鳅(Misgurnus anguillicaudatus)[3]、鳜鱼(Siniperca chuatsi)[4]、杂交鲟(Acipenser baerii ♀×Acipenser schrenckii♂)[5]、斑点叉尾鮰(Ictalurus punctatus)[6]、黄颡鱼(Pelteobagrus fulvidraco)[7]、克氏原螯虾(Procambarus clarkia)[8]等水产动物,可直接导致宿主发病或死亡.
根据病症,MAS大致分为两种类型:急性出血型败血症,表现为出血、弥散性坏死和组织水肿[9-10];慢性溃疡型综合症,以真皮溃疡形成为典型特征[11-12]. 病症表现往往与致病菌携带的毒力因子密切相关,而维氏气单胞菌的毒力因子主要有溶血素HlyA,气溶素AerA,热不稳定型细胞兴奋性肠毒素Alt,热稳定型细胞肠毒素Ast,极性鞭毛蛋白FlaA,侧鞭毛蛋白LafA,丝氨酸蛋白酶AspA,细菌3型分泌系统内膜成分AscV和AexT,纤毛蛋白BfpA和BfpG,σ54依赖性转录因子VasH,志贺样病毒Stx-1和Stx-2,外膜蛋白OmpA和脂肪酶Lip等[13-16].
胭脂鱼(Myxocyprinus asiaticus)是亚口鱼科鱼类在亚洲分布的唯一单型属、种,其体型别致,颜色艳丽,具有“亚洲美人鱼”的美称,极具研究和观赏价值. 近年来,由于胭脂鱼野外资源骤减,已被列为我国二级保护动物[17]. 虽然胭脂鱼人工繁殖已经成功,但养殖过程中病害频发成为限制其健康养殖的重要因素. 据报道,维氏气单胞菌感染可造成胭脂鱼严重患病,进而导致巨大的经济损失[18],但至今有关胭脂鱼感染维氏气单胞菌的组织病理研究还未见报道.
我们已在患病胭脂鱼组织中成功分离到1株强致病性维氏气单胞菌BBAv1[19],该菌株将被运用于本研究的人工感染实验中. 通过观察A. veronii感染后胭脂鱼肾(中肾、头肾)、脾脏和肝脏的显微和超微结构变化,组化染色观察肠道在感染前后黏液细胞数量和类型变化,结合黑色素巨噬细胞中心(Melano-macrophage centres,MMC)在组织中的变化情况来评价各组织病理损伤程度以及在抗A. veronii感染中的免疫功能发挥状况,以此为胭脂鱼感染A. veronii的组织病理学和抗菌免疫反应研究提供参考.
HTML
-
实验所用胭脂鱼(体质量为20.20±1.92 g,全长为126.80±3.90 mm)购买自眉山市东坡区一养殖场. 实验鱼养殖于室内循环水系统中,水温控制在28±0.50 ℃,溶氧7.00±0.50 mg/L,光周期为12L∶12D. 在每天的9:00和17:00分别投喂1次商品饲料,每次投喂量为鱼体质量的1%,投喂2 h后用虹吸吸走粪便和残饵,同时换水1/4. 暂养2周后选择体表无伤、状态良好的个体开始感染实验. 将保存于-80 ℃的维氏气单胞菌毒力菌株BBAv1进行菌体复苏,后利用分光光度法和菌落计数法测定并调节菌液浓度为2.0×108 cfu/mL(即24 h的半致死浓度)[19]. 实验组随机选取20尾胭脂鱼作为攻毒对象,腹腔注射200 μL菌液;对照组随机选取20尾胭脂鱼注射相同剂量的无菌PBS(磷酸盐缓冲溶液). 注射完成后,实验组和对照组10尾/组分别养殖于独立的循环水系统中等待取材,期间记录实验鱼发病时间和死亡情况.
-
注射感染后,选取5尾处于濒死状态(沉于缸底,呼吸缓慢,失去刺激反应能力)的胭脂鱼,用MS-222(100 mg/L)麻醉后进行解剖取材. 将取出的肾(中肾、头肾)、脾脏、肝脏和肠道(按长度等分为前肠、中肠和后肠)用波恩氏液固定,经梯度酒精脱水,二甲苯透明,石蜡包埋后,进行常规石蜡切片,厚度为5 μm,HE染色后,在Nikon DXM1200显微镜下拍照. 与此同时,另取一部分肠道用卡诺氏液固定,后用于AB-PAS染色.
为了观察组织亚显微结构层面的病理变化,将中肾、头肾、脾脏和肝脏用预冷于-4 ℃的2.5%戊二醛固定,固定好的样本经0.1 mol/L(pH值为7.4)磷酸缓冲液漂洗3次,后经1%四氧化锇固定2 h,经梯度酒精脱水,丙酮置换,环氧树脂浸透、包埋后,制成60 nm的超薄切片,醋酸铀和枸橼酸铅染色后,用H-7500型电镜观察,Gatan-780 CCD拍照.
-
用于组织显微结构观察的每个样本取5张切片,每张切片随机选取10个视野(每个视野面积为400×300 μm2)进行观察,即每个样本均进行50个视野的观察. 使用Image-Pro Plus 6.0图像测量软件,对各组织观察视野中所含MMC分别进行计数和面积测量,并计算单位面积中MMC所占比值[20]. 另外,根据Sun等[21]的方法对各组织病理程度进行评估,即根据某一病理现象在所观察切片视野中出现的频率高低,将病理程度划分为无病理现象(-,0%),轻度(+,≤25%),中度(++,25%~50%)和重度(+++,≥50%).
-
数据均以x±s表示. 使用SPSS 19.0(IBM,Chicago,USA)软件对所得数据进行单因素方差分析(One-way analysis of variance,ANOVA)和独立样本t检验,p<0.05表示差异有统计学意义.
1.1. 人工感染实验鱼
1.2. 取材
1.3. 组织病理特征定量与半定量描述
1.4. 数据统计与分析
-
实验组在维氏气单胞菌注射后6 h开始陆续发病,统计至感染后24 h,实验组死亡率为48.66%,显著高于对照组(p<0.05),且实验组死亡大多发生在感染后14~24 h之间.
-
未受感染时,脾脏中单个MMC面积最大(p<0.05),中肾中MMC数量最多,相对面积最大(p<0.05)(表 1). 维氏气单胞菌感染后,各组织中MMC变化明显,表现为中肾、头肾、脾脏和肝脏中的单个MMC面积分别增大了1.25,1.20,1.13和1.20倍;中肾、头肾和脾脏中MMC数量分别增加了1.76,1.73和2.20倍;中肾、头肾和脾脏中MMC占比分别增大了2.12,2.96和3.92倍. 总体来看,中肾、头肾和脾脏中MMC各指标变化趋势基本一致,而肝脏在感染前后其MMC数量和占比均未发生显著变化. 值得一提的是,脾脏中MMC数量和占比在感染前后变化最大.
-
维氏气单胞菌感染后,胭脂鱼各组织出现了一系列相同的病理特征(表 2),如组织出血、溶血,内皮细胞损伤,组织坏死以及淋巴细胞浸润等. 同时,一些特殊的病理特征也出现在不同的组织中,如MMC响应仅出现在中肾、头肾、脾脏和中肠组织中,细胞空泡化仅出现在肝脏组织中.
-
胭脂鱼中肾组织包含了肾小管、肾小球以及排泄管等结构,这些结构之外为肾间质,肾间质主要包含了一些拟淋巴组织,其间可见淋巴细胞、粒细胞、巨噬细胞等,MMC在HE染色下呈棕黄色至棕褐色,形态并不规则(图 1a). 维氏气单胞菌感染后,肾小球肿胀变形,肾间质大量出血并伴随着溶血,局部组织坏死,大量淋巴细胞和MMC浸润组织(图 1b).
-
头肾组织中包含了大量的红细胞、淋巴细胞、粒细胞和巨噬细胞,且组织局部可观察到粒细胞和淋巴细胞的聚集区(图 1c). 维氏气单胞菌感染后,头肾组织发生急性出血,且出血部位被大量淋巴细胞浸润,同时可见局部组织坏死(图 1d).
-
胭脂鱼脾脏可分为明显的红髓和白髓,红髓主要由各个发育阶段的红细胞组成,白髓主要包含了淋巴细胞、粒细胞和巨噬细胞,组织中MMC多见于椭圆体和血管周围(图 1e). 维氏气单胞菌感染后,脾脏出现出血、溶血和组织坏死现象,与此同时,红细胞退化变性也被观察到,主要表现为胞质浅染呈淡红色(图 1f).
-
胭脂鱼肝脏细胞可分为两种:明细胞和暗细胞,组织中可见肝血窦和胆小管等结构,组织部分区域有些许小空泡(5.68±0.13 μm)(图 1g). 维氏气单胞菌感染后,肝细胞核发生固缩,组织局部血细胞凝集,大片肝组织严重空泡化(8.07±0.12 μm)(图 1h).
-
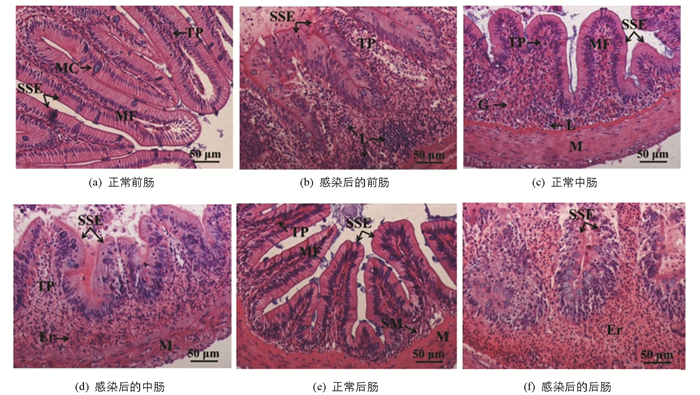
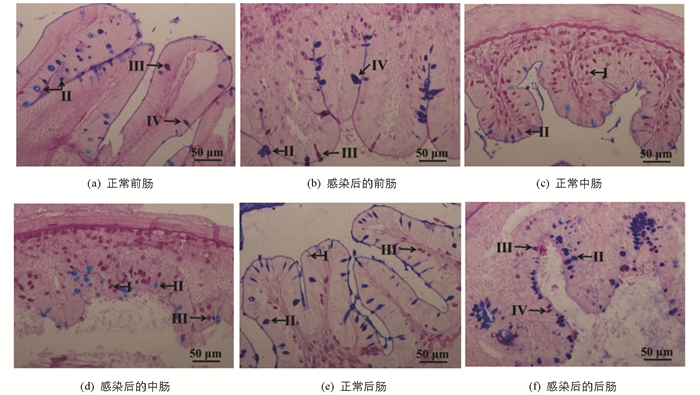
胭脂鱼肠道可大致分为前肠、中肠和后肠,结构相似,均由粘膜层、粘膜下层、肌肉层和浆膜层组成,粘膜层可被进一步划分为粘膜上层和固有层. 显然,胭脂鱼前肠粘膜层最高(196.81±5.37 μm),中肠(129.75±8.98 μm)和后肠(126.23±9.11 μm)次之. 维氏气单胞菌感染后,肠道各部粘膜上层肿胀、坏死,固有层和粘膜下层大量出血,淋巴细胞聚集于粘膜下层. 与此同时,肌肉层细胞肿胀或部分纤维化,浆膜层发生水肿(图 2). 另外,肠道AB-PAS染色显示胭脂鱼肠道中包含4种类型的黏液细胞(图 3):Ⅰ型(红色,中性),Ⅱ型(蓝色,酸性),Ⅲ型(紫红色,中性偏酸性)和Ⅳ型(蓝紫色,酸性偏中性). 从黏液细胞类型来看,前肠和后肠以Ⅱ型黏液细胞为主,中肠以Ⅰ型黏液细胞为主. 从黏液细胞数量来看,中肠黏液细胞最多,前肠和后肠次之. 维氏气单胞菌感染前后,中肠黏液细胞类型和数量均未发生显著变化,而前肠Ⅲ型和后肠Ⅳ型黏液细胞数量变化有统计学意义(表 3).
-
肾小球中的内皮细胞紧贴系膜细胞基膜内侧进行胞质延伸,并在远端形成了许多微窗孔,足细胞胞质也黏贴在系膜细胞基膜外侧,其胞质形成了许多不规则的指状突起(称为足突),上述结构形成了肾小球过滤装置(内皮细胞胞质微窗孔-系膜细胞基膜-足细胞胞质足突)(图 4a). 维氏气单胞菌感染后,系膜细胞基膜肿胀,内皮细胞形成的微窗孔消失,足细胞大量增生,足突大量融合,导致肾小球过滤装置结构严重变形(图 4b).
-
大量饱含颗粒物质的中性粒细胞(含低电子密度的较大圆形颗粒)和嗜酸性粒细胞(含高电子密度的不规则颗粒)分散于头肾组织中(图 4c). 维氏气单胞菌感染后,内皮细胞严重坏死,细胞间隙增大,水肿明显,巨噬细胞功能活跃,表现为内含较大的吞噬泡(图 4d).
-
脾脏中可见形态完好的红细胞、网状细胞和内皮细胞(图 4e). 维氏气单胞菌感染后,网状细胞和内皮细胞肿胀坏死,组织中出现了大量的嗜酸性粒细胞(图 4f).
-
肝细胞中可见大量的线粒体、糖原、粗面内质网、脂滴以及狄氏间隙中大量的肝细胞胞质形成的微绒毛(图 4g). 维氏气单胞菌感染后,肝细胞中糖原消失,线粒体肿胀,髓样小体增多,狄氏间隙遭到严重破坏,表现为微绒毛大量消失(图 4h).
2.1. 死亡率统计
2.2. 组织MMC响应情况
2.3. 组织病理程度评价
2.4. 维氏气单胞菌感染对肾、脾、肝和肠组织结构的影响
2.4.1. 中肾
2.4.2. 头肾
2.4.3. 脾脏
2.4.4. 肝脏
2.4.5. 肠道
2.5. 维氏气单胞菌感染对肾、脾和肝超微结构的影响
2.5.1. 中肾
2.5.2. 头肾
2.5.3. 脾脏
2.5.4. 肝脏
-
众多研究表明,维氏气单胞菌感染将造成宿主产生一系列明显的临床病症,如体表溃疡、皮肤发红、鳍条腐烂、内脏充血等,组织病理变化则主要为细胞坏死、空泡化、组织局部溶血、炎症细胞浸润等[1, 5-6]. 总体而言,维氏气单胞菌感染造成的病理特征基本相似,只是随着感染剂量和时间以及毒力因子数量的增加,组织病理严重程度也随之增加[2-4, 7].
-
鱼类组织中的黑色素巨噬细胞中心(MMC)不仅含有黑色素巨噬细胞(MM),还含有一定量的淋巴细胞[19],因此与哺乳类的脾脏生发中心(splenic germinal centre,SGC)功能相似,对于浆细胞和记忆B细胞的增殖至关重要[22]. 研究发现MMC变化往往与感染性疾病、慢性炎症、红细胞代谢和组织损伤密切相关[23-24]. 与之类似,本研究中维氏气单胞菌感染导致胭脂鱼肾脏、脾脏组织中MMC大小、数量均发生显著变化,因此我们可以推测MMC在抗菌感染中可能发挥着重要作用. 与此同时,我们也观察到感染前后肝脏中MMC变化不明显,而这可能与肝脏中巨噬细胞迁移速度较慢有关[25]. 另外,由于脾脏中MMC在感染前后变化程度最大,因此我们也认为脾脏中的MMC可以作为评价机体生理状态的敏感标记[26].
-
中肾内肾小球和肾小管等结构和组织的完好对于其功能发挥至关重要. 已有研究指出肾小球中的足细胞非常敏感,是诸多有毒物质的靶细胞[27]. 本研究中维氏气单胞菌感染使得足细胞增生、足突大量融合,这可能是细菌毒力因子作用的结果. 另外,肾小球滤过装置变形在一定程度上意味着中肾对原尿的过滤功能会受损,但本研究中并未发现肾小管发生明显变化,这可能与肾小管较强的自我修复能力有关[28-29]. 同样,本研究发现MMC在中肾组织中较为常见,且在细菌感染前后变化明显,据MMC所具备的免疫功能推测胭脂鱼中肾是具备一定免疫功能的,这在中肾转录组研究中得到证实[30].
鱼类头肾不仅是重要的免疫器官,同时也是造血和内分泌调节器官[31]. 本研究中维氏气单胞菌感染造成头肾组织结构严重损伤,这无疑会影响其正常功能的发挥. 鱼类脾脏在造血、B细胞分化和抗体生成等方面发挥着重要作用[32]. 本研究发现维氏气单胞菌感染后脾脏中淋巴细胞、MMC和粒细胞大量浸润组织,从组织学上也反映出特异性免疫反应和非特异性免疫反应都参与了机体的抗菌活动.
环境污染物如镉、锌、铜、氟等均可导致实验对象肝脏空泡化[33-35]. 本研究中维氏气单胞菌感染也导致了胭脂鱼肝脏空泡化,这说明肝脏空泡化可能是肝脏应激的一个普遍现象. 另外,研究发现肝细胞中糖原消失、线粒体肿胀,这似乎说明肝脏糖代谢发生了紊乱;而肝脏狄氏间隙结构遭到严重破坏则可能是导致肝细胞损伤甚至坏死的主要原因[36].
黏液细胞中含有的水解酶、免疫球蛋白和溶菌酶等物质对于其消化吸收以及免疫功能的发挥非常重要,根据其内含物质的不同,黏液细胞可大致分为4种类型[37]. 本研究发现Ⅱ型黏液细胞在前肠和后肠中占据主要优势,这可能与其消化吸收和杀菌作用有关[38],而中肠中Ⅰ型黏液细胞数量最多,可能主要起到润滑肠道的作用. 但总体而言,维氏气单胞菌感染前后仅胭脂鱼前肠Ⅲ型和后肠Ⅳ型黏液细胞数量发生了显著变化,这可能是因为黏液细胞的产生是一个为时较长的过程,或者维氏气单胞菌感染造成了肠道严重损伤以至于产生黏液细胞的功能受损,而本研究发现胭脂鱼肠道在细菌感染后损伤严重,因此我们更倾向于第二种解释.
对致病菌而言,其毒力表现与之携带的毒力因子类型和数量密切相关[39]. 本研究使用的毒力菌株BBAv1[7]携带的AerA和HlyA是导致宿主组织出血的关键毒力因子[40],而AerA,Alt,HlyA和Ast则与肠炎密切相关[41]. 总而言之,本研究诸多病理现象出现的原因均可由该菌株携带的毒力因子来解释.








 DownLoad:
DownLoad: