-
开放科学(资源服务)标志码(OSID):

-
溃疡性结肠炎(Ulcerative Colitis,UC)是一种慢性、非特异性、炎症性肠病,该病的病变区域位于结肠及直肠的黏膜及黏膜下层,其临床症状主要表现为腹痛、腹泻及便血等[1]. UC在中医学辩证立法中一般归为“泻下” “痢疾”等范畴,认为其病因为外感湿热,饮食不节,导致脾、胃、小肠、大肠传导失调,水谷运行不畅,久而闭塞,伤及肠胃,气血瘀滞,以致便血[2]. 平胃散出自宋代《太平惠民和剂局方》,由苍术、厚朴、陈皮、甘草4味药组成,诸药合用,共成燥湿运脾,行气和胃之功. 现代药理研究表明,平胃散有明显的调节胃肠运动,抗菌抗炎,抗溃疡和增强免疫等作用. 平胃散治疗UC可以通过调节肠道菌群,恢复肠道微生态平衡,促进胃肠运动,抑制炎症反应等发挥作用.
中药方剂是在中医辨证立法的基础上,按照一定的组织原则,选择适当的药物组合运用达到预期的治疗效果. 近年来,随着系统生物学与计算机网络分析技术的应用,网络药理学研究也常被用于探究中药方剂与相关疾病之间的关系,通过筛选药物成分、作用靶点、疾病靶点、作用通路等,模拟构建生物网络图,多维度地探究药物成分对疾病靶点的干预和影响,从而揭示药物在治疗疾病过程中发挥的多层次协同作用[3-8]. 本文利用网络药理学研究方法和分子对接验证技术,揭示平胃散在治疗UC时的药效物质基础,探究平胃散治疗UC的关键靶点和作用通路,为后续的研究工作提供理论基础.
HTML
-
为收集平胃散中苍术、厚朴、陈皮、甘草4味中药的主要化学成分,通过检索中药系统药理数据库(TCMSP)[9-10]筛选口服利用度(OB)大于(等于)30%且类药属性(DL)大于(等于)0.18[11]的活性成分,获得平胃散活性成分及相关靶点. 在Uniprot数据库中对基因靶点信息及基因名称进行校对核实[12-13].
-
为收集UC疾病作用的相关靶点,通过检索疾病基因数据库如GeneCards、TTD(Therapeutic Target Database) 以及OMIM(Online Mendelian Inheritance in Man) [14],综合筛选后将其与上述平胃散潜在药物靶点进行比对,筛选出167个共同基因,作为UC和平胃散的共同潜在靶点.
-
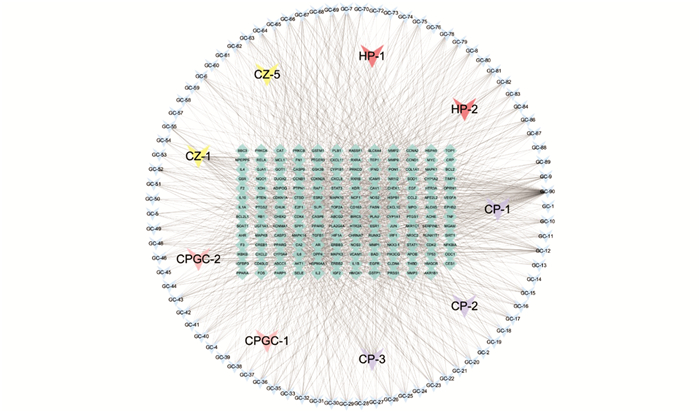
将1.1项筛选的平胃散活性成分与1.2项筛选的共同潜在靶点,依照活性成分-靶点之间的对应关系上传至在线可视化软件Cytoscape形成网络图[15](图 1),利用Cytoscape软件进行拓扑参数分析,以自由度值的中位数来判定活性成分-靶点网络的核心节点.
-
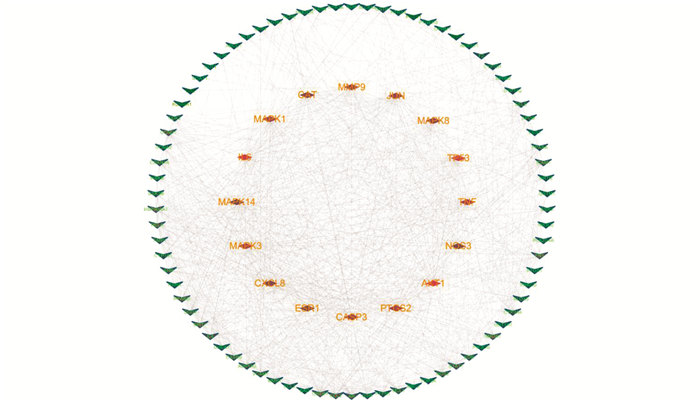
上传167个潜在共同靶点至STRING数据库,进行平胃散治疗UC的靶点与靶点之间相互作用网络分析,并导出分析数据上传至Cytoscape软件绘制靶点与靶点相互作用网络图(图 2),依据自由度值的中位数来判定平胃散治疗UC靶点互作网络的核心节点.
-
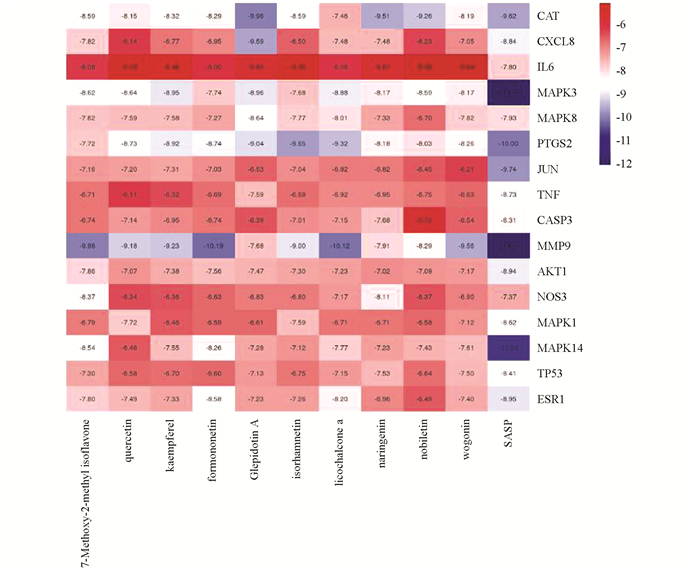
通过PubChem数据库检索获得药物活性成分的3D结构,RCSB-PDB数据库寻找核心靶点的3D结构PDB格式文件,运用PyMOL2.4.1对靶点蛋白进行预处理,利用AutoDock_Vina分子对接模拟软件,对自由度值排名前10的药物活性成分与STRING互作网络筛选得到的核心靶点进行受体与配体对接. 全部分子对接完成后,将药物活性成分和核心靶点最低结合能(Binding Energy)数据作热图(图 3),并选取其中两个对接结果进行PyMOL 2. 4. 1软件可视化处理(图 4).
-
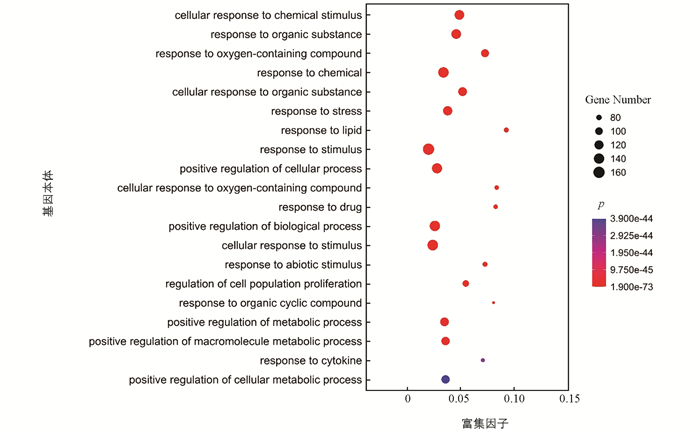
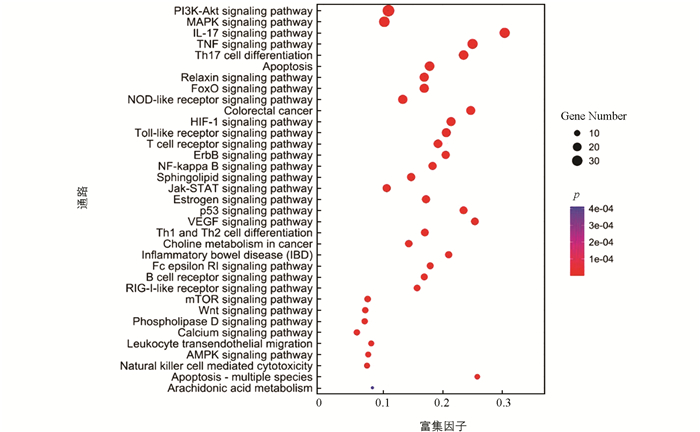
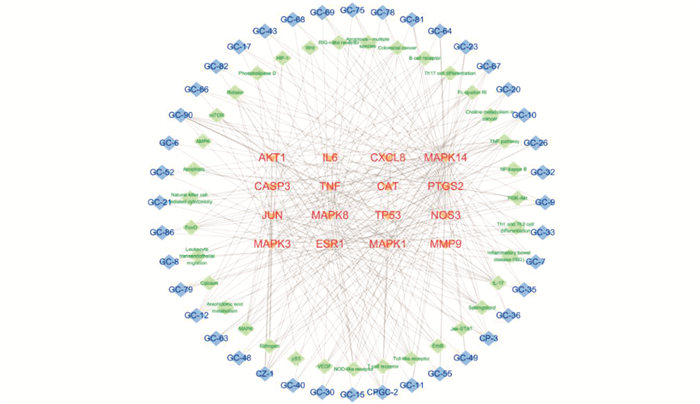
利用STRING在线蛋白质分析软件对167个共同靶点进行GO(Gene Ontology)富集和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析(图 5、图 6),设定阈值p<0.05[14],结合文献资料和生信分析筛选与UC有关的通路导入Cytoscape软件,构建平胃散治疗UC的活性成分-核心靶点-作用通路网络图[16](图 7).
1.1. 筛选平胃散活性成分及相关靶点
1.2. 筛选UC相关疾病作用靶点
1.3. 构建平胃散活性成分-靶点网络
1.4. 分析平胃散治疗UC的核心靶点
1.5. 分子对接验证
1.6. 靶点通路富集分析
-
将阈值设定为OB大于(等于)30%、DL大于(等于)0.18,结合数据库和文献资料最终整合得到平胃散92个活性成分,包括苍术2个、厚朴2个、陈皮3个、甘草83个,甘草与陈皮共有2个. 将平胃散92个活性成分及相关靶点导入Cytoscape软件构建活性成分-靶点网络,如图 1所示. 该网络图主要由节点和边构成,不同颜色的节点代表不同的含义,甘草成分用蓝色、苍术成分用黄色、厚朴成分用红色、陈皮成分用紫色、陈皮和苍术共有成分用粉色、靶点用绿色. 图 1中共有节点259个,包括92个成分节点和167个靶点节点,边1 330条.
经Cytoscape-Tool-NetworkAnalyzer分析得出活性成分-靶点网络中,自由度值中位数为3(核心节点需满足自由度值中位数的2倍作为参考值). 从表 1可见,自由度值由高到低排名前10的活性成分依次为槲皮素(quercetin,115)、山奈酚(kaempferol,38)、汉黄芩素(wogonin,37)、柚皮素(naringenin,31)、川陈皮素(nobiletin,27)、异鼠李素(isorhamnetin,25)、芒柄花黄素(formononetin,23)、7-甲氧基-2甲基异黄酮(7-methoxy-2-methyl isoflavone,22)、甘草酮a(licochalcone a,22)、鳞叶甘草素A(glepidotin A,20),推测以上较高自由度值的活性成分是平胃散主要的药效物质基础,能够发挥重要的药理作用.
-
利用STRING在线数据库分析平胃散治疗UC靶点之间的交互作用,将167个共同靶点相互作用关系数据导入Cytoscape软件,进行网络拓扑分析得到自由度值大于46的靶点(中位数的2倍),共筛选到16个核心靶点. 如图 2所示,自由度值与节点颜色呈正相关,自由度值越大,颜色越深,表明靶点在活性成分-核心靶点网络关系中越重要[14]. 从表 2可见,16个核心靶点的自由度值从大到小依次为RAC-α丝氨酸/苏氨酸蛋白激酶(AKT1)、白细胞介素-6(IL6)、细胞肿瘤抗原p53(TP53)、肿瘤坏死因子(TNF)、丝裂原活化蛋白激酶3(MAPK3)、丝裂原活化蛋白激酶1(MAPK1)、前列腺素G/H合酶2(PTGS2)、转录因子AP-1(JUN)、半胱氨酸蛋白酶-3(CASP3)、基质金属蛋白酶-9(MMP9)、丝裂原活化蛋白激酶8(MAPK8)、过氧化氢酶(CAT)、白细胞介素-8(CXCL8)、雌激素受体1(ESR1)、内皮型一氧化氮合酶(NOS3)和丝裂原活化蛋白激酶14(MAPK14),且在平胃散治疗UC的直接作用靶点中处于核心位置,推测这些靶点可能在平胃散发挥疗效的过程中,对于治疗UC起到了较为重要的作用.
-
利用分子对接软件将16个核心靶点和10个核心活性成分进行对接模拟计算,得到对接最低结合能数据结果并作热图. 由图 3可知,结合能越小分子对接得越好,所有小分子化合物与标靶蛋白的最低结合能都小于-5.0 kJ/mol,说明靶标蛋白配体与活性成分受体可以自发结合,最低结合能越小表明药物活性成分与靶点蛋白结合越好[9]. 对接结果显示,10个活性成分与蛋白靶点MMP9,CAT,PTGS2,MAPK3,MAPK8,AKT1,MAPK14的最低结合能均小于-7 kJ/mol,说明这些活性成分与上述靶点蛋白结合较好.
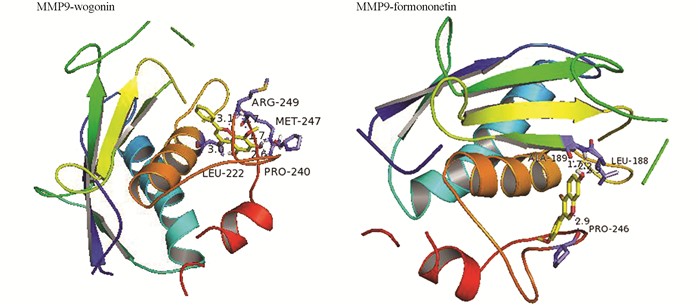
其中,MMP9与汉黄芩素(wogonin)、芒柄花黄素(formononetin)结合活性良好,绘制分子对接细节如图 4所示.
药物小分子结合在蛋白的活性口袋,并且与活性口袋有较好的匹配[6]. wogonin与MMP9活性位点的LYS745,THR854,ASP855形成3个氢键相互作用,formononetin也与MMP9活性位点的LYS745,THR854,ASP855形成3个氢键相互作用. 表 3列出参与分子对接的16个靶点蛋白的基本信息,包括靶点、Uniprot编号及PDB编号. 柳氮磺胺吡啶(SASP)与靶点蛋白对接的最低结合能和平胃散核心活性成分与靶点蛋白的最低结合能相差不大,验证了靶点蛋白晶体及配体选择的合理性.
-
通过STRING数据库共获得GO生物过程条目2 183条,p值从小到大排序取前20条作图. 由图 5可知,富集气泡大小代表富集的基因数量,气泡越大,表明富集的基因数目越多[17];气泡颜色代表p值,其值由大到小从红色向蓝色变化. 在基因本体富集的生物过程中,细胞对化学刺激的反应、细胞的正向调节、生物过程的正向调节、细胞对刺激的反应等排名靠前.
通过STING数据库共筛选出35条与UC有关的KEGG通路(图 6),主要包括PI3K-AKT信号通路、MAPK信号通路、IL-17信号通路、TNF信号通路、Th17细胞分化等,表明平胃散在发挥治疗UC作用时,可能主要是依靠调节平胃散的活性成分来实现上述信号通路.
采用Cytoscape可视化软件绘制活性成分-核心靶点-通路网络(图 7),绿色节点表示作用通路,橙色节点表示核心靶点,蓝色节点表示活性成分. 平胃散中40个活性成分作用于16个UC相关核心靶点,进而调节35条不同的代谢通路,维持机体平衡,充分展现了中药方剂多维度治疗UC的目标.
2.1. 平胃散活性成分-靶点网络构建及核心活性成分筛选
2.2. 平胃散治疗UC的核心靶点分析
2.3. 分子对接验证
2.4. 靶点生物功能及靶点-通路分析
-
参苓白术散对溃疡性结肠炎模型小鼠具有治疗效果[18];而平胃散有燥湿运脾、行气和胃的功效,是治疗UC的有效方剂,临床上已有多例报道证实平胃散治疗UC具有较好的疗效. 本文采用网络药理学方法,应用中药方剂以多种药物成分,通过多种途径来协同作用于多个靶点及多条通路,构建药物活性成分-靶点-通路的互作关系网络,探究平胃散治疗UC的作用机制,为平胃散临床应用提供科学依据.
在平胃散活性成分-靶点网络中经分析可得,自由度值排名前10的化学成分分别为槲皮素、山奈酚、汉黄芩素、柚皮素、川陈皮素、异鼠李素、芒柄花黄素、7-甲氧基-2-甲基异黄酮、甘草查尔酮a、鳞叶甘草素A,均属于黄酮类化合物,说明平胃散治疗UC与黄酮类化合物的抑制酶活性、抗癌、抗菌、抗病毒、抗炎症、抗过敏等功能[19]具有密切联系.
通过STRING数据库在平胃散治疗UC的靶点关系网络中筛选出16个核心靶点,结合分子对接结果,发现10个活性成分与16个核心靶点蛋白对接结合能均小于-5.0 kJ/mol. 其中,分子对接结合能都小于-7.0 kJ/mol的靶点蛋白有MMP9,CAT,PTGS2,MAPK3,MAPK8,AKT1,MAPK14,说明这7个靶点可能是平胃散治疗UC的关键作用靶点. 选取MMP9与汉黄芩素、芒柄花黄素分子对接细节进行分析,发现汉黄芩素可以与MMP9蛋白活性口袋较好地匹配,其活性位点是MMP9的LYS745,THR854,ASP855这3个氢键. 芒柄花黄素也可与MMP9的LYS745,THR854,ASP855这3个氢键进行匹配,说明MMP9确为平胃散治疗UC的一个核心靶点.
MMP-9是MMP家族成员,由成纤维细胞、中性粒细胞、巨噬细胞等多种细胞分泌而成,广泛存在于萎缩性胃炎、胃溃疡、体表溃疡等多种炎症性疾病中,是细胞外基质的重要降解酶[20]. MMP-9在癌症相关疾病中均呈现出高表达状态,肿瘤细胞的高侵袭转移能力与MMP-9的过表达显著关联[21]. 研究表明,葡聚糖硫酸钠(DSS)诱导的UC小鼠MMP-9在mRNA和蛋白水平上均升高[22],且在平胃散治疗UC的关键靶点网络关系中MMP9处于核心地位,结合分子对接结果显示MMP9与平胃散中多种关键活性成分结合能低于-7 kJ/mol. KEGG通路富集分析显示,MMP9与UC有关炎症通路IL-17,TNF和MAPK信号通路密切相关,因此平胃散可能通过调节MMP9的表达,影响UC有关炎症信号通路.
PTGS2是正常组织中起到维持稳态和炎症调节相关作用的重要应答基因[23],因此PTGS2可通过调节UC在不同信号通路中相关基因的表达发挥作用. PTGS2与细胞因子IL-1、TNF-α、IL-6、血小板活化因子等调节因子密切相关,其局部表达增加可引发炎症和缺血[24]. PTGS2在各种异常内外环境的刺激下会呈现出病理性过度表达,显著区别于正常的生理情况. 仇雅岚等[25]研究发现抑制PTGS2在结直肠癌组织中过度表达有利于减少结直肠癌风险,PTGS2在结直肠癌发生、发展、转移中发挥重要作用. 洪寅雯等[26]研究发现PTGS2是调节脂质过氧化相关蛋白的靶基因,且抑制肠黏膜细胞脂质过氧化在治疗UC相关疾病中起到重要作用. 分子对接结果显示,平胃散中10个活性化学成分与PTGS2结合能均低于-7.0 kJ/mol,显示平胃散与PTGS2活性位点结合能力强,亦可推测出平胃散作用于PTGS2时,通过不同的炎症信号通路调节相关基因的表达,从而达到减缓UC炎症反应的作用.
CAT是一类主要起催化底物氧化还原反应的酶,在平胃散治疗UC的关键靶点网络关系中处于核心地位. DSS会破坏肠道上皮细胞的完整性,击破肠道的机械屏障,诱发急性UC[18],而研究表明CAT能有效地清除各种活性氧基团,从而防止细胞膜系统的损坏[27]. 同时,CAT可以通过抑制炎症、提高机体免疫力、增强机体对羟基自由基及超氧阴离子的抑制能力等,有效缓解由于氧化应激所造成的机体或功能损伤[28]. KEGG富集结果显示,NF-κB信号通路具有较高的富集性,研究发现CAT可以通过降低致炎因子IL-1β,IL-8,TNF-α和PTGS2的信使RNA及蛋白表达,降低NF-κB激活水平,从而达到抑制NF-κB信号转导通路的作用[29]. Kobayashi等[30]的研究表明,CAT具有抑制金属蛋白酶(MMPs)和NF-κB表达的功能,可以起到抑制肿瘤细胞对上皮细胞的黏附、减少肿瘤细胞数目、抑制肿瘤生长及转移的作用. 分子对接结果显示,平胃散中10个活性化合物分子与CAT的结合能均低于-7.0 kJ/mol,表明平胃散与CAT活性位点结合能力较强. 因此,本文推测平胃散作用于CAT,通过其强抗氧化性及调节致炎因子表达的功能,发挥抑制NF-κB等信号通路的作用,从而在平胃散治疗UC的关键靶点网络中起到关键作用.
MAPK级联反应存在于所有生物体的大多数细胞内,是真核生物细胞重要的信号转导通路,参与多种细胞功能[31],其中MAPK14信号级联的激活可调节细胞增殖分化、凋亡、衰老和炎症等生物过程,其影响具有多效性和多样性[32]. MAPK14是促炎基因程序的关键激活因子,在UC中可调节TNF-α,IL-1,IL-6,IL-1β等炎症细胞因子的产生[33]. MAPK14可通过增强TNF-α表达诱导细胞生理功能紊乱和细胞凋亡,另有研究表明MAPK信号通路与氧化应激性肠上皮细胞损伤密切相关[34]. 因此,平胃散药物活性成分可能通过MAPK14级联反应来抑制IL-6,IL-1β,TNF-α的表达,从而达到对UC的治疗效果.
KEGG富集结果显示,在UC相关通路中MAPK,TNF,IL-17等具有较高的富集性. 研究表明IL-17家族细胞因子可以通过活化NF-κB来介导信号传送及转录激活因子的磷酸化,进而促进大肠癌的发生发展[35]. 在炎症反应过程中,NF-κB通过提高IL-1β,IL-6等炎症因子的基因转录来增加IL-1β,IL-6的表达,因此调控NF-κB在平胃散治疗UC中起到关键作用[36].
本文应用网络药理学的方法对平胃散治疗UC的分子机制进行探讨,平胃散中不同药物的活性成分通过调控不同的靶蛋白作用于不同的通路,对UC起到治疗作用,体现了中药方剂整体性、系统性的特点. 结果发现,平胃散可能从以下几个方面发挥治疗作用:①作用于MMP9靶点,控制其mRNA和蛋白水平的表达量,起到稳定肠道黏膜环境的作用,从而发挥治疗效果;②作用于CAT和PTGS2,调节炎症细胞因子IL-1β,IL-8,TNF-α及相关蛋白基因的表达,发挥抗炎作用;③抑制NF-κB,MAPK和IL-17等信号通路的活化及相关炎症因子的表达,起到治疗UC的作用. 本文运用网络药理学的方法探究了平胃散治疗UC的作用机制,为后续实验验证提供依据.






 DownLoad:
DownLoad: