-
开放科学(资源服务)标志码(OSID):

-
中国茶文化历史悠久,茶的消费量仅次于纯水,与可可和咖啡并称为世界三大无酒精饮料[1-2]. 儿茶素、咖啡碱和茶氨酸等是茶叶富含的特征性次生代谢产物,是茶叶色、香、味等品质形成和饮茶保健功效发挥的物质基础[3]. 茶树次生代谢丰富,目前已知的代谢物数量多达1 450种[4];对茶树次生代谢物的深入研究有助于茶叶功能性成分的开发和茶树资源的多元化利用.
东莨菪素是香豆素类化合物,植物中主要以糖苷(东莨菪苷)的形式存在,已知具有的药理活性包括抗肿瘤、防治高尿酸血症、降血压、降血脂、解痉、缩瞳和降低眼压、镇痛等[5]. 目前已知东莨菪素在丁公藤、枸杞、桑树、华山参、白鹤藤等传统中药植物中有较高的含量[6-11]. 其中,丁公藤是东莨菪素的重要天然来源,也是丁公藤发挥镇痛、抗炎、祛痰、平喘等药理作用的主要生化成分[12-14]. 在烟草属的植物叶片中,东莨菪素和东莨菪苷还可以起到植保素的作用,直接参与抵抗腐生性病原真菌的侵染[15]. 茶树是包括香豆素类化合物在内的黄酮类物质积累丰富的代表物种,但是截至目前有关茶树中东莨菪素及其糖苷的含量和检测方法的研究还鲜有报道.
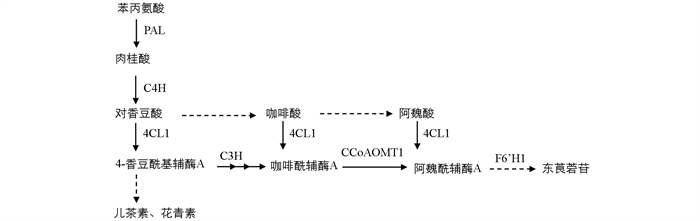
香豆素类化合物广泛存在于植物中. 模式植物拟南芥中发现东莨菪素、东莨菪苷等香豆素类化合物主要在根中合成,但是不同拟南芥材料中的含量存在显著差异[16]. 已知东莨菪苷合成途径是类黄酮代谢途径的上游分支,主要由4-香豆酰基辅酶A经香豆酸-3-羟化酶、咖啡酰辅酶A-O-甲基转移酶和阿魏酰辅酶A-6'-羟化酶等催化形成(图 1),但其合成的准确调控机制仍不清楚[17-18]. 低温(10 ℃)条件下拟南芥的类黄酮代谢增强,而在BEE1 (BRASSINOSTEROID ENHANCED EXPRESSION1)和GRF (G2-LIKE FLAVONOID REGULATOR)突变体中包括东莨菪苷在内的香豆素类化合物合成显著降低,下游的花青素合成增强[18]. 因此BEE1和GRF基因可能是拟南芥中参与东莨菪苷生物合成的关键调控基因,并受低温影响. 倒春寒低温条件下茶树新梢差异基因表达谱分析表明,东莨菪碱合成相关信号通路被显著富集,但茶树中BEE1和GRF的同源基因的表达水平并无显著差异[19]. 因此,茶树新梢中东莨菪苷的积累是否受低温影响,其积累代谢的主要影响因素和主要调控基因有待进一步研究.
本研究建立了茶叶中东莨菪素和东莨菪苷的HPLC检测方法,分析了茶树不同发育阶段、不同环境条件和不同品种/品系茶叶中东莨菪素和东莨菪苷的质量分数,检测了茶树东莨菪素和东莨菪苷生物合成途径中相关基因的表达模式,明确了东莨菪素和东莨菪苷积累的主要影响因素和相关基因的调控作用,为茶叶中功能性成分的开发利用提供理论参考.
HTML
-
以种植于中国农业科学院茶叶研究所试验茶园的5年生“龙井43”盆栽茶树为材料,于春季萌动期移入人工气候室(24 h光周期:13 h光照/11 h黑暗,白天24 ℃/夜晚20 ℃,湿度70%),待新梢萌发至鱼叶期、一芽一叶期、一芽二叶期和一芽三叶期时取新梢用于东莨菪碱、东莨菪苷质量分数测定和基因表达分析;以选种圃种植的3~5年生的20个茶树品种/单株为材料,统一采摘秋季顶端第2~3片成熟叶进行东莨菪碱和东莨菪苷质量分数测定,分析其在品种间的差异.
低温胁迫试验以正常生长条件下的“龙井43”盆栽茶树为材料,分别在新梢萌发至鱼叶期、一芽一叶期、一芽二叶期和一芽三叶期时给予低温处理(24 h光周期:13 h光照/11 h黑暗,白天4 ℃/夜晚2 ℃,湿度70%),于处理后24 h,48 h取新梢用于质量分数检测. 茶尺蠖为害试验同样以“龙井43”盆栽茶树为材料,于秋季茶树停止生长前接种二龄茶尺蠖幼虫,每个处理枝条接种3头,于接种72 h后采集为害叶片. 所有样品采集均设3个生物学重复,采集样品立即投入液氮中冷冻,在-80 ℃低温条件下保存备用.
-
利用ACQUITY UPLC系统(Waters,美国)进行检测. 色谱条件1:X Bridge C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇(B)-0.1%甲酸水溶液(A)梯度洗脱;洗脱程序为0~10 min,15%~34% B;10 ~ 20 min,34% B;20~35 min,34%~38% B;检测波长345 nm,流速1 mL/min,柱温25 ℃,进样量10 μL. 色谱条件2:X Bridge C18柱(250 mm×4.6 mm,5 μm),流动相为甲醇(B)-0.1%甲酸水溶液(A)梯度洗脱;洗脱程序为0~5 min,15%~25% B;5~10 min,25%~30% B;10~15 min,30%~33% B;15~20 min,33%~36% B;20~25 min,36%~40% B;检测波长345 nm,流速1 mL/min,柱温25 ℃,进样量10 μL.
-
准确称取东莨菪苷(CAS:531-44-2,PhytoLab)和东莨菪素(CAS:92-61-5,PhytoLab)标准品2.000 mg分别置于10 mL离心管中,加入4 mL色谱纯甲醇超声溶解,配成500 μg/mL的标准品溶液. 取该标准品溶液,用色谱纯甲醇稀释成为系列梯度浓度的溶液,上机检测,根据峰面积大小和标准品浓度,制作标准曲线.
-
将茶叶样品置于冷冻干燥机48 h冻干后,研磨成粉末,准确称取样品0.200 0 g于10 mL离心管中,加入纯甲醇5 mL,室温浸提4 h后,4 000 r/min离心8 min,用注射器吸取上清液过0.45 μm有机滤膜后收集于2 mL进样瓶中.
-
准确称取0.200 0 g样品粉末于10 mL离心管中,加入东莨菪苷50.0 μg和东莨菪素20.0 μg标准品,按样品溶液制备方法进行浸提并收集于进样瓶中.
-
茶树总RNA按照多糖多酚植物总RNA提取试剂盒(CAT# DP441,天根生化科技有限公司,北京)的操作说明进行提取,用NanoDrop ND2000微量核酸蛋白测定仪测定RNA浓度,用1%琼脂糖凝胶电泳检测总RNA质量,RNA质量检测合格后,参照PrimeScript © RT reagent Kit反转录试剂盒(CAT# DRR037A,宝生物工程有限公司,大连)的说明书步骤,将RNA反转录合成cDNA用于基因表达分析.
-
从“龙井43”茶树基因组中筛选出东莨菪苷的生物合成途径中的关键酶编码基因CsPAL1,CsPAL2,CsC4H,Cs4CL2-1,Cs4CL2-2,Cs4CL3和CsCCoAOMT1等[20],根据基因cDNA序列的特异性,利用Primer-Blast软件设计目的基因的荧光定量PCR(qRT-PCR)引物(表 1). qRT-PCR反应体系为:SYBR Mix(Roche,Basel,Switzerland)5.0 μL,cDNA 1.0 μL,上下游引物(10 μmol/L)各0.5 μL,超纯水3 μL,总体系10 μL;充分混匀,短暂离心后,在LightCycler 480 Ⅱ实时荧光定量PCR仪(罗氏,美国)上进行PCR扩增,反应程序为95 ℃ 5 min,95 ℃ 10 s,56 ℃ 15 s,12 ℃ 12 s,45个循环后增加溶解曲线. 以茶树基因CsPTB为内参基因[21],每个反应3次生物学重复,2次技术重复,2-ΔCT或2-ΔΔCT法分析结果.
1.1. 试验材料及处理
1.2. 东莨菪素与东莨菪苷质量分数检测
1.2.1. 色谱条件
1.2.2. 标准溶液的配制及标准曲线制作
1.2.3. 样品溶液的制备
1.2.4. 回收率试验
1.3. 核酸提取及表达分析
1.3.1. 总RNA的提取及cDNA的合成
1.3.2. 基因表达分析
-
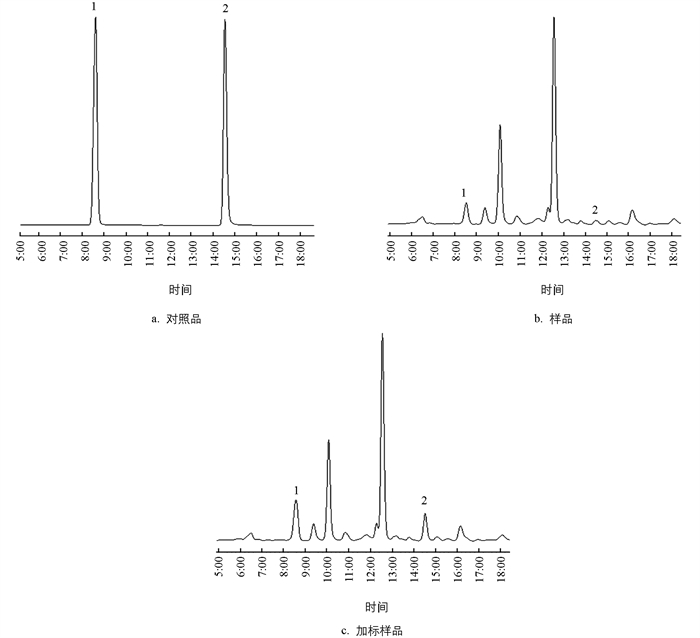
前人通过采用甲醇为提取溶剂,分别用345 nm[11],346 nm[22-23],347 nm[24]等波长来测定一匹绸、参杞等植物中的东莨菪素和东莨菪苷. 本研究通过全波长扫描显示,在茶树中东莨菪素和东莨菪苷的最大紫外吸收波长为345 nm,因此把345 nm作为本研究的测定波长. 将配制好的梯度浓度标准品溶液按色谱条件1进样,分析色谱图并记录峰面积,以峰面积为纵坐标、以对照品浓度为横坐标绘制标准曲线,计算2种标准品的线性回归方程. 东莨菪素回归方程为y=32 520.966 20x-21 613.773 82,r=0.999 8,在0.5~64 μg/mL浓度范围内呈良好线性关系;东莨菪苷回归方程为y=17 984.273 65x-20 044.097 60,r=0.999 9,在1~128 μg/mL浓度范围内呈良好线性关系.
将配制好的梯度浓度标准品溶液按色谱条件2进样,分析色谱图并记录峰面积,以峰面积为纵坐标、以对照品浓度为横坐标绘制标准曲线,计算2种对照品的线性回归方程. 东莨菪素回归方程为y=33 803.743 801x-17 723.041 828,r=0.999 821,在0.5~ 64 μg/mL浓度范围内呈良好线性关系;东莨菪苷回归方程为y=18 669.680 731x-16 520.198 296,r=0.999 9,在1~128 μg/mL浓度范围内呈良好线性关系.
东莨菪苷平均回收率为91.7%,RSD=3.32%(n=5);东莨菪素平均回收率为93.5%,RSD=2.64%(n=5). 该结果与已报道的检测方法的效率基本一致,表明2种色谱条件均具有较好的测定准确度,均能够用于茶叶中东莨菪苷和东莨菪素的定量检测(图 2).
-
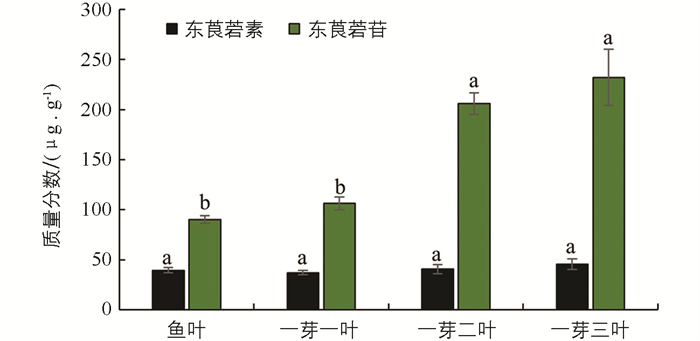
通过比较2种色谱条件对茶树新梢和成熟叶中东莨菪苷和东莨菪素的检测效果,发现利用色谱条件1对茶树新梢进行检测得到的效果更理想,而茶树成熟叶检测需对梯度洗脱条件进行优化,宜采用色谱条件2进行检测. 本研究检测了“龙井43”茶树不同萌发阶段新梢中的东莨菪苷和东莨菪素质量分数变化,结果显示,在茶芽萌发不同阶段的新梢中,东莨菪素的质量分数显著低于东莨菪苷的质量分数,且东莨菪素质量分数在不同阶段新梢中的质量分数变化差异无统计学意义,从鱼叶期到一芽三叶期的过程中,东莨菪素的质量分数变化不明显,均维持在相同的水平;而东莨菪苷的质量分数随着新梢成熟度的增加其质量分数显著升高,在一芽二叶和一芽三叶期新梢中质量分数显著高于鱼叶期和一芽一叶期,均达到200 μg/g以上(图 3).
-
本研究选取包含中小叶种、大叶种、可可茶和叶色变异的茶树品种或单株20个材料,对这些材料中所含的东莨菪苷和东莨菪素的质量分数进行检测. 结果显示,不同茶树材料中东莨菪苷和东莨菪素的质量分数差异较大,东莨菪苷质量分数分布范围为25.84~80.76 μg/g,而东莨菪素质量分数分布范围为18.34~50.88 μg/g(表 2).
报道显示,丁公藤中东莨菪素和东莨菪苷的质量分数范围分别为80~380 μg/g和150 ~ 1 040 μg/g[24],宁夏枸杞中东莨菪素和东莨菪苷的质量分数分别为27.5~57.3 μg/g和59.5~167.6 μg/g[10],一匹绸中东莨菪素和东莨菪苷的质量分数分别为38~240 μg/g和140~1 460 μg/g[22],白花蛇舌草中东莨菪素的质量分数为6.5~17.8 μg/g[25]. 可以看出茶叶中东莨菪素和东莨菪苷的质量分数较白花蛇舌草、枸杞高或相当,而低于一匹绸和丁公藤. 总体上茶叶中的东莨菪苷的质量分数高于东莨菪素,在检测材料中仅在大叶种的2017M-49单株中东莨菪素的质量分数高于东莨菪苷. 本研究还发现黄化变异单株CT2016-2的东莨菪苷和东莨菪素的质量分数均较低;紫色变异品种紫鹃中二者的总质量分数最高,且主要是以东莨菪苷的形式存在,其质量分数是东莨菪素的3.7倍;白化品种安吉白茶中具有较高质量分数的东莨菪苷和相对较低的冬莨菪素.
-
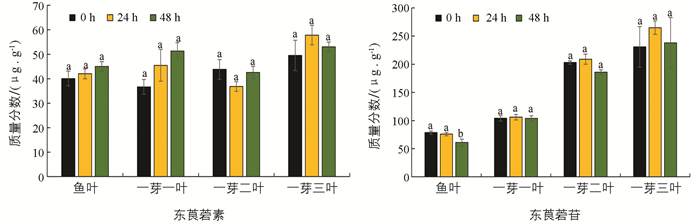
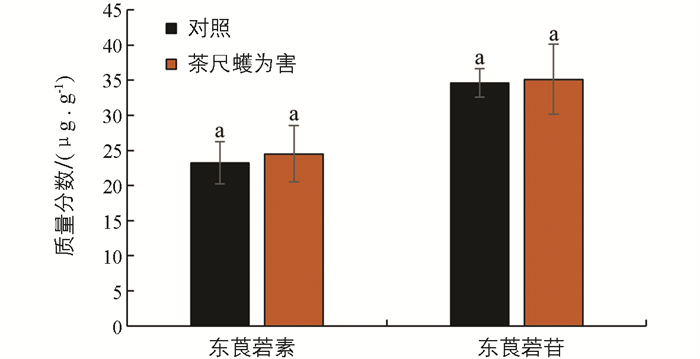
为了探究生物与非生物胁迫是否对茶叶中东莨菪素和东莨菪苷质量分数有影响,本研究分析了其在低温和茶尺蠖为害条件下茶树材料中的质量分数. 以茶树春季萌发至鱼叶、一芽一叶、一芽二叶和一芽三叶期的组织为材料,分别进行低温胁迫处理,并检测处理48 h内的物质质量分数变化. 结果显示,在低温胁迫下,东莨菪素的质量分数在各个时期的材料中变化均无统计学意义;在鱼叶期低温胁迫处理48 h时,东莨菪苷质量分数显著降低,而在一芽一叶、一芽二叶和一芽三叶中的质量分数变化均无统计学意义(图 4). 在拟南芥中的研究表明,东莨菪苷的生物合成受低温影响[19],这与本研究的结果不一致,可能是由于物种间的差异以及茶叶中丰富的次生代谢物的影响. 茶尺蠖为害的样品分析结果显示,茶叶在茶尺蠖为害后其体内的东莨菪素和东莨菪苷质量分数变化无统计学意义(图 5).
-
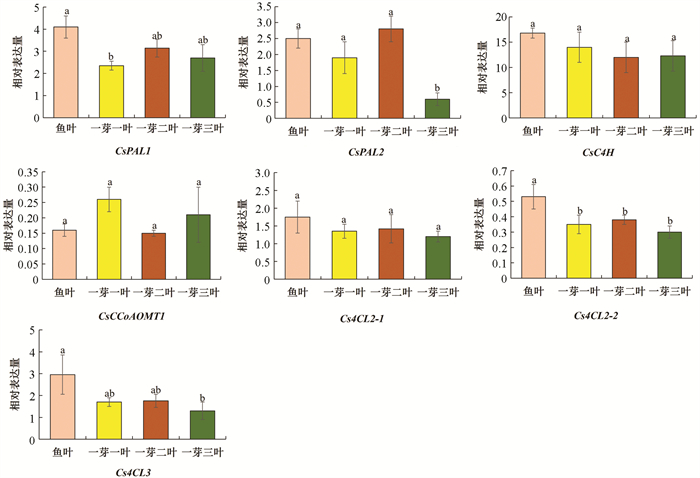
茶叶中东莨菪苷和东莨菪素的质量分数与新梢发育程度密切相关. 本研究基于“龙井43”的基因组数据,筛选出茶叶中东莨菪苷生物合成通路中的关键基因CsPALs,CsC4H,Cs4CLs和CsCCoAOMT1等,检测这些基因在茶芽不同萌发阶段新梢中的表达模式变化. 结果显示,这些基因在鱼叶期新梢中的表达量相对较高,随着成熟度的增加,CsPAL1,Cs4CL2-2和Cs4CL3的表达量降低,到一芽三叶期时如CsPAL2等基因的表达量也显著降低,而CsC4H,CsCCoAOMT1和Cs4CL2-1的表达在鱼叶期到一芽三叶期中的变化无统计学意义(图 6). 在新梢生长过程中,整体上基因表达丰度与黄酮类生物合成高度相关,但在合成通路中的上游基因CsPALs,CsC4H和Cs4CLs的表达丰度与儿茶素和黄酮醇糖苷的积累量存在较低的相关关系[26]. 这可能是由于次生代谢物质合成网络复杂,且下游产物合成底物可能来自多个代谢途径,导致上游基因表达水平与下游目标代谢物质量分数的高低不存在显著的相关关系.
2.1. 标准曲线及回收率
2.2. 茶树新梢中东莨菪素和东莨菪苷质量分数测定
2.3. 不同茶树材料中东莨菪素和东莨菪苷的质量分数检测
2.4. 东莨菪素和东莨菪苷在低温胁迫和茶尺蠖为害下的质量分数变化
2.5. 东莨菪苷合成相关基因在不同发育阶段新梢中的表达模式分析
-
本研究建立了基于高效液相色谱测定茶叶中东莨菪素和东莨菪苷的方法,并利用该方法分析了茶树不同发育时期新梢(鱼叶期到一芽三叶期)、茶尺蠖为害和低温等逆境胁迫处理下东莨菪素和东莨菪苷的质量分数变化,结果显示茶叶中东莨菪苷的质量分数显著高于东莨菪素,且东莨菪苷随着成熟度的增加而显著累积,东莨菪素和东莨菪苷的质量分数受低温和茶尺蠖胁迫的影响较小. 对20个不同茶树品种/单株中的东莨菪素和东莨菪苷的质量分数进行检测结果显示,不同茶树材料间东莨菪素和东莨菪苷的质量分数差异较大,茶叶中东莨菪素质量分数为18.34~50.88 μg/g,东莨菪苷质量分数为25.84~80.76 μg/g,与部分中药材中的质量分数相近. 进一步对东莨菪苷生物合成相关的基因表达模式进行检测结果表明,合成通路上游基因的表达模式与东莨菪苷的积累模式间不存在显著的相关关系. 总之,由于茶叶中富含东莨菪素和东莨菪苷,且具有重要的潜在保健功效,能够为茶叶功能性成分开发和茶树资源多元化利用提供重要参考.






 DownLoad:
DownLoad: